Mirikizumab jako indukční a udržovací léčba ulcerózní kolitidy
Mirikizumab je humanizovaná monoklonální protilátka IgG4, která se specificky váže na podjednotku p19 interleukinu 23. Na základě výsledků klinických studií fáze III byl mirikizumab registrován Evropskou lékovou agenturou (EMA) pro léčbu středně těžké až těžké aktivní ulcerózní kolitidy u dospělých pacientů, u nichž konvenční nebo biologická léčba nejsou dostatečně efektivní, ztratily účinnost nebo způsobují nepřijatelné nežádoucí účinky [1]. Publikace D’Haense a kol. podává přehled o studiích LUCENT‑1 a LUCENT‑2 [2].
Ulcerózní kolitida je chronické onemocnění tlustého střeva a konečníku, při němž slizniční zánět způsobuje krvácení z konečníku, je příčinou zvýšené frekvence stolic, nucení na stolici a bolestí břicha [3]. V současnosti dostupné terapie jsou zatíženy zvýšeným rizikem výskytu infekcí nebo karcinomu, nedostatečnou odpovědí na primární léčbu nebo ztrátou klinického přínosu v průběhu času [4–6].
Interleukin 23 (IL‑23) je prozánětlivý cytokin, který se skládá ze dvou složek, podjednotky p40 sdílené s IL‑12 a unikátní podjednotky p19 [7]. Ustekinumab, monoklonální protilátka cílící na p40 IL‑12 a IL‑23, je schválen pro léčbu ulcerózní kolitidy a Crohnovy choroby. Z monoklonálních protilátek cílících na p19 IL‑23 je risankizumab schválen pro terapii Crohnovy choroby, guselkumab je ve fázi klinického hodnocení pro léčbu stejného onemocnění [8–13].
Mirikizumab jako humanizovaná monoklonální protilátka IgG4, která se specificky váže na p19 IL‑23, prokázal účinnost ve studii fáze II u pacientů s ulcerózní kolitidou [14,15]. Studie fáze III LUCENT‑1 a LUCENT‑2 doložily účinnost a bezpečnost indukční a udržovací léčby mirikizumabem u pacientů se středně těžkou až těžkou aktivní ulcerózní kolitidou.
Studie LUCENT‑1 a LUCENT‑2
LUCENT‑1 byla 12týdenní randomizovaná studie s indukční terapií, LUCENT‑2 pak 40týdenní randomizovaná studie s udržovací terapií. Obě klinické studie byly dvojitě zaslepené, placebem kontrolované s paralelními skupinami. Vhodní pacienti (ve věku 18–80 let) měli při screeningu středně těžkou až těžkou aktivní ulcerózní kolitidu. Závažnost onemocnění byla hodnocena pomocí modifikovaného Mayo skóre (na stupnici od 0 do 9, přičemž vyšší skóre indikovalo větší závažnost). Pacienti museli mít hodnotu uvedeného skóre 4–9 s endoskopickým subskóre 2–3 (rozsah 0–3, vyšší hodnota indikovala větší závažnost). Zařazeni byli nemocní, u nichž selhala konvenční léčba – nedostatečná odpověď, ztráta odpovědi na léčbu, intolerance léčby alespoň jedním léčivem ze skupiny kortikosteroidů nebo imunomodulátory pro terapii ulcerózní kolitidy – nebo biologická léčba či léčba inhibitorem Janus kinázy (tofacitinibem) [2].
V průběhu sledování mohli pacienti užívat perorální kyselinu 5‑aminosalicylovou, perorální kortikosteroidy nebo imunomodulátory azatioprin, 6‑merkaptopurin a metotrexát ve stabilních dávkách. Perorální kortikosteroidy byly během studie sledující indukční léčbu udržovány ve stabilních dávkách, které byly snižovány v průběhu studie s udržovací terapií u pacientů, u nichž byla zaznamenána odpověď na léčbu ve sledování LUCENT‑1. Vyloučeni byli nemocní dříve exponovaní protilátkám anti‑IL‑12 a anti‑IL‑23 p40 nebo anti‑IL‑23 p19 nebo ti, u kterých selhala léčba třemi nebo více biologickými léky. Všichni pacienti, kteří dokončili studii LUCENT-1 bez ohledu na klinickou odpověď nebo zařazení do zkušební skupiny, byli způsobilí k účasti ve studii LUCENT-2 [2].
Uspořádání studií
V nultém týdnu studie LUCENT-1 byli pacienti náhodně rozděleni do skupin v poměru 3 : 1 k podávání mirikizumabu v dávce 300 mg nebo placeba intravenózně každé čtyři týdny (tj. v týdnech 0, 4 a 8). Randomizace byla stratifikována podle selhání léčby biologikem nebo tofacitinibem (ano/ne), výchozího použití kortikosteroidů (ano/ne), výchozí aktivity onemocnění (modifikované Mayo skóre 4–6 nebo 7–9) a zeměpisné oblasti (Severní Amerika, Evropa nebo jiné). Pacienti, kteří měli klinickou odpověď na léčbu mirikizumabem v týdnu 12 (definována jako pokles o ≥ 2 body v modifikovaném Mayo skóre se snížením o ≥ 30 % oproti výchozí hodnotě a zároveň buď poklesem od výchozí hodnoty o ≥ 1 bod v subskóre rektálního krvácení, nebo s jeho hodnotou 0 nebo 1), podstoupili ve studii sledující udržovací léčbu opět randomizaci.
Ve studii LUCENT‑2 byli pacienti náhodně rozděleni v poměru 2 : 1 k podávání mirikizumabu v dávce 200 mg nebo placeba (vysazení mirikizumabu) subkutánně každé čtyři týdny po dobu dalších 40 týdnů (celkem 52 týdnů léčby). Randomizace v této studii byla stratifikována podle selhání léčby biologikem nebo tofacitinibem (ano/ne), stavu remise ve 12. týdnu studie LUCENT-1 (ano/ne), užívání kortikosteroidů (ano/ne) a zeměpisné oblasti (Severní Amerika, Evropa nebo jiné) [2].
Pacienti zařazení do placebové skupiny, u nichž byla zaznamenána klinická odpověď na léčbu během studie LUCENT-1, ve studii LUCENT-2 nadále dostávali zaslepené placebo. Nemocní v kterékoliv skupině, u kterých došlo ke ztrátě odpovědi ve 12. týdnu nebo po týdnu studie LUCENT-2, přerušili udržovací léčbu mirikizumabem nebo placebem a byla jim otevřeně podána záchranná léčba třemi dávkami mirikizumabu (300 mg) intravenózně každé čtyři týdny. Pacienti, kteří během studie LUCENT-1 nereagovali na mirikizumab nebo placebo, dostávali ve studii LUCENT-2 v otevřeném uspořádání prodlouženou indukční terapii s dalšími třemi dávkami mirikizumabu (300 mg) intravenózně každé čtyři týdny a byla u nich znovu posouzena klinická odpověď ve 12. týdnu sledování (tj. v týdnu 24 z celkového 52týdenního období). Nemocní s klinickou odpovědí (ve srovnání s výchozím stavem studie s indukční léčbou) ve 12. týdnu dostávali otevřeně mirikizumab (200 mg) subkutánně každé čtyři týdny jako udržovací léčbu do 40. týdne. Pacienti, kteří nereagovali na prodlouženou indukční léčbu, byli z testování vyloučeni [2].
Hodnocení účinnosti a bezpečnosti
Primárním cílovým ukazatelem ve studii LUCENT‑1 byla klinická remise ve 12. týdnu. K sekundárním cílovým ukazatelům hodnoceným ve 12. týdnu patřily alternativní definice klinické remise, klinická odpověď, endoskopická remise, ústup příznaků, klinická odpověď u pacientů se selháním léčby biologikem nebo tofacitinibem, histologicko‑endoskopické zlepšení stavu sliznice, zmírnění nucení na stolici (měřeno pomocí škály Numeric Rating Scale, NRS) [16]. Alternativní definice klinické remise je zahrnuta v nejnovějším návrhu pokynů amerického Úřadu pro kontrolu potravin a léčiv (FDA) jako preferovaná definice pro budoucí studie s pacienty s ulcerózní kolitidou [17].
Primárním cílovým ukazatelem ve studii LUCENT‑2 byla klinická remise ve 40. týdnu. Sekundární cílové ukazatele zahrnovaly alternativní definici klinické remise, endoskopickou remisi, klinickou remisi bez kortikosteroidů, histologicko‑endoskopickou slizniční remisi, zmírnění nucení na stolici (skóre NRS), remisi střevní urgence (skóre NRS) a udržení klinické remise [2].
Výsledky
Charakteristika pacientů
LUCENT-1 probíhala od června 2018 do ledna 2021 a LUCENT-2 od října 2018 do listopadu 2021. Ve studii LUCENT‑1 bylo randomizováno 1 281 pacientů. V rámci modifikované populace na základě statistické analýzy bylo 1 162 pacientů náhodně rozděleno do skupin s intravenózně podávaným mirikizumabem v dávce 300 mg (868 osob) nebo placebem (294 osob). Ve studii LUCENT‑2 bylo 544 pacientů s klinickou odpovědí na indukční léčbu mirikizumabem náhodně rozděleno do skupin, jimž byly subkutánně podávány mirikizumab v dávce 200 mg (365 osob) nebo placebo (179 osob). Celková doba léčby činila 52 týdnů [2].
Charakteristiky pacientů byly podobné ve všech skupinách obou studií. Podíl nemocných se selháním léčby biologikem nebo tofacitinibem a nemocných se závažnějším onemocněním dle endoskopického vyšetření byl vyšší v otevřené prodloužené indukci oproti kohortě osob, u nichž byla doložena klinická odpověď ve studii sledující indukční léčbu [2].
Indukční léčba
Ve 12. týdnu studie LUCENT‑1 byl podíl pacientů s klinickou remisí vyšší ve skupině s mirikizumabem než ve skupině s placebem (24,2 % vs. 13,3 %; rozdíl 11,1 procentního bodu; 99,875% interval spolehlivosti [CI] 3,2–19,1; p < 0,001). Tyto výsledky byly podobné výsledkům pro alternativní definici klinické remise (25,6 % ve skupině s mirikizumabem vs. 14,6 % ve skupině s placebem; p < 0,001). Lepší výsledky pro skupinu s mirikizumabem byly zaznamenány v případě hlavních sekundárních cílových ukazatelů: klinické odpovědi, endoskopické remise, remise příznaků v týdnech 4 a 12, klinické odpovědi u pacientů se selháním předchozí léčby biologikem nebo tofacitinibem, histologicko‑endoskopického zlepšení stavu sliznice a nucení na stolici (p < 0,001 pro všechna srovnání), graf 1A–C. V závislosti na testované skupině a období bylo 3,8–39,1 % pacientů klasifikováno jako nemocní bez odpovědi na léčbu v důsledku vysazení mirikizumabu nebo placeba nebo přijetí záchranné terapie mirikizumabem. V podskupině pacientů se selháním léčby biologikem nebo tofacitinibem byl podíl osob, které splnily všechny sekundární cílové parametry, vyšší ve skupině s mirikizumabem oproti placebové skupině [2].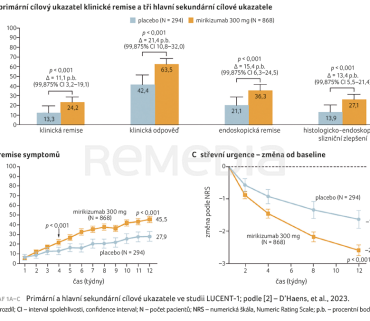
Udržovací léčba
Ve 40. týdnu studie LUCENT‑2 byla u 49,9 % pacientů ve skupině s mirikizumabem a u 25,1 % pacientů ve skupině s placebem zaznamenána klinická remise (rozdíl 23,2 procentního bodu; 95% CI 15,2–31,2; p < 0,001). Tyto výsledky byly podobné výsledkům pro alternativní definici klinické remise (54,9 % ve skupině s mirikizumabem vs. 27,0 % ve skupině s placebem; p < 0,001). Podíl pacientů s klinickou remisí, klinickou remisí bez kortikosteroidů, udržením klinické remise, endoskopickou remisí, histologicko‑endoskopickou slizniční remisí a remisí střevní urgence byl významně vyšší ve skupině s mirikizumabem ve srovnání s placebovou skupinou. Mezi nemocnými léčenými mirikizumabem, kteří se ve 40. týdnu nacházeli v klinické remisi, celkem osob 97,8 % neužívalo kortikosteroidy. Zlepšení ve skóre NRS od výchozí hodnoty bylo setrvalé po celou dobu studie LUCENT-2 ve skupině s mirikizumabem, zatímco u pacientů s placebem byla zjištěna částečná ztráta zlepšení, jehož bylo dosaženo během studie LUCENT-1 (graf 2A, B). V podskupině pacientů se selháním léčby biologikem nebo tofacitinibem byl podíl osob, které splnily primární a hlavní sekundární cílové parametry studie s udržovací terapií ve 40. týdnu, vyšší ve skupině s mirikizumabem oproti placebové skupině [2].
Mezi 272 pacienty, kteří ve studii LUCENT-1 nereagovali na léčbu mirikizumabem a kteří poté dostávali otevřenou indukční léčbu mirikizumabem ve studii LUCENT-2, byla u 53,7 % doložena klinická odpověď a u 11,4 % klinická remise do 12. týdne; 144 z 272 pacientů (52,9 %) byla podávána udržovací léčba mirikizumabem. Klinická remise byla zachována u 72,2 % těchto pacientů a 36,1 % mělo klinickou remisi ve 40. týdnu. V podskupině nemocných se selháním léčby biologikem nebo tofacitinibem, kteří nereagovali na indukční léčbu mirikizumabem, mělo 46,3 % klinickou odpověď na prodlouženou indukční léčbu ve 12. týdnu [2].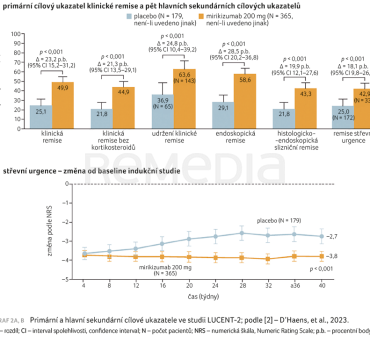
Bezpečnostní cílové ukazatele
Incidence nežádoucích účinků byla podobná ve skupinách s mirikizumabem a ve skupinách s placebem v průběhu obou studií.
Z celkového počtu 1 217 pacientů léčených mirikizumabem během placebem kontrolovaných a nekontrolovaných (tj. otevřené prodloužené indukční a otevřené udržovací) testovacích period byly oportunní infekce pozorovány u 15 osob – infekce herpes zoster u šesti (u 5 pacientů během placebem kontrolovaných období a u 1 pacienta během období bez placeba), kandidóza u čtyř (u 2 pacientů během každého období), cytomegalovirové onemocnění u čtyř (u 2 pacientů během každého období) a střevní tuberkulóza u jedné osoby (během placebem kontrolovaného období). Oportunní infekce (herpes zoster) se vyskytla u jednoho pacienta, který dostával placebo ve studii LUCENT-1 [2].
Během 52týdenního léčebného období byl mezi 1 217 pacienty s mirikizumabem hlášen výskyt karcinomu u osmi osob. Kolorektální adenokarcinom byl zjištěn u dvou pacientů ve studii LUCENT-1 a nemelanomový karcinom kůže a karcinom žaludku vždy u jednoho pacienta v průběhu dvojitě zaslepené části studie LUCENT-2. V otevřených obdobích studie s udržovací léčbou byl spinocelulární karcinom hlášen u dvou pacientů a kolorektální adenokarcinom, rektální karcinom a Kaposiho sarkom vždy u jednoho pacienta. Kolorektální adenokarcinom pozorovaný v otevřených obdobích studie LUCENT-2 byl dříve hlášen u stejného pacienta ve studii LUCENT-1. U pacientů, kteří dostávali placebo ve studii LUCENT-1, žádný karcinom zjištěn nebyl. Jeden další případ adenokarcinomu u pacienta léčeného mirikizumabem ve studii LUCENT‑1 byl odhalen až při sledování po léčbě, a není tedy zahrnut do celkového počtu osmi osob s karcinomem [2].
Zvýšení aktivity jaterních enzymů bylo častější u pacientů léčených mirikizumabem oproti pacientům s placebem. Jeden pacient léčený mirikizumabem v kohortě s otevřenou prodlouženou indukční terapií ve studii LUCENT-2 měl zvýšené koncentrace alaninaminotransferázy a celkového bilirubinu bez příčiny, která by vysvětlila abnormality laboratorních výsledků; hodnoty se upravily po vysazení mirikizumabu. Bezprostřední hypersenzitivní reakce byly ve studii LUCENT-1 častější ve skupině s mirikizumabem oproti placebu, avšak nevyskytly se žádné závažné hypersenzitivní nebo anafylaktické příhody. Reakce v místě vpichu byly častější ve skupině s mirikizumabem v porovnání s placebem během placebem kontrolované udržovací periody. Dvě nežádoucí příhody v podobě bolesti v místě vpichu byly závažné, ostatní byly mírné až střední závažnosti. Ve studii LUCENT-2 byla deprese hlášena u čtyř pacientů, kteří dostávali mirikizumab, u pacientů s placebem se nevyskytla. Deprese byla zjištěna v průběhu otevřeného udržovacího období u dvou pacientů léčených mirikizumabem, u kterých nebyla zaznamenána odpověď na úvodní indukční léčbu mirikizumabem. Jeden případ deprese s pokusem o sebevraždu byl hlášen u pacienta léčeného mirikizumabem, který měl pokusy o sebevraždu v anamnéze [2].
Diskuse
Ve studiích LUCENT‑1 a LUCENT‑2 vedla léčba mirikizumabem k významně vyššímu podílu pacientů s remisí (primární cílový ukazatel) v porovnání s placebem a pacientů, kteří splnili kritéria pro klíčové sekundární cílové ukazatele po dobu 12 týdnů a 40 týdnů. Současná doporučení pro léčbu ulcerózní kolitidy zahrnují stále přísnější cíle nad rámec symptomatického nebo endoskopického zlepšení, např. řešení akutní infiltrace zánětlivých buněk, která je pozorovatelná při histologickém vyšetření [4,18]. V souladu s tím byla v závěru studie LUCENT-2 požadována v rámci složeného sekundárního cílového ukazatele histologicko‑endoskopické slizniční remise absence slizničních neutrofilů, které se hromadí při přetrvávajícím akutním zánětu způsobeném ulcerózní kolitidou [19]. Recentní odborná literatura doporučuje absenci intraepiteliálních neutrofilů jako minimální požadavek pro remisi na základě histologického vyšetření [20,21]. Po jednom roce léčby mirikizumabem ve studiích LUCENT‑1 a LUCENT‑2 více než 40 % pacientů nemělo žádné slizniční neutrofily.
Novinkou v obou studiích bylo zahrnutí sekundárních cílových ukazatelů týkajících se střevní urgence [22,23]. Mnoho pacientů s ulcerózní kolitidou považuje tento aspekt za důležitější než rektální krvácení nebo frekvenci stolice [24,25]. K měření tohoto cílového parametru byla vyvinuta škála NRS [16]. Ve studii LUCENT-1 pacienti hlásili zmírnění střevní urgence při léčbě mirikizumabem, která přetrvávala i v průběhu studie LUCENT-2.
Infekce herpes zoster se vyskytla častěji u pacientů ve skupinách s mirikizumabem (celkově u dvou pacientů vs. u jednoho pacienta ve skupině s placebem ve studii LUCENT-1). U nemocných s infekcí herpes zoster nebyla doložena jasná souvislost s použitím kortikosteroidů nebo imunomodulátorů.
Karcinom žaludku se vyskytl při léčbě mirikizumabem u jednoho pacienta původem z Japonska, kde je známa vysoká incidence tohoto typu nádorového onemocnění [26]. Kolorektální karcinom byl detekován u tří pacientů (z nichž dva byli léčeni mirikizumabem) na konci studie s indukční léčbou, v období sledování po léčbě nebo během prodloužené indukce. Vzhledem k závažnosti zánětu sliznice mohly být tyto karcinomy přítomny v počátku studie, ale nebyly endoskopií odhaleny. Tato situace nastala těž v jiných studiích fáze III, nelze to však jednoznačně potvrdit [27]. Zvýšení hodnot jaterních enzymů bylo častější ve skupinách s mirikizumabem v porovnání s placebovými skupinami; jeden pacient měl zvýšené koncentrace alaninaminotransferázy a celkového bilirubinu bez zjevné příčiny, která by vysvětlovala abnormality v rámci laboratorního vyšetření. Elevace hodnot jaterních enzymů byla pozorována při léčbě inhibitory IL‑23 p19, které jsou schváleny pro jiné indikace, a také u jiných léků pro léčbu ulcerózní kolitidy včetně přípravků proti tumor nekrotizujícímu faktoru (anti‑TNF) [11,12,28]. Během studie s udržovací léčbou byla deprese častěji zaznamenána ve skupině s mirikizumabem oproti skupině s placebem (u čtyř pacientů vs. žádný). Nazofaryngitida a artralgie byly rovněž častější ve skupinách s mirikizumabem ve srovnání s placebem.
Závěr
Studie fáze III LUCENT‑1 a LUCENT‑2 potvrdily, že po dobu 12 týdnů a 40 týdnů byla léčba mirikizumabem účinná v indukční i udržovací periodě napříč klinickými, symptomatickými, endoskopickými a histologickými měřeními aktivity onemocnění, a to i po selhání léčby konvenčními imunosupresivy, biologickou terapií nebo tofacitinibem. U malého počtu pacientů léčených mirikizumabem se vyvinuly oportunní infekce nebo karcinom. Probíhají další a dlouhodobé studie za účelem přesnějšího posouzení účinnosti a bezpečnosti léčby mirikizumabem u pacientů s ulcerózní kolitidou nebo Crohnovou chorobou.
Literatura
[1] Omvoh (mirikizumab). Přehled EMA 2023. Dostupné na: https://www.ema.europa.eu/en/documents/overview/omvoh‑epar‑medicine‑overview_cs.pdf
[2] D’Haens G, Dubinsky M, Kobayashi T, et al. Mirikizumab as Induction and Maintenance Therapy for Ulcerative Colitis. N Engl J Med 2023; 388: 2444–2455.
[3] Ordás I, Eckmann L, Talamini M, et al. Ulcerative colitis. Lancet 2012; 380: 1606–1619.
[4] Rubin DT, Ananthakrishnan AN, Siegel CA, et al. ACG clinical guideline: ulcerative colitis in adults. Am J Gastroenterol 2019; 114: 384–413.
[5] D’Haens G. Systematic review: second‑generation vs. conventional corticosteroids for induction of remission in ulcerative colitis. Aliment Pharmacol Ther 2016; 44: 1018–1029.
[6] Baumgart DC, Le Berre C. Newer biologic and small‑molecule therapies for inflammatory bowel disease. N Engl J Med 2021; 385: 1302–1315.
[7] Croxford AL, Mair F, Becher B. IL‑23: one cytokine in control of autoimmunity. Eur J Immunol 2012; 42: 2263–2273.
[8] Stelara. Horsham, PA: Janssen Biotech; 2016 (package insert).
[9] Irving PM, Abreu M, Axler J, et al. DOP84 Risankizumab maintenance therapy results in sustained improvements in endoscopic outcomes in patients with moderate to severe Crohn’s disease: post‑hoc analysis from the phase 3 study FORTIFY. J Crohn’s Colitis 2022; 16: i127–i128.
[10] Ferrante M, Panaccione R, Baert F, et al. Risankizumab as maintenance therapy for moderately to severely active Crohn’s disease: results from the multicentre, randomised, double‑blind, placebo‑controlled, withdrawal phase 3 FORTIFY maintenance trial. Lancet 2022; 399: 2031–2046.
[11] Skyrizi. Chicago: AbbVie, 2022 (package insert).
[12] Tremfya. Horsham, PA: Janssen Biotech, 2020 (package insert).
[13] Sandborn WJ, D’Haens GR, Reinisch W, et al. Guselkumab for the treatment of Crohn’s disease: induction results from the phase 2 GALAXI‑1 study. Gastroenterology 2022; 162: 1650–1664.e8.
[14] Sandborn WJ, Ferrante M, Bhandari BR, et al. Efficacy and safety of mirikizumab in a randomized phase 2 study of patients with ulcerative colitis. Gastroenterology 2020; 158: 537–549.e10.
[15] Sandborn WJ, Ferrante M, Bhandari BR, et al. Efficacy and safety of continued treatment with mirikizumab in a phase 2 trial of patients with ulcerative colitis. Clin Gastroenterol Hepatol 2022; 20: 105–115.e14.
[16] Dubinsky MC, Irving PM, Panaccione R, et al. Incorporating patient experience into drug development for ulcerative colitis: development of the Urgency Numeric Rating Scale, a patient‑reported outcome measure to assess bowel urgency in adults. J Patient Rep Outcomes 2022; 6: 31.
[17] Food and Drug Administration. Ulcerative colitis: developing drugs for treatment. Guidance for industry. April 2022. Dostupné na: https://www.fda.gov/media/158016/download
[18] Danese S, Roda G, Peyrin‑Biroulet L. Evolving therapeutic goals in ulcerative colitis: towards disease clearance. Nat Rev Gastroenterol Hepatol 2020; 17: 12.
[19] Fournier BM, Parkos CA. The role of neutrophils during intestinal inflammation. Mucosal Immunol 2012; 5: 354–366.
[20] Pai RK, Hartman DJ, Rivers CR, et al. Complete resolution of mucosal neutrophils associates with improved long‑term clinical outcomes of patients with ulcerative colitis. Clin Gastroenterol Hepatol 2020; 18: 2510–2517.e5.
[21] Magro F, Doherty G, Peyrin‑Biroulet L, et al. ECCO Position paper: Harmonization of the approach to ulcerative colitis histopathology. J Crohns Colitis 2020; 14: 1503–1511.
[22] Hibi T, Ishibashi T, Ikenoue Y, et al. Ulcerative colitis: disease burden, impact on daily life, and reluctance to consult medical professionals: results from a Japanese internet survey. Inflamm Intest Dis 2020; 5: 27–35.
[23] Petryszyn PW, Paradowski L. Stool patterns and symptoms of disordered anorectal function in patients with inflammatory bowel diseases. Adv Clin Exp Med 2018; 27: 813–818.
[24] Louis E, Ramos‑Goñi JM, Cuervo J, et al. A qualitative research for defining meaningful attributes for the treatment of inflammatory bowel disease from the patient perspective. Patient 2020; 13: 317–325.
[25] van Deen WK, Obremskey A, Moore G, et al. An assessment of symptom burden in inflammatory bowel diseases to develop a patient preference‑weighted symptom score. Qual Life Res 2020; 29: 3387–3396.
[26] Sekiguchi M, Oda I, Matsuda T, Saito Y. Epidemiological trends and future perspectives of gastric cancer in eastern Asia. Digestion 2022; 103: 22–28.
[27] Rutgeerts P, Sandborn WJ, Feagan BG, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353: 2462–2476.
[28] Rossi RE, Parisi I, Despott EJ, et al. Anti‑tumour necrosis factor agent and liver injury: literature review, recommendations for management. World J Gastroenterol 2014; 20: 17352–17359.