Nazální aplikace farmak a její indikace pohledem anesteziologa
Nazální aplikace farmak má dlouhou historii. Indiáni Jižní Ameriky šňupali různé psychoaktivní substance, v současnosti se takto užívá především heroin nebo kokain. Nazální cestou se ale aplikují i četná léčiva – v anesteziologii jsou to především sedativa, analgetika, jejich kombinace a specifičtí antagonisté. Dále jsou v klinické praxi či ve fázi výzkumu například oxytocin, ženské pohlavní hormony, gonadorelin, glukagon nebo léčiva proti migréně.
Nazální způsob podání je nebolestivý, dobře akceptovatelný, nástup a odeznění účinku jsou rychlé. Farmaka se vstřebávají nejen nosní sliznicí, ale i přímo čichovými neurony do mozku a mozkomíšního moku. Nové nazální aplikátory – MAD a MADomitor – znamenají usnadnění nazálního podání léčiv a rozšíření tohoto způsobu aplikace do různých odvětví medicíny. Mezi indikace patří první pomoc, tlumení pooperační bolesti, premedikace nebo rehabilitace.
Pohled do historie
Nazální aplikace farmakologicky účinných látek je starého data. Nejstarším způsobem podání je šňupání, při němž se účinné látky vstřebávají nosní sliznicí a působí celkově na organismus. Šňupání pochází z Ameriky. Indiáni používali tabák nejen ke kouření, ale i ke šňupání. Nejstarší látka používaná ke šňupání byla pravděpodobně paricá neboli niopo a vyráběla se ze semen akácie (Acacia niopo). Šňupání sloužilo pro povzbuzení nálady při rituálních slavnostech.
V Evropě se stalo šňupání oblíbeným ve středověku. Bylo součástí tzv. purgační léčby.
Nazální aplikace se zneužívala i k travičství. Porta [1, 2] znal homicidum per nasum.
Lewin [3] píše, že ke konci 18. století žili v Paříži traviči, kteří svým obětem nabízeli otrávený šňupavý tabák – po jeho aplikaci do nosu se brzy dostavil spánek a oběti byly oloupeny. Někdy mohl tento spánek vyústit i ve smrt. Vlastní účinnou látkou, která měla hypnotické účinky, byla semena durmanu (Datura stramonium či Datura metel). Ještě nyní jsou stejné látky přidávány do omamných cigaret. V současné době je šňupán zejména kokain a heroin.
První klinickou studii o nazální aplikaci skopolaminu a atropinu provedli Hyde, Tonndorf, Chinn a Field v roce 1953 [4, 5]. Studie byla vojenského charakteru a zabývala se především výhodami nazálního podávání farmak při otravě organofosfáty a bojovými plyny. Na základě této práce začal MUDr. Otakar Bořík, DrSc., emeritní primář oddělení ORL nemocnice v Karlových Varech, testovat v polovině 20. století podání různých farmak nazální cestou. Jednalo se především o skopolamin k premedikaci dětí před ORL výkony, pilokarpin, kyselinu nikotinovou, klonidin, histamin a některá diuretika. Léčiva aplikoval v různých želatinových roztocích [1, 2].
Fyziologické aspekty
V nosní dutině nacházíme tři funkční oblasti – vestibulum nasi (přibližně 0,6 cm2), čichovou oblast určenou k čichové percepci (plocha asi 15 cm2) a respirační oblast (o celkové ploše o 150 cm2) sloužící jako systém ohřívání a zvlhčování vdechovaného vzduchu. Za jednu hodinu projde nosní dutinou 350–450 litrů vzduchu. Plocha nosní sliznice je značně zvětšena přítomností tří nosních skořep (conchae nasales). Sliznice dutiny nosní je kryta víceřadým řasinkovým cylindrickým epitelem. Nosní sekret je posunován řasinkami proti choanám rychlostí 3–12 mm za minutu, to znamená, že průměrně každých 20 minut je obnoven sekret na celé ploše nosní sliznice [6]. Transport hlenu řasinkami je ovlivňován mnoha faktory, z nichž na prvním místě je to vlhkost vzduchu. Nosní sliznice je bohatě vaskularizovaná. Na konvexitách dolní a střední lastury je vyvinut kavernózní systém, který má podobnou stavbu jako topořivá tělesa genitálu. Tento systém velmi pružně reaguje změnou svého objemu na mechanické, chemické, tepelné i infekční podněty a tím také mění průchodnost nosu.
Faktory, které ovlivňují biologickou dostupnost nazálně aplikovaných farmak, jsou četné – především molekulová hmotnost léčiva, rozpustnost látky v tucích, pH roztoku a pKa farmaka, jeho koncentrace a objem, technologické zpracování (použití urychlovačů vstřebávání), místo působení léčiva, způsob aplikace, distribuce a velikost kapek, krevní průtok nosní sliznicí, aktivita cílií a eventuálně patologické podmínky, které ovlivňují nosní funkce. Obecně dosahuje vyšší biologické dostupnosti léčivo ve formě spreje než ve formě kapek.
V poslední době se ukazuje, že při nazální aplikaci existuje přímé spojení nos–mozek. Část vstřebaného léčiva se dostává venózní krví přímo do intrakraniálních vén komunikací mezi oftalmickými vénami, plexus pterygoideus a sinus cavernosus. Farmaka se však také vstřebávají čichovou sliznicí perineurálním prostorem čichových neuronů přímo do subarachnoidálního prostoru a mozkomíšního moku [7, 8].
Výhody nazálního podání farmak
Mezi hlavní výhody nazální cesty podání patří snadnost aplikace a akceptovatelnost. To znamená, že tato cesta je snadno přijatelná i u dětí na rozdíl od například rektálního způsobu podání. Způsob aplikace je nebolestivý. Nazální aplikace má rychlý nástup účinku. Již během 3 minut od aplikace pozorujeme první známky účinku, vrcholu účinku je dosaženo za 10–15 minut. Rychlost nástupu účinku je vyšší než při bukální aplikaci a je dosaženo vyšších plazmatických hladin a tím i intenzivnějšího účinku. Účinek je krátkodobý a dobře řiditelný. Lze jej titrovat – můžeme frakcionovaně přidávat malé dávky farmaka každých 5–15 minut.
Podobně jako u jiných alternativních způsobů podání dochází k obejití first pass efektu v játrech. Kromě toho, jak bylo již uvedeno, dochází částečně k přímému vstupu farmaka do mozku a mozkomíšního moku čichovou sliznicí a tím je nástup účinku rychlejší. Biologická dostupnost aplikovaných farmak se pohybuje nad hodnotou 50 % – u alfentanilu 65 % a sufentanilu okolo 88 %, u midazolamu 50–75 %, u ketaminu 50 %, u dexmedetomidinu 50 % a u naloxonu dokonce 90 % [9–13].
Léčiva podávaná nazálně
Nazální aplikace se může uplatnit především v premedikaci dětí, je vhodná pro útlum křečové aktivity, při tlumení pooperační bolesti i při podání specifických antagonistů, např. při předávkování heroinem [14]. Nazální aplikace se využívá především pro benzodiazepiny, opioidy, ketamin, ?2-agonisty a jejich kombinace. Také specifičtí antagonisté se vstřebávají nosní sliznicí velmi rychle.
Z benzodiazepinů se podává nazálně k navození anxiolýzy a sedace především midazolam [15]. V závislosti na dávce má anxiolytické, amnestické, sedativní, antikonvulzivní, centrálně svalově relaxační a hypnotické účinky. Vzhledem ke svému pH však způsobuje nepříjemné pálení nosní sliznice. Vhodná je proto předchozí aplikace lokálního anestetika lidokainu ve formě 2% roztoku. Nepoužíváme xylokain 4% sprej, který způsobuje rovněž pálení na nosní sliznici.
Opioidy jsou podávány především k navození analgezie a také sedace (obr. 1, 2). Jsou to hlavně fentanyl a jeho 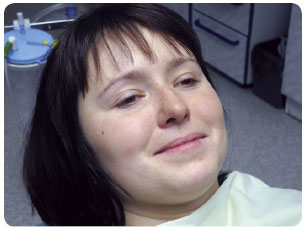 deriváty – sufentanil, alfentanil i remifentanil [16–19]. Fentanyl je používán jako nazální sprej k tlumení průlomové bolesti při onkologických onemocněních. V jednom vstřiku může být dávka 50 µg, 100 µg nebo 200 µg fentanylu. Biologická dostupnost činí 89 %. Maximální plazmatické hladiny je dosaženo za 12–15 minut. Další variantou nosního spreje s obsahem fentanylu je jeho kombinace s pektinem. Pektin spolu s fentanylem se při kontaktu s nosní sliznicí změní v gel, který modifikuje vstřebávání tohoto opioidu, zároveň se snižuje množství tekutiny, která se dostane do nosohltanu. Právě pektin reaguje s kalciem v nosní sliznici a tak přispívá ke změně viskozity roztoku. Jedna dávka
deriváty – sufentanil, alfentanil i remifentanil [16–19]. Fentanyl je používán jako nazální sprej k tlumení průlomové bolesti při onkologických onemocněních. V jednom vstřiku může být dávka 50 µg, 100 µg nebo 200 µg fentanylu. Biologická dostupnost činí 89 %. Maximální plazmatické hladiny je dosaženo za 12–15 minut. Další variantou nosního spreje s obsahem fentanylu je jeho kombinace s pektinem. Pektin spolu s fentanylem se při kontaktu s nosní sliznicí změní v gel, který modifikuje vstřebávání tohoto opioidu, zároveň se snižuje množství tekutiny, která se dostane do nosohltanu. Právě pektin reaguje s kalciem v nosní sliznici a tak přispívá ke změně viskozity roztoku. Jedna dávka 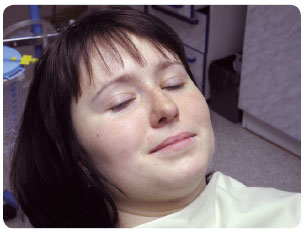 obsahuje 100 µg nebo 200 µg fentanylu [20].
obsahuje 100 µg nebo 200 µg fentanylu [20].
Z disociativních anestetik je to ketamin a jeho pravotočivý izomer S+ketamin. Ketamin má unikátní farmakodynamické účinky. V závislosti na dávce má sedativní, analgetické, kataleptické a anestetické účinky [21, 22]. Je používán k tlumení akutní i chronické bolesti. Vzhledem ke své velké terapeutické šíři a malému ovlivnění kardiorespiračních parametrů je používán v armádě a v medicíně katastrof.
α2-agonisté se váží na adrenergní α2-receptory. Působí zcela specifickou sedaci. Svým centrálním sympatolytickým účinkem snižují krevní tlak i srdeční frekvenci. Nejčastěji je používán dexmedetomidin a klonidin. Na rozdíl od jiných léčiv nastupuje plný účinek po nazální aplikaci teprve za 20 až 30 minut [23].
Flumazenil podáváme titračním způsobem v dávce 0,1 mg nazálně. Účinek nastupuje již za 2 minuty od aplikace. Flumazenil se vyznačuje vysokou biologickou dostupností. Je indikován při nadměrné sedaci benzodiazepiny jak u dětí, tak u dospělých [24].
Naloxon podáváme v dávce 0,2–0,4 mg
nazálně při dechové depresi po podání opioidů, u drogově závislých může vyvolat abstinenční příznaky [14].
Často můžeme využít synergický účinek kombinace jmenovaných farmak.
Uplatnění nazální aplikace
Nazální způsob aplikace léčiv se může uplatnit v mnoha odvětvích medicíny.
Analgosedace dětí
Zklidnění obtížně ošetřitelných dětí představuje dosud závažný problém. Často víceméně násilné ošetření zvyšuje strach z další návštěvy lékaře. I při použití celkové anestezie je nutno zajistit žílu k aplikaci farmaka, což často představuje náročnou situaci spojenou s velkou obranou dítěte. K sedaci se používá především midazolam per os. Je však hořký. Řada dětí odmítá nápoj s midazolamem vypít. U malých dětí je možná rektální aplikace midazolamu eventuálně s ostatními farmaky. Některé děti, i malé, však tento způsob aplikace odmítají. Nabízí se proto možnost nazální aplikace midazolamu. V závislosti na svém pH však působí nepříjemné pálení nosní sliznice. Je vhodná předchozí aplikace lokálního anestetika. Nástup účinku je rychlý, stupeň dosažené sedace závisí na dávce [15, 24, 25]. Základní dávkování midazolamu u malých dětí je 0,3–0,5 mg/kg.
Antikonvulzivní účinek midazolamu v dávce 0,3 mg/kg se s úspěchem využívá při křečové aktivitě, např. při epileptickém záchvatu u dětí. Vhodná je nazální premedikace, např. před aplikací oxidu dusného.
K navození analgezie dětí je vhodný fentanyl v dávce 1–2 µg/kg. Vhodná je kombinace s inhalační analgosedací s oxidem dusným spolu s kyslíkem v procentuálním poměru 50 : 50. U dětí se dále užívá sufentanil v dávce 0,5–1 µg/kg. Při vyšším dávkování již hrozí výrazná dechová deprese [16, 17]. Další možností jsou kombinace midazolamu v dávce 0,3 mg/kg spolu se sufentanilem v dávce 0,7–1 µg/kg. Doporučuje se také kombinace sufentanilu v dávce 0,5 µg/kg spolu s ketaminem v dávce 0,5 mg/kg nazálně [26]. Alfentanil se podává u dětí v dávce 100 µg/kg.
Dávka dexmedetomidinu k analgosedaci dětí je zpravidla 2–3 µg/kg. Nástup účinku po nazální aplikaci je prodloužen na 20 minut, vrchol účinku nastává za 30 minut [27]. Dosažený stupeň sedace je hlubší než po midazolamu. Možná je také kombinace midazolamu v dávce 0,5 mg/kg per os a dexmedetomidinu v dávce 2 µg/kg nazálně k zesílení sedace.
K sedaci a analgezii dětí se používá také ketamin v dávce 3–6 mg/kg [28]. Problémem je příliš velký objem. Proto v Americe používají koncentraci 100 mg/ml, u nás je dostupná pouze koncentrace 50 mg v 1 ml. Je možné použít kombinace midazolamu v dávce 0,2–0,3 mg/kg s ketaminem v dávce 5 mg/kg. Problémem je opět velký objem. K slabší sedaci a analgezii stačí ketamin v dávce 2 mg/kg. Výhoda nazální aplikace ketaminu spočívá v jeho lokálně anestetickém účinku.
V rámci první pomoci
K základním úlohám záchranné služby patří zajištění anxiolýzy, sedace a analgezie. V případě těžkostí zajištění žíly, např. u obézních osob nebo u popálených, se nabízí nazální aplikace farmak. K navození anxiolýzy a sedace je vhodný především midazolam, který minimálně ovlivňuje kardiorespirační parametry. K navození analgezie, např. při akutním infarktu myokardu nebo u popálených, je vhodná aplikace sufentanilu v celkové dávce 10–20 µg. Titračním způsobem můžeme sufentanil přidávat dle účinku.
V rámci první lékařské pomoci je možno aplikovat nazálně ketamin, eventuálně v kombinaci s midazolamem. Stanovení optimální dávky ketaminu podávaného nazálně je předmětem výzkumu.
Zcela zvláštní postavení má nazální aplikace v medicíně katastrof. Nehody s postižením většího počtu osob jsou časté. Je nutno improvizovat. Za této akutní situace bývá nedostatek zdravotnických pracovníků, a proto se uplatní zejména paramedici. Nazální aplikace farmak je snadná, neinvazivní. Opět se uplatní především opioidy a midazolam. Americká armáda testuje v současné době ketamin nazálně v dávce 30–50 mg k tlumení akutní bolesti. Těmito dávkami jsou kognitivní bolesti ovlivněny nevýznamně. Rovněž ovlivnění kardiorespiračního systému je klinicky nevýznamné. K tlumení úzkosti je vhodný midazolam aplikovaný nazálně. Nazální aplikace se může uplatnit při zklidňování panických reakcí lidí, např. při požáru [29].
Pooperační bolest
Slizniční aplikace farmak (nazální, sublinguální, bukální) je vhodná pro akutní i chronickou léčbu bolesti. Aplikace je neinvazivní, bezbolestná a bez rizika infekce. Je snadno proveditelná rodinnými příslušníky a vítaná i u pacientů s poruchami polykání.
Opioidy lze s výhodou nazálně aplikovat k tlumení akutní pooperační bolesti. Mezi pionýry výzkumu v této oblasti patří prof. Striebel, který testoval k této indikaci fentanyl, alfentanil i pethidin [30, 31].
Pacient si může při léčení pooperační bolesti nazálně aplikovat opioidy rovněž sám – tento způsob aplikace je označován zkratkou PCINA (patient controlled intranasal analgesia).
V Basileji probíhá studie o nazální aplikaci S+ketaminu k tlumení pooperační bolesti po výkonech na páteři [32]. Ketamin nebo S+ketamin může být také podáván v nízkých dávkách nazálně, zejména k tlumení neuropatické bolesti [33].
Chronická versus akutní bolest
Nazální aplikace farmak se může uplatnit velmi dobře v hospicích. Zde jsou hlavními problémy častá chronická bolest a úzkost. Farmaka podávaná per os jsou často málo účinná a nástup účinku je příliš pomalý (zvláště při průlomových bolestech). Někteří pacienti nemohou polykat nebo mají obstrukci gastrointestinálního systému. Rektální podání je u mnohých pacientů a jejich rodinných příslušníků sociálně málo akceptovatelné. Intramuskulární nebo subkutánní aplikace je invazivní (hrozí určité nebezpečí infekce) a bolestivá, navíc nevhodná pro kontrolu bolesti v delším časovém období. Oba způsoby podání jsou těžko realizovatelné rodinnými příslušníky. Intravenózní aplikace představuje zlatý standard kontroly bolesti. Je vhodná zejména při prudkém, náhlém zesílení bolesti. Je však také invazivní, s určitým rizikem infekce. Nemůže být prováděna rodinnými příslušníky.
Pro hospic jsou vhodné především opioidy – fentanyl a jeho deriváty, alfentanil a sufentanil, je možno vyzkoušet také morfin. K navození anxiolýzy je vhodný midazolam.
Předávkování opioidů nebo benzodiazepin
Nazální aplikace je velmi účinná při předávkování opioidů nebo benzodiazepinů. Bylo to prokázáno např. při nazální aplikaci naloxonu při předávkování heroinu. K nástupu účinku došlo za 2 minuty od aplikace. Nízká dávka naloxonu může vyvoláním abstinenčních příznaků prokázat nedovolený příjem opioidů.
Flumazenil, specifický antagonista benzodiazepinů, může být použit nazálně k antagonizování účinků benzodiazepinů [24].Premedikace před vyšetřením. Řada endoskopických vyšetření je nepříjemná nebo i bolestivá. Proto je zapotřebí vhodné premedikace. Ta se provádí často intravenózně, např. podáním kombinace midazolamu s fentanylem. Metoda vyžaduje přísné sledování kardiorespiračních parametrů. Nazální aplikace midazolamu v dávce 2–5 mg a fentanylu v dávce 1 µg/kg navodí analgosedaci s menším rizikem vzniku dechové deprese.
Vyšetření NMR a CT (nukleární magnetická rezonance, počítačová tomografie) trvají často déle a jsou provázena nepříjemným a hlasitým hlukem. Existuje větší skupina pacientů, která při uzavření tunelu NMR trpí klaustrofobickými pocity. Pro tyto pacienty je vhodný midazolam podávaný nazálně v celkové dávce 2–4 mg [29].
K tlumení úzkosti je vhodné podávat midazolam 5 mg nazálně, k nástupu účinku dochází za 5 minut. Analgezii je možno potencovat sufentanilem aplikovaným nazálně v dávce 10–15 µg. V současné době testujeme remifentanil v dávce 5–7 µg/kg.
Rehabilitace
Při rehabilitaci po různých zraněních dochází k bolesti, která brání cvičení, a tak i zlepšení celkového stavu. Proto je důležitá dobře řiditelná krátkodobá analgezie. Při sériové zlomenině žeber byl výhodně použit alfentanil v dávce po 250 µg nazálně k následné rehabilitaci.
Stomatologie
Také ve stomatologii dospělých se může uplatnit nazální aplikace farmak. K navození anxiolýzy a sedace lze podat dexmedetomidin v dávce 1–2 µg/kg. Nepůsobí pálení nosní sliznice, ale nástup účinku je opožděn na 20–30 minut [27]. Před aplikací midazolamu v celkové dávce 2,5–5 mg podáme lidokain (1 ml 2% roztoku). Pak následuje aplikace midazolamu. Kombinace dexmedetomidinu v dávce 1 µg/kg spolu s midazolamem v celkové dávce 2–3 mg má synergický účinek.
Nazální forma remifentanilu se dosud nachází v klinických zkouškách. O nazální aplikaci existuje ve světové literatuře pouze jedna citace [16]. Máme kladné zkušenosti s použitím remifentanilu v dávce 7 µg/kg nazálně před stomatochirurgickými výkony, kdy účinek nastupuje do 5 minut a trvá 20 minut, s možností prodloužení podáním poloviny aplikované dávky; významný je výrazný anxiolytický efekt. Dosažená analgezie značně tlumí bolest při aplikaci lokálních anestetik. Psychomotorické zotavení je rychlé.
Způsoby nazální aplikace
V současné době je nejvhodnější formou nazálního podání farmak sprej. Jednou z možností je použít nosní aplikátor 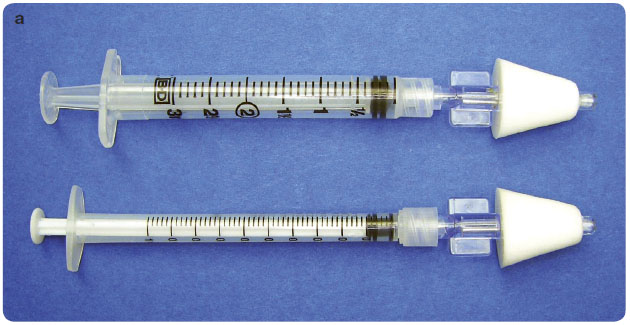 MAD (Mucosal atomic device), který se nasadí na injekční stříkačku s roztokem léčiva (obr. 3a). Průchodem farmak nazálním aplikátorem, který má na špičce jemnou trysku, dochází ke vzniku aerosolu o velikosti částic 30 µm až 100 µm (obr. 4). Aerosolové částice se pak jako jemná mlha rozprostírají po nosní sliznici, odkud jsou absorbovány.
MAD (Mucosal atomic device), který se nasadí na injekční stříkačku s roztokem léčiva (obr. 3a). Průchodem farmak nazálním aplikátorem, který má na špičce jemnou trysku, dochází ke vzniku aerosolu o velikosti částic 30 µm až 100 µm (obr. 4). Aerosolové částice se pak jako jemná mlha rozprostírají po nosní sliznici, odkud jsou absorbovány.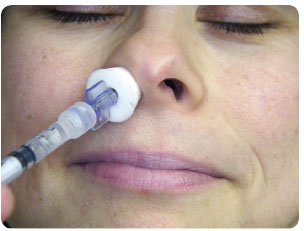
 Dalším prostředkem k nazálnímu podání léčiv, který zaručuje jednoduchou, účinnou a cílenou topickou aplikaci a přesné dávkování, je MADomitor – samostatná lahvička s objemovou pumpou a s ohybatelnou kanylou (obr. 3b). Pumpa zajišťuje jednostranný pohyb tekutiny chlopní a pružná kanyla umožňuje aplikaci farmak v každé pozici pacienta.
Dalším prostředkem k nazálnímu podání léčiv, který zaručuje jednoduchou, účinnou a cílenou topickou aplikaci a přesné dávkování, je MADomitor – samostatná lahvička s objemovou pumpou a s ohybatelnou kanylou (obr. 3b). Pumpa zajišťuje jednostranný pohyb tekutiny chlopní a pružná kanyla umožňuje aplikaci farmak v každé pozici pacienta.
Závěr
Nazální podání představuje jeden z netradičních způsobů aplikace farmak. Je nebolestivý, s velmi rychlým nástupem účinku. Účinek je dobře titrovatelný a tím i dobře řiditelný. Spolu s novými aplikačními pomůckami, které umožňují jemnou aerosolovou aplikaci, představuje rozšíření možností aplikace léčiv.
Nazální způsob podání se může uplatnit v různých oblastech medicíny – od pediatrie až po hospicovou péči. Je používán zejména k premedikaci dětí, ale i dospělých, k navození analgezie v pooperační akutní bolesti i v podmínkách záchranné služby u popálených a polytraumatických pacientů. Jednoduchý způsob aplikace umožňuje i paramedikům, nebo dokonce rodinným příslušníkům podat léčivo. Pacient si může aplikovat farmaka nazálně také sám. Nazální aplikace farmak by se mohla uplatnit i ve veterinární medicíně k premedikaci psů (především medetomidin). Zde hraje opět důležitou úlohu nebolestivý způsob podání.
Nazální způsob aplikace tak přispívá k dalšímu rozšíření spektra farmakologických možností pro navození sedace, anxiolýzy a analgezie.
Práce vznikla s podporou grantů VG 20102015041, VG 20102015014 a IGA NT 11284-4.
Seznam použité literatury
- [1] Bořík O. Příspěvek k dějinám slizniční resorpce léků v otolaryngologii. Praktický lékař 1982; 62: 100–103.
- [2] Bořík O. Resorpční schopnost sliznice dýchacích cest. Plzeňský lékařský sborník, Suppl. 14/1964, SPN 8–72.
- [3] Lewin L. Gifte in der Weltgeschichte. Berlin, 1921.
- [4] Hyde RW, Tonndorf J, Chinn HI, Field R. Absorption from the Nasal mucous Membrane. Ann Otol Rhinol Laryngol 1953; 62: 957–968.
- [5] Tonndorf J, Hyde RW, Chinn HI, et al. Absorption from the Nasal mucous Membrane: Systemic effect of hyoscine following intranasal administration. Ann Otol Rhinol Laryngol 1953; 62: 630–641.
- [6] Djakow J, Svobodová T, Uhlík J, et al. Primární ciliární dyskineze, Část 1. – Patogeneze a klinický obraz. Alergie 2009; 11: 45–50.
- [7] Jansson B. Models for the Transfer of Drugs from the Nasal Cavity to the Central Nervous System. Medicínská disertace, Uppsala, 2004, 46 str.
- [8] Espefält U. Olfactory Transfer of Analgesic Drugs After Nasal Administration. Medicínská disertace, Uppsala, 2007, 64 str.
- [9] Merlin MA, Saybolt M, Kapitanyan R, et al. Intranasal naloxone delivery is an alternative to intravenous naloxone for opioid overdoses. Am J Emerg Med 2010; 28: 296–303.
- [10] Loimer N, Hofmann P, Chaudhry HR. Nasal administration of naloxone is as effective as the intravenous route in opiate addicts. Int J Addict 1994; 29: 819–827.
- [11] Iirola T, Vilo S, Manner T, et al. Bioavalilability of dexmedetomidine after intranasal administration. Eur J Clin Pharmacol 2011; 67: 825–831.
- [12] Malinovsky JM, Servin F, Cozian A, et al. Ketamine and norketamine plasma concentrations after i.v., nasal and rectal administration in children. Brit J Anaesth 1996; 77: 203–207.
- [13] Dale O, Hjortkjaer R, Kharasch ED. Nasal administration of opioids for pain management in adults. Acta Anaesthesiol Scand 2002; 46: 759–770.
- [14] Barton ED, Ramos J, Colwell C, et al. Intranasal administration of naloxone by paramedics. Prehosp Emerg Care 2002; 6: 54–58.
- [15] Fösel Th, Hack C, Knoll R, et al. Nasal midazolam in children: Plasma concentrations and the effect on respiration. Pediatric anaesthesia 1995; 5: 347–535.
- [16] Verghese ST, Hannallah RS. Brennan M. The effect of intranasal administration of remifentanil on intubating conditions and airway response after sevoflurane induction of anesthesia in children. Anesth Analg 2008; 107: 1176–1181.
- [17] Henderson JM, Brodsky DA, Fischer DM, et al. Pre-induction of anesthesia in pediatric patients with nasally administered sufentanil. Anesthesiology 1988; 68: 671–675.
- [18] Karl HW, Keifer AT, Rosenberger JL, et al. Comparison of the safety and efficacy of intranasal midazolam or sufentanil for preinduction of anesthesia in pediatric patients. Anestesiology 1992; 76: 209–215.
- [19] Vercauteren M, Boeckx E, Hanegreefs G, et al. Intranasal sufentanil for pre-operative sedation. Anaesthesia 1988, 270–273.
- [20] Radbruch L, Torres LM, Ellershaw JE, et al. Long-term tolerability, efficacy and acceptability of fentanyl pectin nasal spray for breakthrough cancer pain. Support Care Cancer 2012; 20: 565–573.
- [21] Weksler N, Ovadia L, Muati G, Stav A. Nasal ketamine for paediatric premedication. Can J Anaesth 1993; 40: 119–121.
- [22] Weber F, Wulf H, Gruber M, Biallas R. S-ketamine and s-norketamine plasma concentrations after nasal and i.v. administration in anesthetized children. Paediatr Anaesth 2004; 14: 983–988.
- [23] Talon MD, Woodson LC, Sherwood E, et al. Nasal dexmedetomidine is comparable to midazolam as a preoperative sedative for children. Anesthesiology 2007; Suppl 107: 1398.
- [24] Kulbe J. The use of ketamine nasal spray for short-term analgesia. Home Healthcar Nurse 1998; 16: 367–370.
- [25] Suter-Zimmermann K. Transmucosal nasal drug delivery, Systemic Bioavailability of Nasally Applied Midazolam, Dissertation, Basel 2008.
- [26] Nielsen B, et al. Nasal Administration of Sufentanil + Ketamine for Procedure-related Pain in Children. In http://clinicaltrials.gov/ct2/show/NCT01047241.
- [27] Rosen DA, Daume JT. Short duration large dose dexmedetomidine in a pediatric patient during procedural sedation. Anesth Analg 2006; 103: 68–69.
- [28] Diaz JH. Intranasal ketamine preinduction of paediatric outpatients. Pediatr Anaesth 1997; 7: 273–278.
- [29] Schweizer E, Clary C, Dever AI, Mandos LA. The use of low-dose intranasal midazolam to treat panic disorder: a pilot study. J Clin Psychiatry 1992; 53: 19–22.
- [30] Striebel HW, Koenigs D, Kramer J. Postoperative pain management by intranasal demand-adapted fentanyl titration. Anestesiology 1992; 77: 281–285.
- [31] Scheepers LD, Montgomery CJ, Kinahan AM, et al. Plasma concentrations of flumazenil following intranasal administration in children. Can J Anesth 2000; 47: 120–124.
- [32] Ruppen W, et al. The analgesic effect of combined treatment with intranasal S-ketamine and intranasal midazolam (NASKEMI). http://clinicaltrials.gov/ct2/show/NCT01275547
- [33] Striebel HW, Pommerening J, Rieger A. Intranasal fentanyl titration for postoperative pain management in an unselected population. Anaesthesia 1993; 48: 753–757.