Neuroendokrinní tumory trávicího traktu a možnosti jejich léčby
Gastroenteropankreatické neuroendokrinní tumory (GEP NET) představují heterogenní skupinu relativně vzácně se vyskytujících nádorů, které se strukturálně, histogeneticky i biologickým chováním liší od běžných epitelových nádorů. Během posledních dvou desetiletí dochází ke vzestupu jejich incidence a prevalence. Klinická symptomatologie souvisí nejen s lokálním působením nádoru, ale je často spojena i s nadprodukcí hormonů. Nejčastější chybnou diagnózou je dráždivý tračník. GEP NET nádory exprimují somatostatinové receptory. Rozložení jednotlivých receptorů může vysvětlovat a před zahájením léčby i predikovat léčebnou odpověď a dosud biologicky neuspokojivě vysvětlený antineoplastický účinek somatostatinových analog. Zavedení somatostatinových analog do paliativní léčby bylo významným průlomem v léčbě. Diagnostika a léčba se neobejde bez těsné týmové spolupráce řady odborníků různých specializací.
Definice
Gastroenteropankreatické neuroendokrinní tumory (GEP NET) představují heterogenní skupinu relativně vzácně se vyskytujících nádorů, které se strukturálně, histogeneticky i biologickým chováním liší od běžných epitelových nádorů. Definujícím znakem NET je endokrinní diferenciace nádorových buněk spojená se schopností produkovat, hromadit a uvolňovat biologicky aktivní látky hormonální povahy. Histogeneticky jsou GEP NET odvozovány od endokrinních buněk gastrointestinálního traktu a Langerhansových ostrůvků pankreatu nebo spíše od prekurzorů těchto buněk.
Po zjištění, že endokrinní buňky gastrointestinálního traktu jsou schopny dekarboxylovat 5-hydroxytryptofan na 5-hydroxytryptamin (serotonin), následovalo jejich označení termínem APUD buňky (amine precursor uptake and decarboxylation). Toto označení se nyní opouští a je prosazován pojem difuzní neuroendokrinní systém (DNES).
Epidemiologie a genetika
GEP NET jsou považovány za vzácné, nicméně jejich incidence a prevalence významně narůstá [1]. V současnosti se incidence v ČR odhaduje na 2–3/100 000 obyvatel. Incidence se liší také podle zemí, což můžeme vysvětlovat i různou úrovní zdravotní péče. K problémům přispívá i okolnost, že až donedávna neexistovala jednotná klasifikace onemocnění.
Převážná většina NET se vyskytuje ve formě sporadických nádorů, jež někdy mohou být i vícečetné. Asi u 5–25 % GEP NET nemocných je endokrinně aktivní nádor součástí syndromu mnohočetné endokrinní neoplazie 1. typu (MEN-1), v rámci něhož se současně vyskytují endokrinně aktivní nádory příštítných tělísek a adenohypofýzy [2].
Klasifikace
Neuroendokrinní nádory je možné klasifikovat podle několika kritérií. Podle lokalizace vyplývající z embryonálních vztahů se dělí na nádory předního střeva (foregut), středního střeva (midgut) a zadního střeva (hindgut). K nádorům předního střeva se řadí nádory plic, thymu, žaludku, duodena a pankreatu. Tato skupina je značně heterogenní, což se projevuje pestrou klinickou symptomatologií a značně variabilní produkcí humorálních působků. Nádory středního střeva představují nádory jejuna, ilea, appendixu a céka. Nádory zadního střeva jsou lokalizovány v tračníku a rektu a často jsou hormonálně neaktivní.
Podle typu humorálního produktu jsou klasifikovány především nádory pankreatu, dříve označované jako nesidiomy.
Vývoj poznání se odrazil i v terminologii a výsledkem byla klasifikace vydaná WHO v roce 2000 a následně upravená v letech 2003–2005. Nová klasifikace vychází z předpokladu, že nádory jsou definovány nejen histomorfologickým obrazem, ale i pozitivitou markerů neuroendokrinní diferenciace, především chromograninů, synaptofysinu, neuron specifické enolázy. Klasifikace navíc přesněji definuje hodnocení biologického chování. Pro všechny oblasti trávicího ústrojí byly stanoveny tři hlavní kategorie endokrinně aktivních nádorů: 1. dobře diferencovaný NET (karcinoid), 2. dobře diferencovaný neuroendokrinní karcinom (maligní karcinoid), 3. nízce (špatně) diferencovaný neuroendokrinní karcinom (malobuněčný karcinom).
Stupeň maligního chování (G-grade) je určován na základě mitotické a proliferační aktivity nádorových buněk, cytologické atypie nemají při tomto hodnocení podstatnější význam. Dobře diferencované NET nesou většinou označení G1, pokud splňují kritéria pro nádor G2, je u nich větší riziko maligního chování. Dobře diferencované 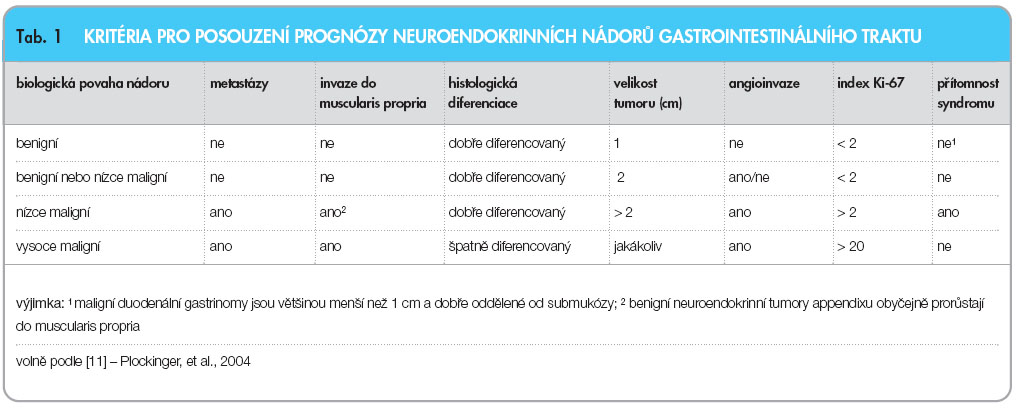 neuroendokrinní karcinomy mohou být buď G1 nebo G2. Všechny nádory splňující kritéria nádorů G3 jsou hodnoceny jako vysoce maligní a odpovídající nízce diferencovanému neuroendokrinnímu karcinomu [3, 4]. Více viz tab. 1. Klinické projevy
neuroendokrinní karcinomy mohou být buď G1 nebo G2. Všechny nádory splňující kritéria nádorů G3 jsou hodnoceny jako vysoce maligní a odpovídající nízce diferencovanému neuroendokrinnímu karcinomu [3, 4]. Více viz tab. 1. Klinické projevy
NET mohou být provázeny specifickým syndromem vyvolaným hypersekrecí hormonů, což odlišuje „funkční“ nádory od „nefunkčních“. U tzv. nefunkčních nádorů jsou příznaky způsobeny pouze růstem nádorové hmoty. Z toho vyplývá, že klinický obraz onemocnění může být velmi pestrý, v závislosti na způsobu růstu primárního nádoru a charakteru produktu nádorových buněk. Závažnost příznaků NET se může pohybovat od velmi nenápadných symptomů až po těžké, život ohrožující projevy, mezi něž řadíme karcinoidovou krizi, metabolický rozvrat a dehydrataci při přítomnosti VIPomu (nádor s nadprodukcí vazoaktivního intestinálního polypeptidu), či těžkou protrahovanou hypoglykemii u inzulinomu. Studie publikovaná v roce 2004 uvádí medián prodlevy do stanovení správné diagnózy abdominálního karcinoidu 66 měsíců, nejčastější chybnou diagnózou byl dráždivý tračník (u 45 % pacientů, zpoždění 64 měsíců) [2].
Stanovení diagnózy
Diagnóza NET se opírá o analýzu klinického nálezu a hodnocení výsledků pomocných vyšetření. Nález vysoké koncentrace hormonu při typické symptomatologii podporuje diagnózu. Následuje lokalizace nádoru, dle možnosti určení primárního zdroje a zajištění histologického nálezu a staging (určení rozsahu nádoru). Mezi vyšetřovací metody řadíme lokalizační techniky, což jsou konvenční zobrazovací metody, endoskopická a izotopová vyšetření. 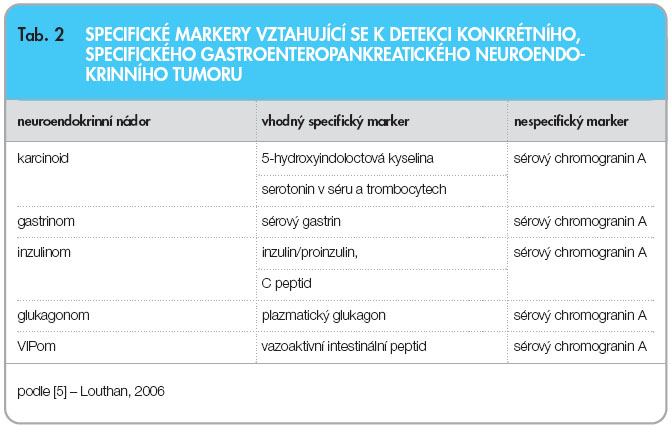 Funkční diagnostika zahrnuje biochemická vyšetření, stanovení různých onkomarkerů. Negativní laboratorní výsledky neznamenají nutně nepřítomnost nádoru, neboť se mohou uplatňovat některé faktory maskující jeho průkaz. Řada NET nevykazuje sekreční aktivitu nebo produkuje látky, které běžně nestanovujeme. Produkce může být také epizodická a hladina produktu může být ve chvíli odběru nízká. Proto je věnována pozornost nespecifickým markerům, jako je např. chromogranin A, který je nezávislý na biologické aktivitě NET [5]. Více viz tab. 2.
Funkční diagnostika zahrnuje biochemická vyšetření, stanovení různých onkomarkerů. Negativní laboratorní výsledky neznamenají nutně nepřítomnost nádoru, neboť se mohou uplatňovat některé faktory maskující jeho průkaz. Řada NET nevykazuje sekreční aktivitu nebo produkuje látky, které běžně nestanovujeme. Produkce může být také epizodická a hladina produktu může být ve chvíli odběru nízká. Proto je věnována pozornost nespecifickým markerům, jako je např. chromogranin A, který je nezávislý na biologické aktivitě NET [5]. Více viz tab. 2.
Somatostatinové receptory
Somatostatin je polypeptidový hormon, který je exprimován v centrálním nervovém systému, v C-buňkách štítné žlázy, v endokrinních buňkách gastrointestinální sliznice a v D-buňkách pankreatu. Řadíme jej do skupiny „brain-gut“ hormonů, vyskytuje se i ve tkáních, které nejsou neuroendokrinního původu, např. v aktivovaných lymfocytech. V různých tkáních vykonává somatostatin různé biologické funkce, v závislosti na lokalizaci působí jako hormon, neurohormon, transmiter nebo parathormon (PTH).
Somatostatinové receptory (SSTR) patří k superrodině (superfamily) receptorů se sedmi transmembránovými doménami. Pro somatostatin bylo dosud identifikováno 5 podtypů specifických membránových receptorů SSTR1–5. Geny pro jednotlivé podtypy receptorů jsou lokalizovány na různých chromozomech, což naznačuje nejen individuální transkripční kontrolu každého z nich, ale i jejich rozdílnou funkčnost. Účinek somatostatinu a současně analog somatostatinu je ovlivněn především typem receptoru, přes který je uskutečňován. Zdá se, že SSTR mají různé funkce v různých typech tkání. Byla popsána schopnost SSTR tvořit homodimery a heterodimery, přičemž dochází ke vzniku receptoru s odlišnými vlastnostmi.
Midgut karcinoidy exprimují somatostatinové receptory ve více než 90 %, 85 % karcinoidů exprimuje SSTR2 nebo SSTR5. SSTR se vyskytují i mimo okruh NET, např. exprimují je nádory prsu, prostaty, ledvin, ovaria, meningeomy, gliomy, některé lymfomy. Metastázy GEP NET rovněž exprimují receptory. Každý tumor exprimuje více než 1 receptorový subtyp, nejčastěji se jedná o SSTR2. Stupeň exprese se mění dokonce i ve tkáni jednoho nádoru. Dobře diferencované karcinoidy exprimují SSTR více, oproti málo diferencovaným agresivně rostoucím. Přítomnost receptorů má velký význam jak pro diagnostiku, tak pro terapii neuroendokrinních nádorů. Receptory slouží jako terapeutické cíle, skrze které lze dosáhnout symptomatické kontroly, ale také protinádorového účinku. Některé práce naznačují, že rozložení jednotlivých typů somatostatinových receptorů může vysvětlovat a před zahájením léčby i predikovat lepší léčebnou odpověď a dosud biologicky neuspokojivě vysvětlený antineoplastický účinek somatostatinových analog [6].
Terapie
Chirurgické a endoskopické přístupy
Radikální odstranění nádorů je dosud jediným kurativním léčebným postupem. Malé polypózní nádory zejména žaludku, duodena nebo střeva můžeme odstranit metodou endoskopické polypektomie, případně lokální excizí. U větších NET žaludku se provádí gastrektomie s regionální lymfadenektomií. Nádory tenkého střeva se resekují i s disekcí regionálních uzlin. NET appendixu jsou nejčastěji diagnostikovány náhodně při zánětu appendixu, pokud je nádor menší než 2 cm, provádí se appendektomie dostatečným výkonem. Vzácně může nádor appendixu infiltrovat mesoappendix nebo serózu, pak je indikována pravostranná hemikolektomie. NET tlustého střeva, které není možné odstranit endoskopicky nebo pokud prorůstají do hlubších vrstev stěny, vyžadují resekci se snesením regionálních uzlin. Dobře ohraničené nádory pankreatu do 2 cm se léčí enukleací, případně parciální pankreatektomií. U nádorů větších rozměrů se provádí proximální pankreatoduodenektomie, subtotální pankreatektomie se splenektomií nebo totální pankreatektomie.
Svůj význam má i odstranění jaterních metastáz, i když jen s paliativním záměrem, protože zmenšením masy tumoru dojde ke zmírnění případného karcinoidového syndromu. Výjimečně jsou pacienti indikováni k transplantaci jater.
Hormonální léčba
Somatostatin má v trávicím ústrojí obecně inhibiční účinek. Biologický poločas přirozeného somatostatinu je jen několik minut a po ukončení aplikace infuze následuje hypersekrece hormonů v důsledku rebound fenoménu. Proto byla vyvinuta somatostatinová analoga, která mají specifickou afinitu ke somatostatinovým receptorům, především SSTR2 a SSTR5. Oktreotid a lanreotid mají podobné vazebné profily. Většina GEP NET exprimuje SSTR2, výjimku tvoří pankreatické tumory produkující inzulin, které SSTR2 exprimují v méně než 50 % případů. Účinek analog somatostatinu v léčbě NET je zprostředkován jednak přímo prostřednictvím vazby analoga na specifické somatostatinové receptory a také nepřímo prostřednictvím suprese uvolňování hormonů a růstových faktorů uplatňujících se v regulaci nádorového růstu. Mezi hlavní účinky analog patří kontrola symptomů u endokrinně aktivních neuroendokrinních nádorů, dále jsou popisovány také antiproliferační, antiangiogenní účinky a ve vyšších dávkách rovněž indukce apoptózy.
Omezení průjmu je docíleno zhruba u 40–50 % pacientů a potlačení flushe nastává u 50–70 % pacientů s klasickými midgut karcinoidy [7]. I další pacienti s nádory, jako jsou glukagonomy, tumory produkující vazoaktivní intestinální peptid a v menší míře i gastrinomy a metastazující inzulinomy, mají prospěch z léčby somatostatinovými analogy [7].
Léčbou s využitím analog můžeme docílit remise a/nebo stabilizace nádorových markerů asi u 70 % pacientů. K poklesu hladin např. chromograninu A dochází díky antisekrečnímu účinku oktreotidu a nelze ho interpretovat jako průkaz redukce nádorové masy. Některé studie uvádějí, že analoga působí i dlouhodobou prevenci srdečního postižení a fibrotizujících střevních procesů. Růst nádoru se většinou stabilizuje u 50 % pacientů, jen u malého počtu nemocných (do 9 %) dochází k jeho zmenšení. Analoga je vhodné použít i před výkony, které by mohly vyvolat karcinoidovou krizi.
Častým problémem při podávání analog je vznik tachyfylaxe nebo rezistence, která se vyskytuje u více než poloviny pacientů během dlouhodobé léčby. Většina pacientů preferuje pohodlnost aplikace jedné injekce depotního analoga za měsíc. Léčba analogy je obvykle dlouhodobá za předpokladu, že se nevyskytnou nezvladatelné nežádoucí účinky nebo pokud nedojde k úplné ztrátě kontroly nad projevy onemocnění. Analoga jsou bezpečná, s prověřeným bezpečnostním profilem a s omezenou toxicitou.
Vedlejší účinky somatostatinových analog nejsou příliš časté. Patří k nim malabsorpce tuku a vitaminů A a D, dysfunkce žlučníku, bolesti hlavy, průjmy, závratě a hypoglykemie či hyperglykemie. Přetrvávající steatoreu lze léčit suplementací pankreatických enzymů. Cholestáza s cholecystolitiázou se vyskytuje až u 60 % pacientů v důsledku inhibice cholecystokininu a produkce litogenní žluče. Profylaktická léčba chenodeoxycholovou kyselinou může zabránit vzniku kamenů. Pokud pacient absolvuje chirurgický výkon, je vhodné doplnit jej i preventivní cholecystektomií. Dalším nežádoucím účinkem je lokální bolest v místě injekce, během dlouhodobé léčby mohou vznikat ve svalu vazivové uzly s následnou sníženou koncentrací léčivé látky v krvi [7–12].
Další léčba
Interferon α se užívá v monoterapii nebo v kombinaci se somatostatinovými analogy, pokud ani nejvyšší dávka nepřináší dostatečný léčebný efekt. Nejlepší odpovědi na chemoterapii (až u 70 % pacientů) se dosahuje u nízce diferencovaných nádorů, které vykazují vysokou proliferační aktivitu. Tyto nádory nemají somatostatinové receptory. Nejčastěji se používá kombinace cisplatina plus etoposid, délka odpovědi je kolem 8–10 měsíců.
Cílená radionuklidová terapie je založena na schopnosti nádorových buněk exprimovat somatostatinové receptory a tím následně vázat izotopem označená somatostatinová analoga. Princip je obdobný jako u somatostatinové receptorové scintigrafie, jen beta-zářič používaný v diagnostice je nahrazen radionuklidem, který emituje záření gama. V poslední době se používá hlavně 177Lutetium DOTA oktreotid. Léčba je účinná u symptomatických inoperabilních či generalizovaných SSTR pozitivních nádorů a vede většinou ke stabilizaci onemocnění, regrese je výjimečná. Z vedlejších účinků se vyskytují hlavně myelosuprese a nefrotoxicita.
Embolizace, resp. chemoembolizace jaterních metastáz, je indikovaná u nemocných s neresekabilním jaterním postižením. Cílem léčby je zmenšení nádorové masy a snížení nadprodukce peptidů. Ke kontraindikacím patří úplná obstrukce portální žíly a jaterní insuficience.
Radiofrekvenční ablace (RFA) se provádí perkutánně pod kontrolou CT, laparoskopicky nebo při laparotomii. Metoda je založena na termické destrukci buněk ve tkáni, kterou prochází vysokofrekvenční střídavý elektrický proud. Maximální doporučená velikost ložiska, při níž lze dosáhnout zmenšení masy tumoru a tím i snížit nadprodukci hormonů, je tři centimetry. V průběhu dalších let očekáváme posun v biologické léčbě. V klinických studiích jsou jako potenciální léky zkoumány mimo jiné inhibitory mTOR (centrální regulátory buněčného metabolismu, růstu, proliferace i angiogenze) [13]. Došlo k objevu analoga, které se váže specificky na SSTR4 (somatoprim), v současnosti probíhá studie fáze I. Další zajímavou látku představuje dopastatin, jenž spojuje vlastnosti somatostatinového analoga a agonisty dopaminového receptoru [14]. Většina GEP NET totiž exprimuje nejen SSTR2, ale i dopaminové receptory D2.
Závěr
Seznam použité literatury
- [1] Yao JC, Hassan M, Phan A, et al. One hundred years after „carcinoid“: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol 2008; 26: 3063–3072.
- [2] Toth-Fejel S, Pommier RF. Relationships among delay of diagnosis, extent of disease, and survival in patients with abdominal carcinoid tumors. Am J Surg 2004, 187: 575–579.
- [3] Mandys V. Neuroendokrinní nádory zažívacího traktu – historie a současnost, Čes-slov Patol 2009; 45: 57–63.
- [4] Lukáš M, Louthan O, a kol. Neuroendokrinní nádory trávicího traktu. Maxdorf, Praha 2006.
- [5] Louthan O. Neuroendokrinní nádory. Klinické pohledy. Grada Publishing, Praha 2006, 1. vyd., 344 s.
- [6] Slaby O, Sachlova M, Bednarikova M, et al. Gene expression of somatostatin receptor 4 predicts clinical outcome of patients with metastatic neuroendocrine tumors treated with somatostatin analogs. Cancer Biother Radiopharm 2010; 25: 237–243.
- [7] Eriksson B, Oberg K. Summing up 15 years of somatostatin analog therapy in neuroendocrine tumors: future outlook. Ann Oncol 1999; 10 (Suppl 2): S31–38.
- [8] Honová H, et al. Karcinoid. Maxdorf, Praha 2004.
- [9] Oberg K. Somatostatin analog octreotide LAR in gastro-entero-pancreatic tumors. Expert Rev Anticancer Ther 2009; 9: 557–566.
- [10] Oberg KE, Rheubi JC, Kwekkeboom DJ, Krenning EP. Role of somatostatins in gastroenteropancreatic neuroendocrine tumor development and therapy. Gastroenterology 2010, 139: 742–753.
- [11] Plockinger U, Rindi G, Arnold R, et al. Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. A consensus statement on behalf of the European Neuroendocrine Tumour Society (ENETS). Neuroendocrinology 2004; 80: 394–424.
- [12] Plockinger U, Wiedenmann B, de Herder WW. ENETS Consensus Guidelines for the Standard of Care in Neuroendocrine Tumors. Neuroendocrinology 2009; 90: 159–161.
- [13] Yao JC, Phan AT, Chang DZ, et al. Efficacy of RAD001 (everolimus) and octreotide LAR in advanced low- to intermediate-grade neuroendocrine tumors: results of phase II study. J Clin Oncol 2008; 26, 4311–4318.
- [14] Jaquet P, Gunz G, Saveanu A, et al. BIM-23A760, a chimeric molecule directed towards somatostatin and dopamine receptors, vs universal somatostatin receptors ligands in GH-secreting pituitary adenomas partial responders to octreotide. J Endocrinol Invest 2005; 28, 21–27.