Nové fixní kombinace v terapii bronchiálního astmatu ‒ Atectura® a Enerzair® v práškovém inhalátoru Breezhaler®
Souhrn:
Krčmová I, Novosad J, Sedlák V. Nové fixní kombinace v terapii bronchiálního astmatu ‒ Atectura® a Enerzair® v práškovém inhalátoru Breezhaler®. Remedia 2021; 31: 197–205.
Recentně na jaře roku 2020 byly Evropskou lékovou agenturou registrovány dva inhalační léčivé přípravky, fixní kombinace léčiv určené k léčbě bronchiálního astmatu. Léčivý přípravek Atectura® Breezhaler® obsahuje fixní dvojkombinaci indakaterol/mometason furoát. Enerzair® Breezhaler® se skládá z fixní kombinace tří léčivých látek ‒ indakaterol, glykopyrronium a mometason furoát. Držitelem rozhodnutí o registraci je farmaceutická společnost Novartis. Léčebné kombinace jsou obsaženy v tobolkách, které se podávají jednou denně pomocí práškového inhalátoru Breezhaler®. Léčivý přípravek Atectura® Breezhaler® je indikován jako udržovací léčba astmatu u dospělých a dospívajících ve věku od 12 let, u nichž terapie inhalačními kortikosteroidy a krátkodobě působícími β2 adrenergními agonisty nevedla k dostatečné kontrole astmatu. Enerzair® Breezhaler® směřuje k těžším astmatikům. Lék je indikován jako udržovací léčba astmatu u dospělých pacientů, kteří nejsou adekvátně kontrolováni udržovací kombinací dlouhodobě působícího β2 adrenergního agonisty/vysokou dávkou inhalačního kortikosteroidu a kteří prodělali jednu nebo více exacerbací astmatu v předchozím roce. Jedná se o vůbec první fixní trojkombinaci v inhalačním systému určenou k léčbě bronchiálního astmatu. Kombinace léčebných molekul v obou přípravcích se jeví dle současných studií jako slibný přístup v léčebném portfoliu astmatika.
Summary:
Krcmova I, Novosad J, Sedlak V. New fixed combinations in the therapy of bronchial asthma ‒ Atectura® and Enerzair® in Breezhaler® powder inhaler. Remedia 2021; 31: 197–205.
Recently, in the spring of 2020, two fixed‑combination inhaled medicinal products for the treatment of bronchial asthma were registered by the European Medicines Agency. Atectura® Breezhaler® contains a fixed dual combination of indacaterol/mometasone furoate while Enerzair® Breezhaler® consists of a fixed combination of three active substances ‒ indacaterol/mometasone furoate and glycopyrronium. The marketing authorization holder is the pharmaceutical company Novartis. The therapeutic combinations are in capsules that are administered once a day using a Breezhaler® powder inhaler. Atectura® Breezhaler® is indicated for the maintenance treatment of asthma in adults and adolescents from 12 years of age in whom therapy with inhaled corticosteroids and short‑acting β2 adrenergic agonists has not led to adequate control of asthma. Enerzair® Breezhaler® is aimed at more severe asthmatics. The drug is indicated as maintenance treatment of asthma in adult patients who are not adequately controlled on a maintenance combination of a long‑acting β2 agonist and a high‑dose inhaled corticosteroid and who have experienced one or more asthma exacerbations in the previous year. This is the first fixed triple combination in the inhalation system to treat bronchial asthma. According to current studies, the combination of therapeutic molecules in both preparations appears to be a promising approach in the asthma treatment portfolio.
Key words: bronchial asthma, inhalation therapy, fixed combination, Atectura® Breezhaler®, Enerzair® Breezhaler®
Úvod
V České republice se odhaduje počet astmatiků až na 800 000, z toho 5 % pacientů trpí těžkou formou perzistujícího astmatu. Bronchiální astma je velmi heterogenní onemocnění dýchacích cest. Jeho patogenetickou podstatou je chronický zánět průdušek spojený s jejich remodelací a bronchiální hyperreaktivitou (bronchial hyperreactivity, BHR) a variabilní, často reverzibilní obstrukcí. Astma je považováno za nevyléčitelné, ale díky potenciálu léčebných možností dobře léčitelné onemocnění. Cílem léčebné strategie je dosažení a udržení plné kontroly nad astmatem a omezení budoucích rizik s ireverzibilním poklesem funkce plic, součástí léčebného přístupu je zabránění nežádoucím účinkům farmakoterapie.
Lékař posuzuje tíži astmatu odvozenou od minimálního stupně farmakoterapie potřebné k dosažení plné kontroly. Tíže astmatu se v průběhu života astmatika může měnit a s ohledem na narůstající možnosti specifické léčby je zásadní určovat základní fenotyp astmatu, který vychází z alergologického vyšetření a přítomnosti eozinofilie. Pokud propojíme tyto jednoduché parametry s klinickým hodnocením (doba vzniku astmatu, přítomnost alergického terénu), můžeme eozinofilní astma rozdělit na dva základní fenotypy ‒ eozinofilní alergické astma a eozinofilní astma nealergické (type 2, high asthma). Třetí fenotyp, který představuje non eozinofilní nealergické astma (typ 2, low asthma), bývá spojen s nadváhou, jinými komorbiditami a s ženským pohlavím. U těchto astmatiků chybějí jak eozinofilie, tak klinicky významné alergie, je přítomna BHR a začíná s převahou v dospělosti [1,2]. Správně stanovená diagnóza astmatu pak bývá často celoživotní.
Farmakoterapie astmatu
V léčbě je preferována inhalační farmakoterapie směřující k potlačení zánětu a BHR. Základem farmakoterapie jsou kontrolující/preventivní antiastmatika, v nichž dominantní roli hrají inhalační kortikosteroidy (IKS). Včasné zahájení podávání IKS snižuje riziko ireverzibilních změn. Přidání inhalačních β2 agonistů s dlouhodobým, ev. ultradlouhodobým účinkem (long acting beta agonist/ultra long acting beta agonist, LABA/U LABA) k nízkým a středně vysokým dávkám IKS ve většině případů zlepšuje kontrolu lépe než navyšování dávek IKS (synergický účinek).
Molekuly typu LABA a U LABA se podávají zásadně pouze v kombinaci s IKS, buď ve dvou samostatných inhalátorech, nebo v jednom inhalátoru (tzv. fixní kombinace). Podání fixní kombinace zlepšuje compliance a adherenci pacientů k léčbě a zároveň zaručí podání (U) LABA pouze v kombinaci s IKS. Typ léku a dávka jsou voleny individuálně a léčba je upravována podle aktuálního stavu pacienta. Mechanismus synergie účinku IKS + LABA byl prokázán klinickými studiemi pro všechny kombinace IKS + (U) LABA. Je prokázáno, že přidání LABA k IKS přináší zlepšení kontroly nad astmatem (zlepšení funkce plic, redukci exacerbací a redukci výskytu příznaků se zlepšením kvality života).
Jako přídatnou bronchodilatační léčbu lze u dospělých pacientů nedostatečně kontrolovaných kombinací středně vysokých a vysokých dávek IKS/(U) LABA použít i dlouhodobě působící antagonisty muskarinových receptorů (ultra long acting muscarinic antagonist, U LAMA), např. tiotropium, glykopyrronium. Teofyliny kromě bronchodilatace vykazují v nízkých dávkách i přídatný protizánětlivý efekt. U některých fenotypů astmatu mohou mít částečný protizánětlivý efekt antileukotrieny (zástupce montelukast). Bohužel, indikace tohoto léku musí být zvažována, v březnu 2020 jej americký Úřad pro kontrolu potravin a léčiv (FDA) zařadil do tzv. black boxu s varováním před psychiatrickými nežádoucími účinky, jako jsou agrese, deprese, poruchy spánku a sebevražedné myšlenky.
Překryv astmatu a chronické obstrukční plicní nemoci (tzv. ACO, asthma COPD overlap) je logicky řešen prolnutím farmakoterapie astmatu a chronické obstrukční plicní nemoci (CHOPN), tj. vedle kombinace IKS s LABA i podávání kombinace s LAMA, U LABA.
Každý pacient by měl být vybaven úlevovým/záchranným lékem a zároveň dobře seznámen s omezenou rolí a riziky této léčby; jako úlevový lék se užívají inhalační β2 agonisté s rychlým nástupem účinku (rapid acting beta agonist/short acting beta agonist, RABA/SABA), pokud je pacient léčen LABA či U LABA a pokud RABA není již součástí fixní kombinace.
Zvláštní postavení zaujímá fixní kombinace IKS s LABA s rychlým nástupem účinku (formoterol), která je doporučena v léčbě jak úlevové již od prvního stupně astmatu, tak dlouhodobě udržovací (tzv. režimu SMART – single inhaler/maintenance and reliever therapy) [3‒5].
Pětistupňové dávkování a kombinace kontrolujících antiastmatik se řídí závažností stavu nemocného a odpovědí na dosavadní léčbu. Jednu z léčebných možností v 5. stupni farmakoterapie představuje biologická léčba zvolená dle typu zánětu, který je zásadní u konkrétního astmatika. Každý astmatik v 5. stupni terapie s terapií systémovými kortikosteroidy by měl být zhodnocen v centru pro těžké astma, zda má správně určenou diagnózu, léčené komorbidity a zda je vhodný k biologické léčbě. Ve vybraných situacích u pacientů s fixovanou těžkou obstrukcí je ke zvážení bronchiální termoplastika. U alergických astmatiků s dominantní vazbou na roztoče můžeme indikovat specifickou imunoterapii pomocí sublinguálních tablet s obsahem alergenů roztočů. Vždy v 5. terapeutickém kroku u těžkého astmatika se jedná o personalizovaný medicínský přístup [2].
Nové fixní kombinace Atectura® a Enerzair® v inhalačním systému Breezhaler®
Astma je díky kombinaci léčebných molekul dobře léčitelným onemocněním. Za předpokladu správné diagnózy (zahrnující určení fenotypu a tíže/kontroly astmatu) lze při adekvátní a řádně užívané léčbě u přibližně 95 % případů dosáhnout kontroly onemocnění [6].
Obě nově registrované inhalační fixní kombinace spojují, kromě inhalačního systému, dvě stejné léčebné molekuly ‒ mometason furoát (IKS) a indakaterol (U LABA). Enerzair jako první fixní trojkombinace v léčbě astmatu obsahuje navíc U LAMA glykopyrronium. Účinné molekuly jsou v lékové formě tobolek podávaných v jednom práškovém inhalačním systému Breezhaler.
Jedna tobolka přípravku Atectura Breezhaler obsahuje 150 µg indakaterolu (indacateroli acetas) a dávky IKS jsou ve třech silách – 80 µg/160 µg/320 µg mometasonu (mometasoni furoas). Jedna podaná inhalační dávka je pochopitelně nižší ‒ obsahuje 125 µg indakaterolu a 62,5 µg/127,5 µg/260 µg mometasonu [7].
Jedna tobolka přípravku Enerzair Breezhaler obsahuje 150 µg indakaterolu, 63 µg glykopyrronia (glycopyrronii bromidum) a mometason je v jedné síle 160 µg. Jedna podaná dávka (která opouští náustek inhalátoru) obsahuje 114 µg indakaterolu, 58 µg glykopyrronia a 136 µg mometasonu [8].
Oba přípravky jsou řazeny dle ATC klasifikace do farmakoterapeutické skupiny: Léčiva k terapii onemocnění spojených s obstrukcí dýchacích cest (ATC kód: R03). V České republice mají přípravky v současné době preskripční omezení vázané na specializaci pneumolog a alergolog/imunolog, jejich úhrada je stanovena od 1. května 2021.
Farmakologické vlastnosti účinných látek
Účinné terapeutické molekuly se doplňují v protizánětlivém a bronchodilatačním efektu, a proto je vhodné znát jejich výhodné farmakologické vlastnosti.
Mometason furoát
Mometason furoát (MF) představuje syntetický kortikosteroid, který má vysokou afinitu pro glukokortikoidní receptory (GR) s lokálními protizánětlivými vlastnostmi. Jako samostatný IKS v léčbě astmatu je v ČR registrován od roku 2011 (Asmanex, Merck Sharp & Dohme). Ve fixní kombinaci je nyní uveden poprvé.
Mechanismus účinku IKS je objasněn jen do určité míry. Vdechované kortikosteroidy jsou látky lipofilní povahy, které prostupují cytoplazmatickou membránu a v cytoplazmě se váží na GR. Cytoplazmatický GR je identický ve všech buňkách lidského organismu, ale může se lišit jeho tkáňová exprese. Imunohistochemické studie prokázaly vysokou expresi GR v epiteliálních buňkách respiračního systému. Receptor je tvořen třemi doménami. Molekula kortikosteroidu se váže na C koncovou část, střední část je určena k interakci s DNA a N terminální část se účastní transaktivačních procesů v jádře. Polymorfní charakter receptoru může být podkladem pro individuální senzitivitu nemocných vůči kortikosteroidům. V cytoplazmě se GR nachází v inaktivní podobě, po vazbě kortikosteroidu dochází ke konformační změně receptoru. Tato vazba je zásadní v účinku kortikosteroidů, neboť vede ke zvýšení či snížení transkripce [9].
Snížení transkripce se děje cestou negenomové transrepresivní blokády transkripčních faktorů AP 1 (aktivační protein 1) a NFκB (nukleární faktor kappa B). Při probíhajícím zánětu jsou tyto transkripční faktory aktivovány některými cytokiny, např. tumor nekrotizujícím faktorem alfa (TNFα). Transkripční faktory v aktivované formě pronikají do jádra buňky a cestou mRNA (messenger RNA) indukují tvorbu celé řady prozánětlivých mediátorů. Nově vytvořený komplex kortikosteroid GR je schopen navázat se na transkripční faktory a tímto způsobem blokovat jejich průnik do jádra buňky. Kortikosteroidy jsou schopny takto inhibovat produkci celé škály interleukinů (IL), interferonu gama (IFNγ), TNFα, včetně dalších proteinů zapojených do procesu zánětu (GM CSF [faktor stimulující kolonie granulocytů a makrofágů], RANTES [CCL5, chemokinový ligand 5], receptor NK 1, endotelin 11, adhezní molekuly ICAM 1 a selektin).
Cestou genomovou, transaktivační, jsou pozitivně regulovány geny kódující protizánětlivě působící látky. Po vazbě kortikosteroidu na GR a vzniku komplexu kortikosteroid GR v cytoplazmě dochází ke konformační změně a rozpadu receptoru. Do jádra buňky prostupuje jen jeho nukleární část a váže se na DNA, konkrétně na tzv. GRE sekvenci (glucocorticoid response elements). Cestou mRNA dochází buď k potlačení, nebo k indukci produkce mediátorů. V první řadě je třeba jmenovat nově tvořený protein lipokortinu, který inhibuje fosfolipázu A2 a takto zasahuje do metabolismu kyseliny arachidonové se snížením tvorby prozánětlivých leukotrienů, prostaglandinů a destičky aktivujícího faktoru (platelet activating factor, PAF).
Zásahem kortikosteroidu do produkce regulačních a prozánětlivých cytokinů dochází k dalším dějům, které vyplývají z účinků těchto cytokinů. Je snižována exprese adhezních molekul na endoteliích (např. ICAM 1, E selektin), a tím nastává pokles migrace buněk submukózně a jejich přežívání v místech zánětu. Při pravidelné aplikaci IKS dochází ke snižování slizniční buněčné infiltrace – je redukován počet aktivovaných T lymfocytů, antigen prezentujících buněk, eozinofilů a též neutrofilů v zánětlivé respirační sliznici [10].
Epiteliální buňky, které jsou místem prvního kontaktu IKS se sliznicí, redukují tvorbu chemokinů, jako jsou MIP 1 a RANTES, a snižují produkci GM CSF. Účinkem kortikosteroidů na hlenové slizniční žlázky je snížena sekrece hlenu a jejich schopnost odpovídat na cholinergní podněty. Při dlouhodobé aplikaci IKS je dokladován jejich restaurační vliv s obnovením a řádnou funkcí řasinkového epitelu respirační sliznice.
Farmakodynamické vlastnosti
jednotlivých IKS se liší, proto pro orientaci uvádíme tabulku 1 s doporučením denních dávek pro dospívající
a dospělé [4].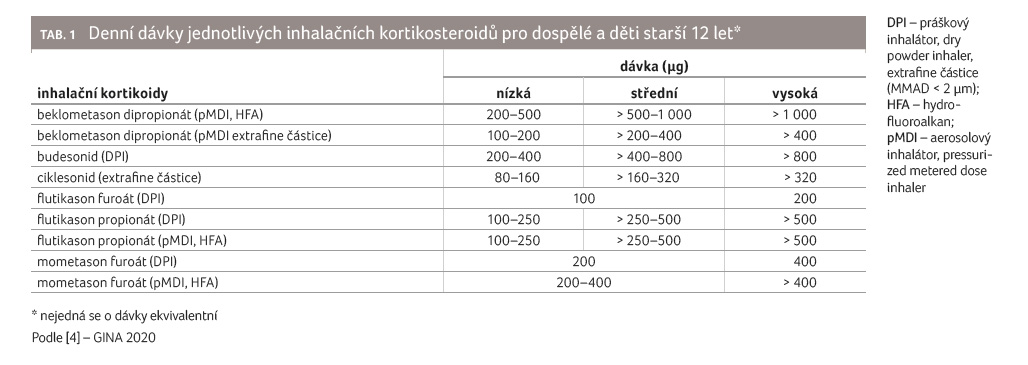
Mometason furoát v buněčné kultuře prokázal vysokou účinnost v inhibici syntézy a uvolnění IL 1, IL 5, IL 6 a TNFα. Je to také silný inhibitor produkce leukotrienů a produkce tzv. Th2 cytokinů IL 4 a IL 5. Farmakodynamické účinky byly prokázány in vitro. Bylo zjištěno, že MF má přibližně 12krát vyšší vazebnou afinitu k lidským GR než dexamethason, 7krát vyšší než triamcinolonacetonid, 5krát vyšší než budesonid a 1,5krát vyšší než flutikason.
Protizánětlivá účinnost a bezpečnost léčby MF je pozitivně ovlivněna jeho vysokou receptorovou afinitou, vysokou vazbou na plazmatické proteiny a nízkou biologickou dostupností. Tyto vlastnosti MF dokládají studie in vitro. Byl potvrzen vliv MF na zvýšenou apoptózu eozinofilů s vyšším efektem než flutikason propionát nebo budesonid [11].
Systémová biologická dostupnost po inhalaci MF je nízká. Je to díky nízké absorpci z plic a střev a rozsáhlému presystémovému metabolismu porce inhalačního léku zachycené v dutině ústní a polknuté. Absorpce z gastrointestinálního traktu podléhá extenzivnímu metabolismu. U lidí je MF v jaterních mikrozomech metabolizován na mnoho metabolitů, včetně 6 betahydroxyl MF, který vzniká na cytochromu P450 (izoenzym 3A4, CYP3A4). Inhalovaná dávka, radioaktivně označená, je vylučována především stolicí (75 %) a v menší míře močí (8 %) [7,8].
V souvislosti s molekulou MF klinické studie nepřinesly žádné důkazy o supresi osy hypotalamus hypofýza nadledviny po dlouhodobé léčbě inhalačním MF v dávkách ≤ 800 μg denně, hodnoceno dle koncentrací plazmatického kortizolu nebo abnormálních odpovědí na kosyntropin [11].
Vzhledem k tomu, že po inhalačním podání je dosaženo nízkých plazmatických koncentrací, jsou klinicky významné lékové interakce nepravděpodobné. Nicméně při současném podávání se silně účinnými inhibitory CYP3A4 (např. ketokonazol, itrakonazol, nelfinavir, ritonavir, kobicistat) může potenciálně dojít ke zvýšení systémové expozice MF.
Při inhalačním použití kortikosteroidů může být hlášena porucha zraku. I když se MF při doporučených dávkách vyznačuje nízkou systémovou biologickou dostupností, u pacientů s nově vzniklými očními příznaky, jako např. rozmazané vidění nebo jiné poruchy zraku, by mělo být zváženo doporučení k očnímu lékaři. Tak jako jiné IKS je i tento léčivý přípravek třeba podávat s opatrností u pacientů s plicní tuberkulózou nebo u pacientů s chronickými nebo neléčenými infekcemi [7,8].
Indakaterol
Farmakologické účinky β2 adrenoreceptorových agonistů, včetně indakaterolu, jsou přičitatelné zvýšeným koncentracím cyklického 3’,5’ adenosin monofosfátu (cyklický AMP), který způsobuje relaxaci bronchiální hladké svaloviny. Při inhalaci působí indakaterol lokálně v plicích jako bronchodilatátor, je schopen účinku již v nanomolárním množství a má rychlý nástup a dlouhé trvání účinku.
Beta2 adrenergní receptory jsou predominantní v bronchiální hladké svalovině a β1 adrenergní receptory jsou predominantní v lidském srdci. Beta2 adrenergní receptory se vyskytují i v lidském srdci a představují 10‒50 % celkového množství adrenergních receptorů. Podobně jako jiné léčivé přípravky obsahující β2 adrenergní agonisty může uvedený lék vyvolat u některých pacientů kardiovaskulární účinky, jako např. zrychlený pulz, zvýšený krevní tlak a/nebo jiné příznaky. Obecně je udáváno, že je nutná opatrnost u pacientů s kardiovaskulárními poruchami.
Ze studií s kombinovaným přípravkem Atectura a Enerzair Breezhaler byli vyřazeni astmatici s nestabilní ischemickou chorobou srdeční, anamnézou infarktu myokardu v posledních 12 měsících, levostranným srdečním selháním stupně III/IV podle klasifikace New York Heart Association (NYHA), arytmií, nekontrolovanou hypertenzí, cerebrovaskulárním onemocněním nebo se syndromem prodlouženého intervalu QT v anamnéze a pacienti léčení léčivými přípravky, u nichž je známo, že prodlužují interval QTc.
Obecně je u β2 adrenergních agonistů dokumentováno, že způsobují elektrokardiografické změny, jako jsou oploštění vlny T, prodloužení intervalu QT a deprese úseku ST. Je však důležité, že klinický význam těchto pozorování není přesně znám. LABA nebo kombinované přípravky obsahující U LABA – jako např. Atectura a Enerzair Breezhaler – by proto měly být používány s opatrností u pacientů se známým nebo suspektním prodloužením intervalu QT nebo u těch, kteří jsou současně léčeni léčivými přípravky ovlivňujícími interval QT [12‒14].
Glykopyrronium
Glykopyrronium bromid je selektivní antagonista muskarinových receptorů s vysokou afinitou, blokuje bronchokonstrikční působení acetylcholinu na hladké svalové buňky v dýchacích cestách, čímž dýchací cesty dilatuje. Muskarinové acetylcholinové receptory (muscarinic acetylcholine receptors, mAChRs) vytvářejí komplexy receptorů spřažených s G proteinem v buněčných membránách některých neuronů a dalších buněk. Tyto receptory působí jako hlavní konečný receptor stimulovaný acetylcholinem uvolněným z postgangliových vláken v parasympatiku. U lidí byly v plicích identifikovány tři subtypy muskarinových receptorů (M1, M2 a M3) s odlišnými fyziologickými funkcemi. Muskarinové receptory M1, které jsou lokalizovány v parasympatických gangliích, usnadňují neurotransmisi acetylcholinu. Muskarinové receptory M2, které byly nalezeny v myokardu a v hladkých svalech, působí negativní zpětnou vazbou na uvolňování acetylcholinu. Jejich aktivace tlumí uvolňování acetylcholinu, jejich blokáda způsobuje zvýšení produkce acetylcholinu v dýchacích cestách, což má za následek pěti až osminásobné zvýšení bronchokonstrikce navozené vagem. Muskarinový receptor M3 se zejména podílí na kontrakci hladkého svalstva, bronchokonstrikci a zvýšené tvorbě hlenu v plicích. Blokádou tohoto výkonného receptoru dojde ke snížení vagového tonu v dýchacích cestách. V lidských průduškách byl ještě identifikován muskarinový receptor M4, jeho funkce není přesně známa.
Ideální anticholinergikum by mělo selektivně antagonizovat činnost receptorů M1 a M3 a současně mít minimální afinitu k receptoru M2. Ve studiích vazebné kompetice prokázala molekula glykopyrronia čtyř až pětinásobnou selektivitu pro muskarinové receptory M3 a M1 nad receptorem M2.
Glykopyrronium má rychlý nástup účinku, což bylo dokladováno kinetickými parametry receptorové asociace/disociace a nástupem účinku po inhalaci v klinických studiích. Dlouhé trvání účinku může být zčásti přisuzováno trvalým lékovým koncentracím v plicích, což bylo prokázáno prodlouženým terminálním poločasem vylučování glykopyrronia po inhalaci inhalátorem na rozdíl od poločasu po intravenózním podání.
Glykopyrronium (podobně jako jiná anticholinergika) by mělo být používáno s opatrností u pacientů s glaukomem s uzavřeným úhlem nebo urinární retencí (s hyperplazií prostaty a s obstrukcí hrdla močového měchýře). Pacienti by měli být poučeni o známkách a příznacích akutního glaukomu s uzavřeným úhlem a o včasném přerušení léčby s kontaktováním lékaře [8].
Registrační studie s přípravky Atectura® a Enerzair® Breezhaler®
Atectura® Breezhaler®
Bezpečnost a účinnost přípravku Atectura Breezhaler byly hodnoceny ve dvou randomizovaných, dvojitě zaslepených studiích fáze III (PALLADIUM a QUARTZ) [7]. Zařazeni byli astmatici ve věku 12 let nebo starší s diagnózou nedostatečně kontrolovaného astmatu (skóre podle Asthma Control Questionnaire, ACQ 7 ≥ 1,5 při vstupu) a prokazující bronchodilatační reverzibilitu. Pacienti byli léčeni IKS s LABA nebo bez LABA alespoň tři měsíce před vstupem do studie.
PALLADIUM byla 52týdenní studie hodnotící léčbu přípravky indakaterol 125 µg/MF 127,5 µg (n = 439) a indakaterol 125 µg/MF 260 µg s inhalací jednou denně (n = 445) v porovnání s MF 400 µg jednou denně (n = 444) a MF 800 µg podávaným ve dvou denních dávkách (n = 442). Další aktivní kontrolní rameno studie zahrnovalo pacienty léčené fixní kombinací salmeterol/flutikason propionát v dávce 50 µg/500 µg podávané dvakrát denně (n = 446).
Primárním cílem studie bylo prokázat superioritu fixních kombinací indakaterolu 125 µg/MF 127,5 µg a indakaterolu 125 µg/MF 260 µg podávaných jednou denně nad MF 400 µg podávaným jednou nebo dvakrát denně. Ve 26. týdnu prokázaly obě síly fixních kombinací v dávce jednou denně signifikantní zlepšení v průběžné hodnotě trough FEV1 (objem vzduchu vydechnutý během jedné sekundy usilovného výdechu) a ve skóre ACQ 7 v porovnání s MF v dávce 400 µg jednou nebo dvakrát denně. Výsledky v 52. týdnu byly konzistentní s výsledky ve 26. týdnu. Obě síly přípravku prokázaly významné snížení v ročním výskytu středně těžkých nebo těžkých exacerbací (sekundární cílový ukazatel) v porovnání s MF v dávce 400 µg jednou a dvakrát denně [15].
QUARTZ byla 12týdenní studie hodnotící fixní kombinaci indakaterol 125 µg/MF 62,5 µg podávanou jednou denně v porovnání s monoterapií MF v dávce 200 µg jednou denně [16]. Studie QUARTZ je významná, neboť jako první srovnává fixní kombinaci IKS/U LABA v nízkých dávkách podávanou jednou denně s monoterapií IKS v nízkých dávkách u dospělých a dospívajících pacientů s nedostatečnou kontrolou nad astmatem. Hlavním cílem bylo porovnat kombinaci indakaterol/MF v nízkých dávkách (jednou denně) aplikovaných prostřednictvím inhalátoru Breezhaler a MF podávaný v nízkých dávkách (jednou denně) prostřednictvím inhalátoru Twisthaler. Kombinace indakaterol/MF v nízkých dávkách prokázala statisticky významné zlepšení trough hodnoty FEV1 ve srovnání s MF v nízkých dávkách po 12 týdnech léčby.
Dle uvedených klinických studií fixní kombinace indakaterolu a MF v nízkých dávkách prokázala zlepšení funkce plic a kontroly astmatu ve srovnání s monoterapií MF u symptomatických dospívajících a dospělých astmatiků s nedostatečnou kontrolou astmatu.
Enerzair® Breezhaler®
Klinická účinnost a bezpečnost byly dokladovány ve studii IRIDIUM. Jednalo se o 52týdenní sledování hodnotící Enerzair Breezhaler u dospělých pacientů s perzistujícím astmatem v randomizované, dvojitě zaslepené studii fáze III [8,17,18].
Jedna podaná inhalovaná dávka obsahovala indakaterol, glykopyrronium a MF ve dvou skupinách (obsah léků v uvedeném pořadí): a) 114 µg/46 µg/68 µg jednou denně (n = 620); b) 114 µg/46 µg/136 µg jednou denně (n = 619); v porovnání s kombinací indakaterol 125 µg/MF 127,5 µg (n = 617) a 125 µg/260 µg jednou denně (n = 618). Třetí aktivní kontrolní rameno zahrnovalo pacienty léčené fixní kombinací salmeterol/flutikason propionát v dávce 50 μg/500 μg dvakrát denně (n = 618).
U všech pacientů bylo požadováno, aby měli příznaky astmatu (ACQ 7 skóre ≥ 1,5) a dostávali udržovací terapii astmatu s užíváním kombinované léčby středními nebo vysokými dávkami IKS a LABA po dobu alespoň tří měsíců před vstupem do studie. Průměrný věk astmatiků v souboru byl 52,2 roku. Zařazeni byli pacienti s exacerbací astmatu v anamnéze v minulém roce.
Primárním cílem studie bylo prokázat superioritu: a) kombinace 114 µg/46 µg/68 µg jednou denně nad podáním kombinace indakaterol/MF 125 µg/127,5 µg jednou denně; b) kombinace 114 µg/46 µg/136 µg jednou denně nad podáním kombinace indakaterol/MF 125 µg/260 µg jednou denně. Hodnoticím ukazatelem byla hodnota trough FEV1 ve 26. týdnu.
Enerzair Breezhaler v dávce 114 µg/46 µg/136 µg jednou denně prokázal statisticky významné zlepšení v hodnotě trough FEV1 ve 26. týdnu v porovnání s kombinací indakaterol/MF v uvedených dávkách.
Klinicky významné zlepšení plicních funkcí (změna trough FEV1 z výchozí hodnoty v týdnu 26, ranní a večerní vrcholové výdechové rychlosti) bylo rovněž pozorováno ve větvi třetí při porovnání s fixní kombinací salmeterol/flutikason propionát v dávce 50 µg/500 µg dvakrát denně. Je příznivé, že nálezy v 52. týdnu byly konzistentní s nálezy z 26. týdne [18]. Všechny léčebné skupiny vykazovaly klinicky relevantní zlepšení od výchozích hodnot v ACQ 7 ve 26. týdnu a v tomto parametru nebyly pozorovány statisticky významné rozdíly mezi skupinami.
Exacerbace představovaly sekundární cílový ukazatel. Enerzair Breezhaler v dávce 114 µg/46 µg/136 µg jednou denně prokázal redukci (o 36‒42 %) v ročním počtu exacerbací v porovnání s přípravkem salmeterol/flutikason propionát v dávce 50 µg/500 µg dvakrát denně. Farmakodynamická odpověď tohoto léčivého přípravku je s rychlým nástupem účinku do pěti minut po podání dávky a s trvalým účinkem po dobu 24hodinového dávkovacího intervalu. Profil farmakodynamické odpovědi je charakterizován zvýšením průměrného FEV1 172 ml po podání kombinace indakaterol/glykopyrronium/MF v dávce 114 µg/46 µg/136 µg jednou denně v porovnání s fixní kombinací salmeterol/flutikason v dávce 50 µg/500 µg dvakrát denně [8].
Bezpečnost přípravků a zařazení do léčebného schématu
U obou přípravků Atectura a Enerzair Breezhaler souběžná inhalace terapeutických molekul indakaterolu/MF a indakaterolu/glykopyrronia/MF vzájemně neovlivnila farmakokinetiku žádné z léčivých látek při kombinovaném užití v jedné tobolce. Tachyfylaxe nebyla v průběhu studie ani při roční aplikaci pozorována. Populační farmakokinetická analýza u pacientů s astmatem neprokázala po inhalaci přípravků klinicky relevantní vliv věku, pohlaví, tělesné hmotnosti, kouření.
Celkově ve studiích byla léčba fixní dvoj a trojkombinací dobře snášena a bezpečnostní profil byl srovnatelný napříč všemi rameny registračních studií. Jedinou absolutní kontraindikací léčby Atectura a Enerzair Breezhaler je známá hypersenzitivita na léčivé látky nebo na některou z pomocných látek (monohydrát laktózy, želatina nebo potiskový inkoust tobolky).
V současnosti nejsou dostatečná fakta o aplikaci uvedených fixních kombinací u těhotných žen. Jako ostatní léčivé přípravky obsahující β2 adrenergní agonisty může indakaterol inhibovat porod v důsledku relaxačního účinku na hladké svalstvo dělohy. Léčivý přípravek může být použit během těhotenství pouze tehdy, pokud očekávaný přínos pro pacientku ospravedlňuje potenciální riziko pro plod. Z hlediska kojení není k dispozici žádná informace ohledně přítomnosti indakaterolu, glykopyrronia nebo MF v lidském mateřském mléce a jejich účinku na kojené dítě či účinku na tvorbu mléka. Obecně IKS přestupují do mateřského mléka. Indakaterol, glykopyrronium a MF byly detekovány v mléce kojících potkanů. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení, nebo ukončit/přerušit léčbu. Z hlediska reprodukce studie u zvířat nenaznačují ovlivnění fertility u mužského ani ženského pohlaví.
U obou přípravků je doporučena
inhalace jedné tobolky jednou denně, jedná se o maximální
denní dávku. Jako pomocná látka v tobolce je užita laktóza
v dávce 25 mg. Je vhodné podávat léčbu každý den
ve stejnou dobu, denní doba je ponechána na volbě
pacienta. Pokud dojde k vynechání dávky, další dávka by
měla být použita co nejdříve. Tento léčivý přípravek se
nemá používat k léčbě akutních příznaků astmatu [7,8].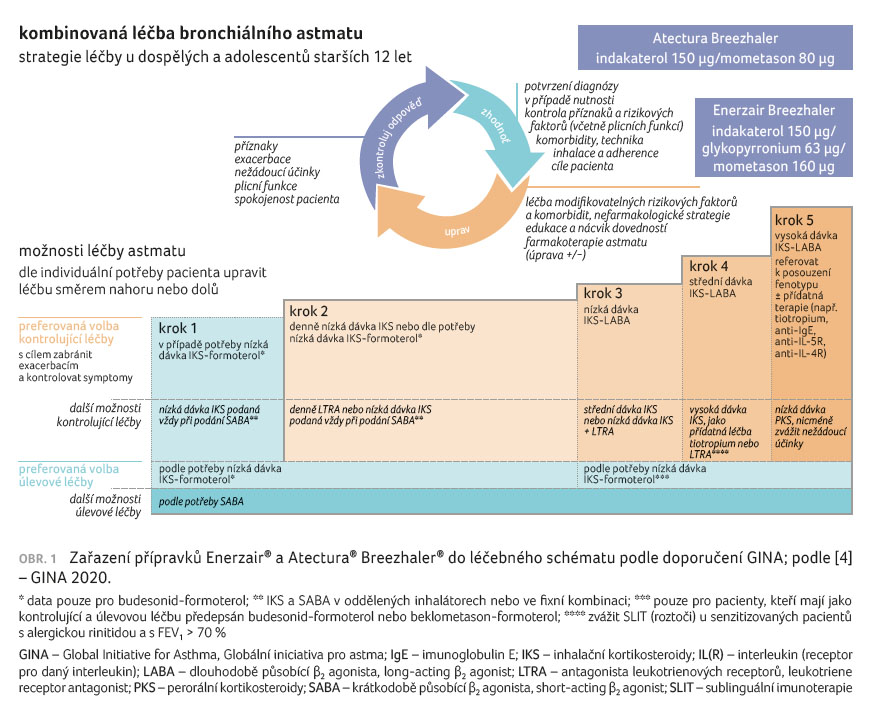
Obrázek 1 ukazuje zařazení obou přípravků do léčebného schématu podle doporučení Globální iniciativy pro astma (Global Initiative for Asthma, GINA).
Inhalační systém Breezhaler® a technika inhalace
Inhalační systém Breezhaler® představuje uživatelsky jednoduchý inhalační systém pro práškovou formu léku. Balení přípravků Atectura a Enerzair s inhalátorem Breezhaler obsahuje:
- jeden inhalátor Breezhaler,
- blistry s obsahem tobolek k použití v inhalátoru.
K bazi inhalačního systému může být v případě přípravku Enerzair připojen volitelný elektronický digitální senzor, který shromažďuje údaje o inhalacích pacienta a odesílá je do aplikace v chytrém telefonu nebo jiném vhodném zařízení. Senzor a aplikace nejsou nezbytné pro inhalaci, předepisující lékař může prodiskutovat s pacientem, zda je pro něj použití senzoru motivačním přínosem z hlediska adherence k léčbě (obr. 2).
Tak jako u jiných inhalačních
léků je astmatika nezbytné poučit, jak léčivý přípravek
správně používat. Tobolka je vyjmuta z blistru bezprostředně
před použitím, vložena do inhalátoru a propíchnuta
stiskem obou postranních tlačítek. Inhalace musí být rychlá
a hluboká, během inhalace je slyšitelný chrčivý zvuk.
Po inhalaci je vhodné se ujistit, zda je tobolka prázdná,
a vypláchnout ústa vodou a nepolykat ji. Výhodou
inhalačního systému je trojnásobná zpětná vazba –
„vidím, slyším, cítím“. Pacient vidí dávku v transparentní
tobolce, slyší při správně vedeném nádechu víření
perforované tobolky a po inhalaci cítí sladkou příchuť
laktózy. Charakteristikami inhalačního systému Breezhaler
jsou nízký vnitřní odpor inhalátoru a doporučená hodnota
nádechové rychlosti ≥ 60 l/min [2]. Nácvik inhalační
techniky je snadný, což bylo doloženo ve studii INHALER.
V počtu 2 935 pacientů byla srovnávána chybovost inhalační
techniky u inhalačních systémů, přičemž 8 z 10 pacientů
aplikovalo Breezhaler
správně [19,20].
Z hlediska compliance pacienta (ač se nám to může zdát méně uvěřitelné) je třeba se astmatika, který nepozoruje efekt léčby, zeptat, zda léčivý přípravek namísto inhalace nepolyká.
Závěr
Uvedené fixní kombinace U LABA/IKS (Atectura) a U LABA/U LAMA/IKS (Enerzair) představují novou možnost mezi dnes užívanými fixními kombinacemi IKS (nízká až vysoká dávka)/LABA v léčbě perzistujícího astmatu napříč terapeutickými kroky 3, 4 a 5 dle stupňovité léčby astmatu podle GINA.
Účinné molekuly jsou k dispozici v lékové formě tobolek podávaných v jednom inhalačním systému Breezhaler. Indakaterol je U-LABA s rychlým nástupem účinku, který vyvolává relaxaci hladkého svalstva bronchů u pacientů s reverzibilní obstrukcí dýchacích cest. Glykopyrronium bromid je selektivní antagonista muskarinových receptorů s vysokou afinitou, který blokuje bronchokonstrikční působení acetylcholinu na hladké svalové buňky v dýchacích cestách. Mometason představuje výhodný syntetický IKS s vysokou afinitou pro GR a s lokálními protizánětlivými vlastnostmi.
Léčivý přípravek Atectura Breezhaler je indikován jako udržovací léčba astmatu u dospělých a dospívajících ve věku od 12 let, u nichž samotná terapie IKS a LABA nevedla k dostatečné kontrole astmatu. Jedna tobolka přípravku obsahuje 150 µg indakaterolu a dávky MF jsou ve třech silách – 80 µg/160 µg/320 µg, což umožnuje individuální titraci dávky IKS. Fixní kombinace indakaterolu/MF prokázala v klinických studiích zlepšení funkce plic a kontroly astmatu ve srovnání s monoterapií MF u dospívajících a dospělých symptomatických astmatiků [7].
Enerzair Breezhaler představuje vůbec první přípravek v trojkombinaci k inhalační léčbě bronchiálního astmatu. Přípravek se skládá z fixní kombinace tří léčivých látek (150 µg indakaterol/63 µg glykopyrronium/160 µg MF). Enerzair Breezhaler je indikován k udržovací léčbě astmatu u dospělých pacientů, kteří nejsou adekvátně kontrolováni udržovací léčebnou kombinací LABA/vysoká dávka IKS a kteří překonali jednu nebo více exacerbací astmatu v předchozím roce. Přípravek směřuje k těžším astmatikům, dle indikace je primárně určen pro čtvrtý až pátý krok léčby bronchiálního astmatu [8].
Užívání léku jednou denně může zlepšit adherenci k léčbě ve srovnání s užíváním kombinace dvakrát denně, a tudíž u některých astmatiků vede k lepší úrovni kontroly astmatu. Inhalační systém Breezhaler je jednoduchý na obsluhu a poskytuje pacientovi zpětnou kontrolu správné inhalační techniky.
V České republice mají oba přípravky preskripční omezení. S ohledem na účinnost a bezpečnost terapie je vhodné, aby léčbu vedl lékař s odborností „alergologie a klinická imunologie“ a „pneumologie a ftizeologie, dětská pneumologie“ bez možnosti přenositelnosti preskripce na jiné lékařské odbornosti. Oba přípravky se stanovením úhrady jsou dostupné od 1. května 2021 (Enerzair: SUKLS254416/2020, sukl80001/2021; Atectura: SUKLS230025/2020, sukl80024/ 2021).
Seznam použité literatury
- [1] Carr TF, Zeki AA, Kraft M. Eosinophilic and noneosinophilic asthma. Am J Respir Crit Care Med 2018; 197: 22–37.
- [2] Terl M, Sedlak V, Cap P, et al. Asthma management: A new phenotype‑based approach using presence of eosinophilia and allergy. Allergy 2017; 72: 1279‒1287.
- [3] Chung KF, Wenzel SE, Brozek JL, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014; 43: 343‒373.
- [4] GINA Report, Global Strategy for Asthma Management and Prevention 2020. Dostupné na: https://ginasthma.org/wp‑content/uploads/2020/06/GINA‑2020‑report_20_06_04‑1‑wms.pdf
- [5] Katsaounou P, Odemyr M, Spranger O, et al. Still Fighting for Breath: a patient survey of the challenges and impact of severe asthma. ERJ Open Res 2018; 4: 00076‒2018.
- [6] Price D, Fletcher M, van der Molen E. Asthma control and management in 8,000 European patients: the REcognise Asthma and LInk to Symptoms and Experience (REALISE) survey. NPJ Prim Care Respir Med 2014; 24: 14009.
- [7] Souhrn údajů o přípravku Atectura® Breezhaler®. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/atectura‑breezhaler‑epar‑product‑information_cs.pdf
- [8] Souhrn údajů o přípravku Enerzair® Breezhaler®. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/enerzair‑breezhaler‑epar‑product‑information_cs.pdf
- [9] Bousquet J. Mometason furoate: an effective anti‑inflammatory with well‑define safety and tolerability profile in the treatment of asthma. Int J Clin Pract 2009; 63: 806–819.
- [10] Hogger P. Current Concepts for Optimizing the Therapeutic Index of Glucocorticoid Receptor Ligands for Oral and Inhalative Use: Basic Considerations and Clinical Reality. Curr Med Chem Anti Inflamm Anti‑Allergy Agents 2003; 2: 395–408.
- [11] Asmanex Twisthaler 200 and 400 mg (mometasone furoate inhalation powder); UK prescribing information, Summary of Product Characteristics (SPC). Dostupné na: http://www.medicines.org.uk/emc/ (10. 6. 2011)
- [12] Battram C, Charlton SJ, Cuenoud B, et al. In vitro and in vivo pharmacological characterization of 5‑[(R)‑2‑(5,6‑diethyl‑indan‑2‑ylamino)‑1‑hydroxy‑ethyl]‑8‑hydroxy‑1H‑quinolin‑2‑one (indacaterol), a novel inhaled beta(2) adrenoceptor agonist with a 24‑h duration of action. J Pharmacol Exp Ther 2006; 317: 762–770.
- [13] Scola AM, Loxham M, Charlton SJ, et al. The long‑acting beta‑adrenoreceptor agonist, indacaterol, inhibits IgE‑dependent response of human lung mast cells. Br J Pharmacol 2009; 158: 267–276.
- [14] Khindri S, Sabo R, Harris S, et al. Cardiac safety of indacaterol – no clinical effect on QT in healthy subjects [abstract No P2031] 19th Annual Congress of the European Respiratory Society 2009; Vienna.
- [15] van Zyl‑Smit RN, Krüll M, Gessner C, et al. Once‑daily mometasone plus indacaterol versus mometasone or twice‑daily fluticasone plus salmeterol in patients with inadequately controlled asthma (PALLADIUM): a randomised, double‑blind, triple‑dummy, controlled phase 3 study. Lancet Respir Med 2020; 8: 987–999.
- [16] D’Andrea P, Kornmann O, Mucsi J, et al. Efficacy and safety of once‑daily low‑dose indacaterol/mometasone via Breezhaler in symptomatic adult and adolescent patients with inadequately controlled asthma: Phase III randomised QUARTZ study findings. Eur Respir J 2019; 54: RCT3780.
- [17] Chapman KR, van Zyl‑Smit R, Kerstjens HAM, et al. Indaceterol/Glycopyrronium/Mometason Fuorate improves lung function and decreases exacerbations compared with Salmeterol/Fluticason in patients with uncontrolled asthma: Pooled Analyses of PALLADIUM and IRIDIUM Studies. Thematic poster session, A3004, Asthma Clinical Trials, ATS International Conference, May 15‒20, 2020.
- [18] Kerstjens HAM, Maspero JF, Chapman KR, et al. Indaceterol/Glycopyrronium/Mometason Fuorate improves lung function and reduces exacerbations versus Long‑acting beta2‑agonist/Inhaled Corticosteroid Standard‑of‑care in patients with uncontrolled asthma: The Phase III IRIDIUM Study. Thematic poster session, A3007, Asthma Clinical Trials, ATS International Conference, May 15‒20, 2020.
- [19] Molimard M, Raherison C, Lignot S, et al. Chronic obstructive pulmonary disease exacerbation and inhaler device handling: real‑life assessment of 2935 patients. Eur Respir J 2017; 49: 1601794.
- [20] Sobotík O. Atectura® Breezhaler® – fixní kombinace IKS/LABA v léčbě astmatu. Remedia 2021; 31: 6–9.