Nové možnosti léčby atopické dermatitidy
Souhrn:
Atopická dermatitida (AD) je běžné zánětlivé kožní onemocnění postihující dospělé a děti. Základem lokální léčby AD jsou emoliencia, kortikosteroidy a inhibitory kalcineurinu. Pro pacienty s těžší formou AD jsou využívána celková imunosupresiva. Rozvoj znalostí v oblasti mechanismu vzniku AD vede k širokému využití nových, cílených možností léčby.
Summary:
Atopic dermatitis (AD) is a common, inflammatory skin disease affecting adults and children. Topical agents including emollients, corticosteroids and calcineurin inhibitors are the mainstay of AD therapy. For more severely affected subjects, systemically administered immunosuppresant drugs are used. Our improved understanding about the mechanism for development of AD is leading to an expanding use of new targeted treatment interventions.
Key words: atopic dermatitis, cytokines, topical therapy, biologics
Definice
Atopická dermatitida/ekzém (AD) je chronické recidivující svědivé kožní onemocnění, které se vyznačuje suchou kůží a zánětlivou reakcí. Toto chronické nebo chronicky recidivující onemocnění má výrazný dopad na kvalitu života nemocného i celé jeho rodiny. Proto se v současnosti zaměřuje léčebná péče na nové postupy, které by toto onemocnění zkrotily. Atopická dermatitida je chronické onemocnění, léčba proto musí tuto skutečnost zohlednit a měla by být plánována s dlouhodobou perspektivou. Základem léčby AD je psychosomatický přístup lékaře k nemocnému, vyvarování se specifických a nespecifických provokačních faktorů a hydratace kůže emoliencii [1].
Role emoliencií
Emoliencia jsou nedílnou součástí léčby tohoto onemocnění, obnovují porušenou kožní bariéru, zabraňují ztrátám vody z horních vrstev kůže, zlepšují kapacitu vázat vodu v kůži a také přímo vodu dodávají do suchých vrstev kůže. Existují také klinické studie, které prokazují tzv. kortikosteroidy šetřící účinek emoliencií. Emoliencia tak hrají významnou roli v léčbě AD [1].
Pokud emoliencia obsahují ve svých texturách kožní ceramidy v kombinaci s jinými hygroskopickými látkami (např. N steatoryl fytosfingosin, 5% urea a laktát), jejichž syntéza je u atopiků snížená, dochází k opětovné obnově porušené kožní bariéry jak na anatomické úrovni, tak na úrovni funkční (snížení transepidermálních ztrát vody, zlepšení hydratace a úleva od svědění) [2].
Další zcela novou a potenciálně úspěšnou léčbou porušené kožní bariéry u atopiků je využití syntetické, elastické „druhé kůže“. Tato „kůže“ je vyrobena ze zesíťovaného polymeru (cross linked polyethylen, XLP), je s úspěchem využívána v estetické dermatologii jako tzv. anti aging přípravek k odstranění známek stárnutí kůže, a to zejména v periokulární zóně. Tento přípravek je v současnosti studován jako potenciální zevní „lék“ AD pro své schopnosti vytvořit na kůži náhradní kožní bariéru (po dobu 24 hodin) a zabránit jak úniku vody z atopické kůže, tak průniku iritantů a alergenů do atopické kůže s následným vznikem a udržováním atopického zánětu [3].
Možnou cestou, jak zmírnit tíži atopického ekzému, je rovněž využití emoliencií s obsahem vitaminu D a/nebo jeho derivátů. Vitamin D je důležitý v pochodech obnovujících kožní bariéru a v imunitních reakcích. Kalcitriol normalizuje keratinocytární diferenciaci a zlepšuje porušenou kožní bariéru atopické kůže zejména zvýšením koncentrace filaggrinu. Nejnovějšími studiemi bylo zjištěno, že perorální suplementace vitaminu D nevykazuje léčebné účinky srovnatelné s účinky emoliencií s obsahem vitaminu D nebo jeho derivátů [4].
Ve výzkumu jsou intenzivně zkoumána zcela nová emoliencia s obsahem antimikrobiálních peptidů (AMP); jedná se zejména o emoliencia s obsahem rekombinantního lidského beta defenzinu 2 (hβD 2). V kůži atopiků jsou koncentrace AMP sníženy a jejich využití v emolienciích by mohlo omezit (o 10–15 %) poškození kožní bariéry, které je vyvoláno zejména SspA/V8 proteázou zlatého stafylokoka. Tato proteáza poškozuje korneodesmozomální spoje ve stratum corneum a proteiny tight junctions stratum granulosum, což vede k dalšímu prohloubení poškozené kožní bariéry u pacientů s AD [5].
Protizánětlivá léčba
Zcela zásadní u pacientů s AD je protizánětlivá léčba lokálními kortikosteroidy, lokálními imunomodulátory (inhibitory kalcineurinu) a lokálními inhibitory fosfodiesterázy (IPDE). Lokální terapie není někdy schopna účinně kontrolovat AD, proto přichází na řadu sekundární terapie, která zahrnuje fototerapii UV zářením (zejména 311 nm UVB) a systémovou léčbu kortikosteroidy, cyklosporinem A, metotrexátem, azatioprinem a mykofenolát mofetilem, inhibitory Janusových kináz (JAK) a nově také biologickou léčbu dupilumabem.
Lokální kortikosteroidy
Lokální kortikosteroidy se používají v akutní fázi onemocnění. Tyto látky zmírňují projevy AD a tlumí zánětlivou reakci v kůži. Jelikož je AD chorobou chronickou, nelze lokální kortikosteroidy aplikovat na kůži dlouhodobě. Při dlouhodobé aplikaci lokálních kortikosteroidů dochází ke ztrátě účinnosti těchto léků, k následnému zhoršení kožního nálezu onemocnění a iatrogenně navozených projevů kortikodermatu. Tyto nežádoucí účinky vznikají především při dlouhodobé aplikaci lokálních kortikosteroidů na tváři a v okolí očí. Nejsou zanedbatelné ani systémové nežádoucí účinky lokálních kortikosteroidů při jejich dlouhodobé a velkoplošné aplikaci. Děti jsou ke vzniku systémových nežádoucích účinků náchylnější než dospělí, protože mají třikrát větší poměr tělesného povrchu ke hmotnosti než dospělí. Tyto nežádoucí účinky jsou příčinou strachu z kortikosteroidní terapie.
Kortikofobie je častým fenoménem, až 84 % pacientů s AD odmítá léčbu lokálními kortikosteroidy a bojí se této léčby. Důvodem jejich strachu byly nežádoucí účinky a neúčinnost lokálních kortikosteroidů u těchto pacientů léčených lokálními kortikosteroidy v minulosti. Pacienti s kortikofobií tudíž vykazují selhání léčby, bojí se lokální kortikosteroidy pro jejich nežádoucí účinky používat a odmítají tuto léčbu [1].
Nežádoucí účinky lokálních kortikosteroidů se snažíme eliminovat správným používáním těchto léčiv. Aplikujeme je pouze v době největšího zhoršení a k překonání kritických obtíží. Léčbu zahajujeme silnějšími nebo středně silnými přípravky a podáváme po nezbytně nutnou dobu do zlepšení, pak aplikujeme přípravky slabší (sestupná či odstupňovaná léčba) či redukujeme frekvenci aplikace (ústupová léčba). V léčbě chronické AD využíváme režim intervalové terapie, kdy se kortikosteroidy aplikují na kůži obvykle jednou denně tři dny po sobě a ty jsou pak následovány třídenní nesteroidní léčbou [1].
Lokální imunomodulátory
Bezpečnou alternativou léčby AD jsou lokální imunomodulátory (např. 0,03% a 0,1% takrolimus v masti, 1% pimekrolimus v krému) působící inhibici kalcineurinu, které jsou velmi účinné, bezpečné, nevykazují nežádoucí účinky lokálních kortikosteroidů. Tyto moderní léky mají rychlý nástup účinku, dobře a rychle odstraňují svědění a tlumí zánětlivou reakci v kůži a využívají se především k dlouhodobé kontrole AD, v léčbě jejích akutních i chronických projevů, a to zejména v proaktivním režimu léčby (takrolimus mast 2× týdně dlouhodobě v kombinaci s emoliencii) [1].
Lokální inhibitory fosfodiesterázy
Krisaborol představuje inovativní nesteroidní molekulu určenou k léčbě pacientů s AD starších dvou let. Jedná se o inhibitor fosfodiesterázy (PDE 4), který zabraňuje degradaci cyklického adenosinmonofosfátu (cAMP) na adenosinmonofosfát (AMP). Krisaborol a cAMP hrají klíčovou protizánětlivou roli, a to snížením koncentrace vysoce prozánětlivé PDE 4 v kůži s navýšením koncentrací cAMP. Mast s obsahem 2% krisaborolu je určena pacientům s mírnou a středně těžkou formou AD, aplikuje se 2× denně v tenké vrstvě a vykazuje klinickou účinnost srovnatelnou se středně silně potentními lokálními kortikosteroidy, ale bez jejich nežádoucích účinků (zejména bez rozvoje kortikodermatu). Mezi nežádoucí účinky léčby krisaborolem patří pocit pálení kůže v místě aplikace přípravku. Lokální přípravek s obsahem krisaborolu nevykazuje nežádoucí gastrointestinální účinky, které jsou přítomny u psoriatických pacientů léčených inhibitory fosfodiesterázy perorálně [6].
Janusovy kinázy a jejich inhibice
Čtyři typy JAK a sedm transkripčních faktorů STAT (signal transducer and activator of transcription protein) tvoří síť pro transdukci signálu, která je využívána při signalizaci interleukiny 2, 6, 9, 10 a 31 (IL 2, IL 6, IL 9, IL 10, IL 31) a interferonem gama (IFNγ). Po vazbě těchto cytokinů na jejich transmembránové receptory se spouští intracelulární kaskáda fosforylační reakce, která je katalyzována proteinkinázami. Fosforylace zprostředkovaná JAK vede k vazbě transkripčního faktoru STAT. Tento protein je dále fosforylován a tvoří dimer, který v buněčném jádře ovlivňuje transkripci genů. Takto dochází k přenosu signálu z buněčného povrchu (membrány) do jádra buněk a následně k ovlivnění genové exprese [7].
Lokálně aplikovaný 2% tofacitinib v krému je určen pro pacienty s mírnou až středně těžkou formou AD. EASI skóre (Eczema Area and Severity Index) ve 4. týdnu léčby bylo u pacientů léčených tofacitinibem zlepšeno o 81,7 % proti výchozí hodnotě ve srovnání se zlepšením o 29,9 % u pacientů léčených placebem. Signifikantního zlepšení EASI skóre bylo dosaženo za týden od začátku léčby, zatímco signifikantního zmírnění svědění bylo dosaženo po dvou dnech léčby.
Probíhají klinické studie s dalšími
inhibitory JAK, které jsou aplikovány zevně nebo perorálně
(např. baricitinib, upadacitinib) [8].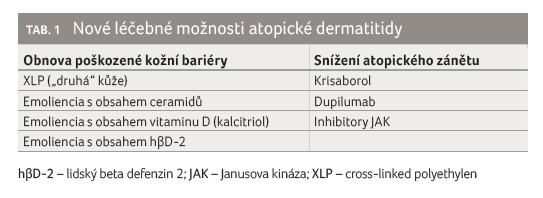
Dupilumab
Dupilumab je rekombinantní lidská monoklonální protilátka třídy IgG4, která inhibuje signální dráhu IL 4 a IL 13. Dupilumab působí proti receptoru IL 4α, který brání aktivaci tohoto IL 4 a inhibuje tak signální dráhu IL 4/IL 13. Je tak účinně inhibována produkce prozánětlivých cytokinů IL 4 a IL 13, které jsou klíčovými Th2 cytokiny podílejícími se na vzniku AD. Dupilumab je indikován k léčbě středně těžké až těžké AD u dospělých pacientů. Doporučená iniciální dávka je u dospělých pacientů 600 mg (dvě injekce po 300 mg), následovaná dávkou 300 mg každý druhý týden formou subkutánní injekce. Přípravek s obsahem dupilumabu lze používat s lokálními kortikosteroidy, lokálními imunomodulátory nebo bez nich. U pacientů, u nichž nedošlo po 16 týdnech léčby k žádné odpovědi, je vhodné léčbu ukončit. Účinnost a bezpečnost dupilumabu byla hodnocena především randomizovanými, dvojitě zaslepenými, placebem kontrolovanými studiemi SOLO 1 a SOLO 2. Například ve studii SOLO 1 v 16. týdnu nastalo zlepšení EASI skóre proti výchozí hodnotě o 72,3 % u pacientů léčených dupilumabem versus 37,6 % u pacientů léčených placebem, hodnocení závažnosti AD podle indexu SCORAD prokázalo zlepšení proti výchozí hodnotě o 57,7 % v rameni s dupilumabem a o 29 % v rameni s placebem a skóre intenzity svědění bylo zlepšeno proti výchozí hodnotě o 51 % v rameni s dupilumabem, zatímco v rameni s placebem pouze o 26,1 %. V klinických studiích bylo v 16. týdnu pozorováno významné zlepšení kvality života pacienta včetně dopadu AD na spánek a symptomy úzkosti a deprese spojené s AD [9,10].
Závěr
Základem léčby AD nadále zůstává kombinace moderních, sofistikovaných emoliencií, která dokáží obnovit strukturu a funkci porušené kožní bariéry, s lokálními protizánětlivými léky v proaktivním režimu léčby (kortikosteroidy, resp. inhibitory kalcineurinu). V případě nedostatečné kontroly AD jsou indikována celkově podávaná imunosupresiva. V případě selhání celkové imunosupresivní léčby je možná u pacientů se středně těžkou až těžkou formou AD léčba dupilumabem či inhibitory JAK. S nárůstem nových poznatků o etiopatogenezi AD jsou v léčbě dostupné zcela nové molekuly, které cílí na specifické patofyziologické mechanismy. Jedná se zejména o inhibitory PDE 4 a inhibitory JAK (obě skupiny léčiv jsou v České republice dostupné zatím pouze v klinických studiích) a monoklonální protilátky (dupilumab je v ČR již registrován). Výzkum v oblasti ovlivnění atopického zánětu a porušené kožní bariéry nadále trvá, mnohé další molekuly čekají na vyhodnocení účinnosti v klinických studiích.
Seznam použité literatury
- [1] Litvik R. Atopický ekzém v dospělém věku. In Dermatologie v kazuistikách. Praha: Mladá fronta, 2008.
- [2] Danby SG, Brown K, Higgs‑Bayliss T, et al. The Effect of an Emollient Containing Urea, Ceramide NP, and Lactate on Skin Barrier Structure and Function in Older People with Dry Skin. Skin Pharmacol Physiol 2016; 29: 135−147.
- [3] Yu B, Kang SY, Akthakul A, et al. An elastic second skin. Nat Mater 2016; 15: 911−918.
- [4] Bikle DD, Chang S, Crumrine D, et al. Mice lacking 25OHD 1alpha‑hydroxylase demonstrate decreased epidermal differentiation and barrier function. J Steroid Biochem Mol Biol 2004; 29: 135−147.
- [5] Wang B, McHugh BJ, Qureshi A, et al. IL‑1β‑Induced Protection of Keratinocytes against Staphylococcus aureus‑secreted Proteases Is Mediated by Human β‑Defensine 2. J Invest Dermatol 2017; 137: 95−105.
- [6] Jarnagin K, Chanda S, Coronado D, et al. Crisaborole Topical Ointment, 2% A Nonsteroidal, Topical, Anti‑Inflammatory Phosphodiesterase 4 Inhibitor in Clinical Development for the Treatment of Atopic Dermatitis. J Drugs Dermatol 2016; 15: 390−396.
- [7] Chaplin S. Janus kinase inhibitors for autoimmune disorders. Prescriber 2017; 28: 33−37.
- [8] Bissonnette R, Papp KA, Poulin Y, et al. Topical tofacitinib for atopic dermatitis: a phase IIa randomized trial. BJD 2016; 175: 902−911.
- [9] Simpson EL, Bieber T, Guttman‑Yassky E, et al. Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med 2016; 375: 2335−2348.
- [10] Beck LA, Thaci D, Hamilton JD, et al. Dupilumab Treatment in Adults with Moderate‑to‑Severe Atopic Dermatitis. N Engl J Med 2014; 371: 130−139.