Nové poznatky o obezitě a současná farmakoterapie
Souhrn:
Šrámková P. Nové poznatky o obezitě a současná farmakoterapie. Remedia 2019; 29: 99–104.
Obezita je celoživotní, progredující závažné onemocnění s možnými mnohočetnými komplikacemi. Více než polovina dospělé populace v České republice trpí nadváhou či obezitou. Geneticky determinováno je hospodaření s energií i jídelní chování. Regulace tělesné hmotnosti je výsledkem komplexní interakce genetické dispozice, tukové tkáně, procesu absorpce živin, který je ovlivněn mikrobiomem zažívacího traktu, mírou fyzické aktivity, bazální termogeneze a životního prostředí. Centrum kontroly regulace se nachází v hypotalamu. Většina antiobezitik, a zvláště bariatrická chirurgie, vede k dlouhodobému hmotnostnímu úbytku, a to změnou signálů vysílaných do hypotalamu zejména navozením fyziologického pocitu sytosti. Dlouhodobé ovlivnění hypotalamického centra pomocí farmakoterapie či bariatrické chirurgie může být efektivní v boji s obezitou. Základem léčby obezity je úprava životosprávy ‒ redukční dieta, pohybová aktivita a změna chování spolu s farmakoterapií či bariatrickou léčbou. K terapii obezity jsou v ČR k dispozici orlistat, fentermin s omezenou preskripcí, z nových léků kombinace bupropionu s naltrexonem a injekční liraglutid v dávce 3 mg. V USA jsou možnosti širší ‒ schválen je lorkaserin, kombinace fenterminu s bupropionem, u diabetiků též amylin a bromokriptin. Nejnižší účinnost terapie je zaznamenána u orlistatu (‒2,9 %/rok), avšak s nejmenším výskytem nežádoucích účinků, nejúčinnější se jeví liraglutid doprovázený intenzivní kognitivně‑behaviorální terapií (‒11,5 %/rok). Perspektivní je léčba celoživotní.
Summary:
Sramkova P. New findings on obesity and the current pharmacotherapy. Remedia 2019; 29: 99–104.
Obesity is a life‑long, progressing illness with possible multiple complications. More than half of the adult population in the Czech Republic suffers from overweight or obesity. Energy management and eating behavior is genetically determined. The regulation of body weight is a result of complex interaction of genetic predisposition, fatty tissue, the process of nutrient resorption affected by digestive microbiota, physical activity rate, basal thermogenesis and the environment. The control center is in the hypothalamus. Most antiobesity drugs, and especially bariatric surgery, lead to long‑term weight loss by changing the signals going into the hypothalamus, in particular by inducing a physiological feeling of satiety. Long‑term influence of the hypothalamic center through pharmacotherapy or bariatric surgery can be effective in dealing with obesity. The basis of obesity treatment is the diet change ‒ reduction diet, physical activity and behavioral change, along with pharmacotherapy or bariatric treatment. In the Czech Republic, orlistat, limited prescription phentermine, new drug bupropion with naltrexone and 3mg injection of liraglutide are available. In America, options are wider; the approved drugs include lorcaserin, the combination of fentermin and bupropion, and in diabetic patients also amylin and bromocriptine. The least efficient is orlistat ‒2.9%/year, however, with the least adverse effects; liraglutide accompanied by intensive cognitive behavioral therapy ‒11.5%/year ‒ appears to be the most efficient. Perspective treatment is lifelong.
Key words: obesity, regulation of body weight, bupropion/naltrexone, liraglutide.
Úvod
Obezitu vnímáme
jako celoživotní, progredující závažné
onemocnění s možnými
mnohočetnými komplikacemi. Onemocnění je charakterizováno
zvýšeným podílem tukové tkáně ≥ 25 %
u mužů a ≥ 30 % u žen.
Podíl tělesného tuku s věkem
stoupá, a tím se mění i kritéria
hodnocení. Obecně lze říci, že
za negativní jev považujeme více než 35 % tukové
tkáně u žen v menopauze, bez ohledu na index
tělesné hmotnosti (body mass index, BMI). Riziko vzniku
metabolických a kardiovaskulárních komplikací spojených
s obezitou je
vázáno na ukládání viscerálního
tuku, jež odpovídá obvodu pasu (tab. 1).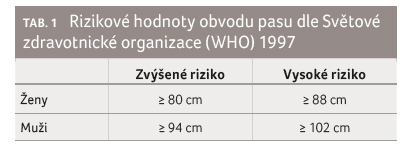
Obezita se vyskytuje historicky ve všech společenstvích, s různou mírou prevalence. Ve 21. století je výskyt v rozvinutých zemích jistě největší ve srovnání s předchozími stoletími. Získání validních dat je velmi obtížné. Podle výzkumu agentury STEM/MARK z roku 2013 je v České republice 55 % osob s nadváhou či obezitou. Nadváha se týká 34 % dospělých a obézních je 21 % osob, 4 % populace trpí obezitou 2. a 3. stupně, tedy mají hodnotu BMI nad 35. Rozdělení obezity pouze dle BMI není ideální a čelí řadě kritik na odborných fórech. Edmontonská klasifikace, která představuje modernější dělení akceptující komorbidity, jejich tíži a vliv na funkční stav jedince i s predikcí mortality, zatím nedoznala širšího uplatnění [1].
Genetické vlohy k obezitě jsou různě vyjádřeny prakticky u každého jedince, dále záleží na vlivu okolního obezitogenního prostředí, zda dojde k projevu vlastního onemocnění. Aktivně se bránit obezitogennímu prostředí vyžaduje cílevědomost a jistou míru inteligence a jistě není možné vinit jedince z vlastní genetické dispozice. Geneticky determinováno je jídelní chování i hospodaření s energií – tedy energetický příjem a energetický výdej. Regulace tělesné hmotnosti je výsledkem komplexní interakce genetické dispozice, tukové tkáně, procesu absorpce živin, který je ovlivněn mikrobiomem zažívacího traktu, mírou fyzické aktivity, bazální termogeneze a životního prostředí [2]. Obezitu můžeme též vnímat jako neurokrinní dysregulaci energetického příjmu a energetického výdeje. Na příjmu potravy v mozku se podílejí dva systémy ‒ homeostatický (leptin, ghrelin atd.) a hédonický (dopamin, endokanabinoidy atd.), které spolu v tomto komplexním procesu trvale soupeří. Dopamin je nervový přenašeč, jenž se podílí na zprostředkování odměny a vzniku závislosti. Proto je možné hovořit i o závislosti na jídle [3]. Centrum kontroly regulace se nachází v hypotalamu. Existují dobré důkazy o tom, že ačkoliv obezita startuje jako tzv. lifestyle problém, rychle směřuje k narušení energetické regulace jako k výsledku poruchy hypotalamických signálů. Tyto signály vedou ke zvýšenému „body weight set point“, jež lze zjednodušeně vysvětlit jako zvýšené nastavení hodnoty termostatu regulujícího tělesnou hmotnost. Spolu s většinou antiobezitik vede zvláště bariatrická chirurgie k dlouhodobému hmotnostnímu úbytku; děje se tak změnou signálů jdoucích do hypotalamu zejména v důsledku navození fyziologického pocitu sytosti [4]. Pouhá změna životního stylu pomocí redukční diety a fyzické aktivity není u vyšších stupňů obezity účinná. Proto právě dlouhodobé ovlivnění hypotalamického centra pomocí farmakoterapie či bariatrické chirurgie může být efektivní v boji s obezitou. Toto onemocnění rozhodně nespočívá v selhání vůle jedince [5].
Terapie obezity
Základem léčby obezity je úprava životosprávy, tj. redukční dieta, pohybová aktivita a změna chování. Dalším důležitým bodem je vhodná farmakoterapie. Stejně jako nyní přistupujeme k léčbě hypertenze či hyperlipoproteinemie, měli bychom vhodnou farmakologickou léčbu obézním pacientům podávat prakticky celoživotně. Toto vyplývá z podstaty onemocnění, kdy velký podíl mají genetické vlivy, jež zatím nelze ovlivnit. Od farmakoterapie se obecně očekává redukce o 7‒10 % původní hmotnosti a její udržení po dobu užívání léků.
Indikací farmakoterapie je selhání nefarmakologické léčby vedené po dobu tří měsíců u pacientů s BMI ≥ 30, nebo u pacientů s BMI ≥ 27, jsou li přítomna kardiovaskulární a metabolická rizika související s obezitou. Farmakoterapie obezity se nedoporučuje u pacientů ve věku nad 65 let a u dětí. Kontraindikace vyplývají z mechanismu působení jednotlivých farmak a s ním spojeného možného výskytu nežádoucích účinků [6]. Je li snížení hmotnosti s farmaky za tři měsíce ≥ 5 % původní hmotnosti bez nežádoucích účinků, můžeme pokračovat v léčbě.
Současnými dostupnými antiobezitiky v ČR jsou orlistat (Xenical), fentermin, kombinace naltrexon/bupropion (Mysimba) a od listopadu 2018 liraglutid (Saxenda).
Orlistat
Orlistat představuje antiobezitikum
vyzkoušené více než osmi miliony
pacientů, které je používáno
v klinické praxi od roku
1998 u dospělých a od roku 2004 v USA
a v Kanadě i u adolescentů.
Orlistat je inhibitor střevní lipázy – inhibuje část
účinku enzymů trávících tuky. Redukce hmotnosti zde dosahujeme
sníženým vstřebáváním tuků ze střeva,
a to asi o 30 % při dávce
120 mg (25 % při dávce 60 mg), čímž
dojde k redukci kalorického obsahu
jídla na zhruba 600 kJ/den. Pokud dochází k nedodržování
diety hlavně ve smyslu zvýšeného
příjmu tuků, trpí
pacient nadýmáním, odchodem stolice
spolu s nevstřebaným tukem, mastným až imperativním
průjmem. V tomto směru působí
orlistat jako tzv. výukový lék. Je třeba
zmínit, že nežádoucí
účinky se mohou objevit i přes dodržování dietních
opatření, citlivost k léku je
individuální. Průměrný pokles hmotnosti je 5,5 kg za rok.
Vidíme i významné zlepšení
v lipidovém spektru, zlepšení
citlivosti k inzulinu, pokles hodnot
glykovaného hemoglobinu, u obézních
nediabetiků dochází k významnému
snížení rizika vzniku diabetu 2. typu (37 %). Léky
lze podávat dlouhodobě i po dobu čtyř let, minimálně
však tři měsíce ke zjištění
efektu. Orlistat působí jako účinné
antiobezitikum vhodné ke komplexní léčbě
metabolického syndromu. Po čtyřech
letech užívání je pokles hmotnosti o 2,8 kg větší, než
jaký byl doložen u placeba [7] (graf 1).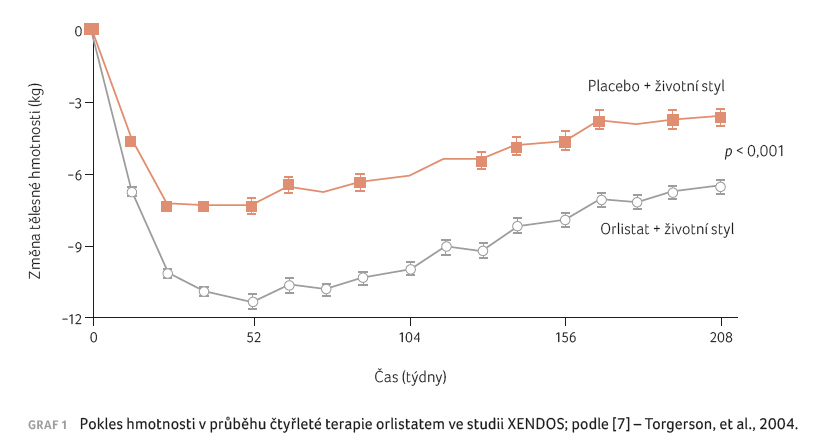
Fentermin
V České republice je fentermin registrován jako Adipex ret. 15 mg v tabletě (tbl.). Byl vyroben již v roce 1971, zde je na trhu od roku 1991. V současné době nejsou dostupné signifikantní údaje týkající se změny morbidity a mortality, neboť v době uvedení na trh nebyly požadovány. Fentermin vede k uvolňování dopaminu v CNS a při jeho podávání je možný vznik závislosti. Přípravek lze používat pouze po omezenou dobu – maximálně tři měsíce (dle SPC). Podává se jako doplněk k redukční dietě u pacientů s BMI ≥ 30 jednou denně ráno, často zvláště na počátku redukce hmotnosti pro usnadnění omezení množství potravy. I když je krátkodobě efektivní, prakticky vždy vede k jojo efektu právě z důvodu, že jej lze užívat pouze po určitou přesně stanovenou dobu. Poměrně dobře snižuje chuť k jídlu. Má mnoho závažných nežádoucích účinků, které se projevují až při delším užívání (tři a více měsíců). Proto byl již v mnoha zemích EU stažen z trhu. Nyní je možnost preskripce omezena pouze na opiátový recept s modrým pruhem. Příčinou takovéto restrikce bylo jeho zneužívání k výrobě návykové látky pervitinu. U některých pacientů, kteří dostávali anorektika tohoto typu, byly zaznamenány případy závažné, často fatální pulmonální hypertenze. Dlouhodobá léčba tímto přípravkem je spojena s rizikem farmakologické tolerance, závislosti a s abstinenčními příznaky. Nejběžnějšími popsanými nežádoucími účinky jsou psychotické reakce nebo psychózy, deprese, nervozita, agitovanost, poruchy spánku a vertigo, tachykardie, palpitace, hypertenze. Všechny léky se zachovaným psychostimulačním účinkem jsou zatíženy určitým rizikem vzniku drogové závislosti.
V USA je fentermin stále široce předepisován a tvoří asi 60‒70 % preskripce antiobezitik, větší význam má však zde nabízená kombinace topiramátu s fenterminem.
Topiramát s fenterminem
Jedná se o fixní kombinaci schválenou americkým Úřadem pro kontrolu potravin a léčiv (FDA) v roce 2012. Přípravky nesou název Qnexa a Qsymia a lze je získat pouze v USA. Kombinovaný přípravek má mnohem větší efekt než monoterapie. Fentermin sám o sobě cestou amfetaminu a fenyletylaminu potlačuje chuť k jídlu, antiepileptikum topiramát vede k redukci hmotnosti. V kombinaci topiramát snižuje závislost na fenterminu. Nejrozsáhlejší klinické sledování léčby touto kombinací představuje CONQUER, randomizovaná, placebem kontrolovaná dvojitě zaslepená studie, do níž bylo zařazeno 2 487 nemocných s hodnotou BMI 27‒45 kg/m2 a s minimálně dvěma komorbiditami souvisejícími s metabolickým syndromem. Po roce sledování zhubli lidé v placebové skupině o 1,4 kg, ve skupině s nižší dávkou fenterminu/topiramátu 7,5 mg/46 mg o 8,1 kg a ve skupině s dávkou fenterminu/topiramátu 15 mg/92 mg o 10,2 kg. Nejčastějšími nežádoucími účinky byly sucho v ústech, parestezie, zácpa, nespavost, motání hlavy. Depresivní epizody prodělalo 7 % nemocných ve skupině s vyšší dávkou kombinačního přípravku, podobně úzkostné poruchy se v této skupině vyskytly v 8 % [8].
AQCLAIM je čtyřletá prospektivní klinická studie uskutečněná v EU s 16 000 obézními s vysokým kardiovaskulárním rizikem. Ukončení studie se očekává koncem letošního roku. Sledován byl dlouhodobý efekt na výskyt závažné srdeční příhody (major adverse cardiac event, MACE) a dále hospitalizace pro srdeční selhání, nestabilní angina pectoris a srdeční revaskularizace. Data těsně před ukončením studie jsou velmi povzbudivá, přípravek nemá vliv na kardiovaskulární onemocnění (výsledek byl prezentován na Evropském obezitologickém kongresu, Vídeň 2018).
Lorkaserin
Lorkaserin ve formě přípravků Lorquess či Belviq je schválen v USA prostřednictvím FDA již od roku 2012. Jedná se o látku ze skupiny agonistů serotoninových receptorů. Zvyšuje pocit sytosti působením na 5-HT2C serotoninové receptory pouze v mozku, nemá prakticky nežádoucí účinky. Centrum působení je v hypotalamu ovlivněním produkce proopiomelanokortinu. Redukce hmotnosti v klinických studiích představuje více než 10 % původní hmotnosti po jednom roce užívání, což odpovídalo v průměru 8 kg. Po dvou letech je průměrný hmotnostní úbytek 6 kg. Přibližně 22 % pacientů zhubne o více než 10 % hmotnosti, 5 % hmotnosti je redukováno u poloviny nemocných. Při hodnocení pacientů nediabetiků jich 85 % udrželo po 52 týdnech terapie hmotnost sníženou o 5 % a 50 % pacientů dokonce o 10 % původní hmotnosti [9,10]. Kritériem, zda byli sledovaní hodnoceni jako respondéři, byla redukce hmotnosti o více než 5 % trvající 12 týdnů od zahájení terapie.
Nebylo prokázáno riziko vzniku plicní hypertenze či chlopňových vad, byla prokázána bezpečnost z hlediska rizika vzniku kardiovaskulárních chorob. Nejčastějšími nežádoucími účinky jsou bolesti hlavy, infekty horních dýchacích cest a nauzea, zvláště v počátku užívání. V Evropě probíhá závěrečné zhodnocení studie CAMELLIA TIMI. Jedná se o randomizovanou, multicentrickou, dvojitě zaslepenou studii u velmi rizikové populace 12 000 pacientů s kardiovaskulárním onemocněním a s diabetes mellitus 2. typu. Studie probíhala od roku 2014 do července 2018, prokázala kardiovaskulární bezpečnost, bez výskytu MACE oproti placebu.
Naltrexon s bupropionem
Bupropion je aktivátorem proopiomelanokortinové osy a jako antidepresivum vede společně s antagonistou opioidních receptorů naltrexonem ve spojení s intenzivní kognitivně behaviorální terapií (intensive behavioral therapy, IBT) k redukci hmotnosti. Předpokládá se stimulace melanokortinové osy a synergické efekty na oblast mezencefalu [11]. Ve Spojených státech amerických a v Jižní Koreji je k dispozici od roku 2015 přípravek s názvem Contrave (naltrexon 8 mg/bupropion 90 mg). Od roku 2015 je též Evropskou lékovou agenturou (EMA) schválena kombinace Mysimba 8 mg/90 mg ve formě tablet s prodlouženým uvolňováním. Lék je určen k redukci hmotnosti pacientů s BMI ≥ 30 a s BMI ≥ 27 s komorbiditami. Obě látky samostatně jsou již na trhu více než 30 let a nemají zásadní nežádoucí účinky, zejména výskyt kardiovaskulárních onemocnění a depresí. Dávkování je postupné s titrací po jedné tabletě týdně, tedy od 1 tbl. ráno po 2 tbl. ráno a večer. Postupnou titrací předcházíme možnému výskytu nežádoucích účinků, dle vlastních zkušeností je efekt očekáván od konce třetího týdne podávání.
Bupropion je látka určená k terapii depresivních onemocnění a k odvykání kouření (dostupná od roku 1989). Snižuje příjem potravy prostřednictvím inhibice zpětného vychytávání dopaminu a noradrenalinu, aktivuje hypotalamickou proopiomelanokortinovou anorexigenní osu, potlačuje chuť k jídlu, zvyšuje kontrolu nad jídlem a zmírňuje craving (bažení).
Naltrexon je opioidní antagonista užívaný při léčbě závislosti na opioidech a alkoholu (dostupný od roku 1984). Rovněž snižuje příjem potravy inhibicí opioidních neuronů tlumících hypotalamickou melanokortinovou anorexigenní osu a tlumí tzv. odměňovací (reward) systém v CNS.
V klinických studiích
byla prokázána průměrná redukce hmotnosti o 9,3 %
(8,2 kg) a zmenšení obvodu pasu o 6,2 cm za 56
týdnů léčby. Asi 34 % pacientů
zredukovalo svoji původní hmotnost o 10 %
a více. Snížení o 11,5 % hmotnosti a zmenšení
obvodu pasu o 10 cm byly dokumentovány ve studii spolu
s IBT. V této
větvi 55 % pacientů zredukovalo
svoji původní hmotnost o 10 %
a více [12] (graf 2).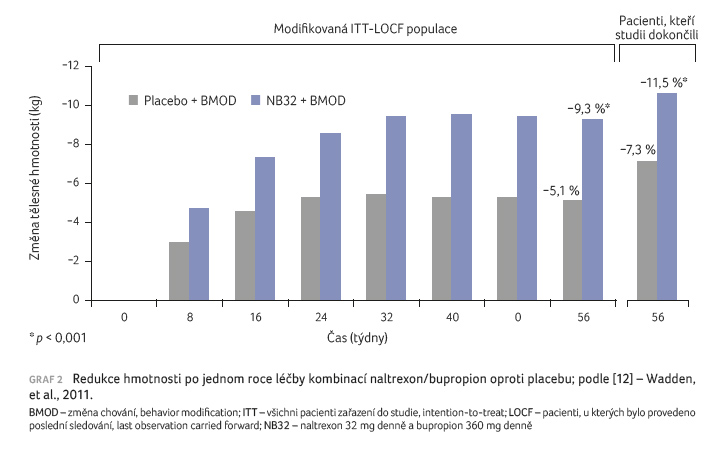
Pozitivní efekt vidíme na zmenšení obvodu pasu, redukci koncentrace triglyceridů, LDL cholesterolu, glykovaného hemoglobinu, snížení hodnot glykemie, diastolického krevního tlaku a zvýšení hodnot HDL cholesterolu. Kombinace nemá vliv na tepovou frekvenci. Do studií hodnotících kardiovaskulární bezpečnost bylo zahrnuto 13 000 pacientů.
Zatím nejčastějšími nežádoucími účinky jsou nauzea (32 %), zácpa (19 %), cefalea (18 %), zvracení (11 %), závrať a sucho v ústech. Kontraindikaci představují těžké psychiatrické poruchy, epilepsie, léková či alkoholová závislost, současné podávání léků se stejným složením, podávání inhibitorů monoaminooxidázy a užívání dětskými pacienty.
Liraglutid
První analog GLP 1
(glukagonu podobný peptid 1) schválený FDA v roce 2014
k léčbě obezity nese název Saxenda.
Ačkoliv v Evropě EMA povolila lék již v roce 2015, v ČR
je možnost preskripce až od listopadu
2018. Jedná se o injekční přípravek,
který se podává 1× denně subkutánně. V přípravku
Saxenda jedna dávka liraglutidu (3 mg)
představuje objem roztoku 3 ml (obr. 1). Zahájení léčby probíhá s postupnou titrací
dávky od 0,6 ml 1× denně vždy o 0,6 ml
po jednom týdnu až k dávce 3,0 ml denně. Postupnou
titrací dávky se snažíme předejít rozvoji nejčastějších
nežádoucích účinků.
V léčbě diabetu používáme
analoga GLP 1 již několik let, a proto máme i vlastní
bohaté zkušenosti. Tyto látky tlumí
zvýšenou sekreci glukagonu, zvyšují sekreci inzulinu, potlačují
apoptózu beta buněk
pankreatu a zároveň navozují pocit sytosti v mozku,
snižují chuť k jídlu, zpomalují vyprazdňování žaludku,
zvyšují pocit plnosti a snižují příjem potravy. V bílé
tukové tkáni redukují ukládání
tuku stimulací lipolýzy a inhibicí
lipogeneze. Při redukci hmotnosti nedochází ke snížení
klidového energetického výdeje (rest energy
expenditure, REE) [13,14]. Toto
antiobezitikum tak nabízí komplexní, centrální i periferní
efekt.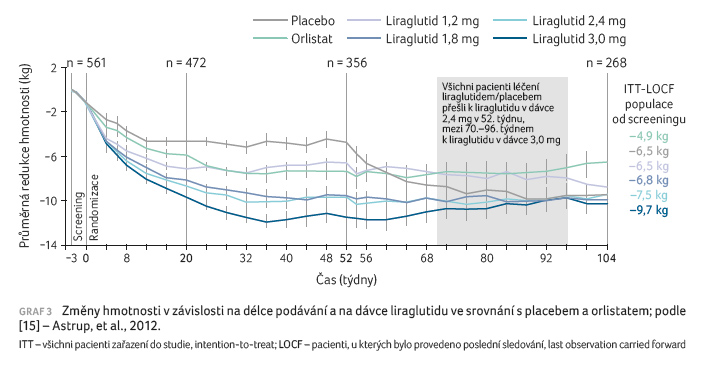
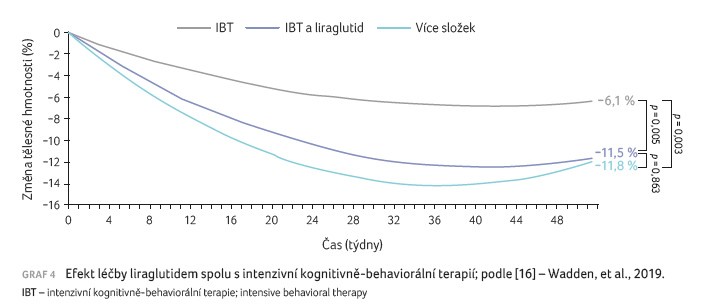
Léčba snižuje krevní tlak a má pozitivní vliv na lipidové parametry a v některých studiích též zmírňuje subklinickou zánětlivou reakci. Agonisté GLP 1 jsou efektivní k navození a udržení hmotnostního úbytku po dobu 104 týdnů s dobrou tolerancí a bezpečností. U nediabetiků/respondérů dosahuje hmotnostní úbytek 10,3 kg za rok a 9,7 kg za dva roky aplikace [15] (graf 3). Pokud kromě běžné edukace a redukční diety 1 000‒1 200 kcal/den poskytneme obéznímu k léčbě liraglutidem ještě IBT, můžeme očekávat redukci až o 11,5 % původní hmotnosti za rok. To je významně více než u samotné IBT, kdy obézní zhubli za rok o 6,1 % hmotnosti [16] (graf 4).
Z nežádoucích účinků je nejčastější nauzea (40 %), dále pak zvracení (16 %), průjem, zácpa, bolesti břicha, nazofaryngitida, cefalea, únava, artralgie a také sporadický výskyt pankreatitidy. Kontraindikací podání je medulární karcinom
štítné žlázy, pankreatitida v anamnéze. Efekt terapie je posuzován dle FDA po 16 týdnech, kdy účinek redukce má být ≥ 4 % původní hmotnosti, dle EMA je kontrola po 12 týdnech a úbytek by měl být ≥ 5 % původní hmotnosti. Uchování pera před použitím je doporučeno v chladničce při teplotě od 2 do 8 °C. Při aplikaci pak uchování pera při pokojové teplotě 15‒30 °C, nebo opět v chladničce.
Perspektivní je další analog GLP 1 semaglutid, který je zatím zkoušen v rámci studií. Při jeho aplikaci dochází k redukci o 15 % původní hmotnosti za rok (výsledek byl prezentován na Evropském obezitologickém kongresu, Vídeň 2018).
Elsinorské prášky
Elsinorské prášky jsou magistraliter připravená kombinace efedrinu s kofeinem podávaná ráno a v poledne. Předpokládá se zvýšení termogeneze. Lék není akceptován všemi obezitology, nicméně podle vlastní zkušenosti je u některých pacientů efektivní. Nežádoucí účinky a možnost lékové závislosti omezují dobu jejich užívání na tři měsíce.
Farmaka snižující hmotnost určená
k léčbě jiných onemocnění
Již při odebírání anamnézy obézního pacienta si všímáme veškeré medikace, kterou nemocný užívá. Řada léků má vliv na zvýšení hmotnosti (např. některá psychofarmaka vedou ke vzestupu hmotnosti během týdnů). Pokud je to možné, pak doporučíme výměnu za vhodnější přípravek. Mnoho léků má naopak pozitivní vliv na redukci hmotnosti. Některá antidepresiva ovlivňují příjem potravy tím, že působením v CNS vyvolávají pocit nasycení či tlumí pocit hladu, a to prostřednictvím neuropřenašečů, jako jsou serotonin, noradrenalin a dopamin. Do skupiny látek ovlivňujících zpětné vychytávání (reuptake inhibitors) patří bupropion, fluoxetin, duloxetin, venlafaxin a další. Jestliže je to možné, neurologové mohou předepsat rovněž topiramát.
Z léků určených k terapii diabetes mellitus 2. typu jsou vhodná především analoga GLP 1 a glifloziny (inhibitory přenašeče SGLT2 v proximálním tubulu ledvin), v USA navíc ještě antidiabetika amylin a bromokriptin. V léčbě obezity jsou úspěšně zkoušeny léky na principu inhibitorů SGLT1 a SGLT2 působící zejména v tračníku, nyní se nacházejí v poslední fázi klinických studií.
Závěr
Léčba obezity a zejména přidružených onemocnění má výrazný ekonomický dopad. Terapii je třeba brát zodpovědně, určit si reálné cíle a dle toho volit kromě úpravy životního stylu farmakologickou a eventuálně bariatricko metabolickou chirurgickou léčbu. Jedná se vždy o úzkou spolupráci lékaře či zdravotnického pracovníka na jedné straně a obézního pacienta na straně druhé. Pacient musí být nejen motivován, ale také si musí být vědom nutnosti celoživotní léčby a změny životního stylu. Současná farmakoterapie nabízí účinnou a bezpečnou léčbu. Farmakologická terapie obezity je hrazena pacientem.
Seznam použité literatury
- [1] Padwal RS, Pajewski NM, Allison DB, Sharma AM. Using the Edmonton obesity staging system to predict mortality in a population‑representative cohort of people with overweight and obesity. CMAJ 2011; 183: E1059‒E1066.
- [2] Lébl J. Nový pohled na etiopatogenezi obezity, přednáška postgraduálního bloku 54. diabetologických dnů, Luhačovice 2018. Dostupné na: https://dia.euni.cz/article/5191?bid=0&search=1
- [3] Svačina Š. Obezitologie a teorie metabolického syndromu. Praha: Triton, 2013; s. 33‒40.
- [4] Apovian CM. The Obesity Epidemic — Understanding the Disease and the Treatment. N Engl J Med 2016; 374: 177‒179.
- [5] Harrison P. Obesity Is a Disease, Not a Choice (Experts Advise). Dostupné na: https://www.medscape.com/viewarticle/896444
- [6] Hainer V, et al. Základy klinické obezitologie. 2. přepracované a doplněné vydání. Praha: Grada, 2011; s. 277‒280.
- [7] Torgerson JS, Hauptman J, Boldrin MN, Sjöström L. XENical in the Prevention of Diabetes in Obese Subjects (XENDOS) Study. Diabetes Care 2004; 27: 155‒161.
- [8] Gadde KM, Allison DB, Ryan DH, et al. Effects of low‑dose, controlled‑release, phentermine plus topiramate combination on weight and associated comorbidities in overweight and obese adults (CONQUER): a randomised, placebo‑controlled, phase 3 trial. Lancet 2011; 377: 1341‒1352.
- [9] Smith SR, Weissman NJ, Anderson CM, et al. Multicenter, placebo‑controlled trial of lorcaserin for weight management. N Engl J Med 2010; 363: 245‒256.
- [10] Nigro SC, Luon D, Baker WL. Lorcaserin: a novel serotonin 2C agonist for the treatment of obesity. Curr Med Res Opin 2013; 29: 839‒848.
- [11] Billes SK, Sinnayah P, Cowley Ma. Naltrexone/bupropion for obesity: An investigational combination pharmacotherapy for weight loss. Pharmacol Res 2014; 84: 1‒11.
- [12] Wadden TA, Foreyt JP, Foster GD, et al. Weight Loss With Naltrexone SR/Bupropion SR Combination Therapy as an adjunct to Behavior Modification: The COR‑BMOD Trial. Obesity (Silver Spring) 2011; 19: 110–120.
- [13] Flint A, Raben A, Ersbøll AK, et al. The effect of physiological levels of glucagon‑like peptide‑1 on appetite, gastric emptying, energy and substrate metabolism in obesity. Int J Obes Relat Metab Disord 2001; 25: 781–792.
- [14] Deacon CF, Nauck MA, Toft‑Nielsen M, et al. Both subcutaneously and intravenously administered glucagon‑ like peptide 1 are rapidly degraded from the NH2‑terminus in type II diabetic patients and in healthy subjects. Diabetes 1995; 44: 1126–1131.
- [15] Astrup A, Carraro R, Finer N, et al. Safety, tolerability and sustained weight loss over 2 years with the once‑daily human GLP‑1 analog, liraglutide. Int J Obes (Lond) 2012; 36: 843‒854.
- [16] Wadden TA, Walsh OA, Berkowitz RI, et al. Intensive Behavioral Therapy for Obesity Combined with Liraglutide 3.0 mg: A Randomized Controlled Trial. Obesity 2019; 27: 75‒86.