Nový koncept v léčbě kardiovaskulárních onemocnění – duální inhibice neutrální endopeptidázy a systému RAA
Souhrn:
Při chronickém srdečním selhání se dlouhodobě aktivují neurohumorální systémy, které působí vazokonstrikčně a vedou k retenci sodíkových iontů a vody. Hlavními z těchto systémů jsou systém renin‑angiotenzin‑aldosteron (RAAS) a systém sympatoadrenální (SAS). Jejich farmakologická inhibice inhibitory angiotenzin konvertujícího enzymu (ACE), ev. sartany se spolu s betablokátory stala základem léčby chronického srdečního selhání se sníženou ejekční frakcí levé komory (HFrEF). U nemocných, kteří jsou i přes tuto léčbu nadále symptomatičtí, je doporučeno přidat ještě blokátor mineralokortikoidních receptorů. Při chronickém srdečním selhání se však aktivují také kontraregulační neurohumorální systémy, které působí vazodilataci, natriurézu a diurézu. Hlavním z těchto kontraregulačních systémů jsou natriuretické peptidy (NP). Současná inhibice RAAS na úrovni receptorů AT1 pro angiotenzin II a neprilysinu – enzymu, který štěpí NP na neaktivní štěpy – se v klinické studii PARADIGM‑HF ukázala být v léčbě HFrEF účinnější než v současnosti standardní inhibice RAAS na úrovni ACE. Proto se první duální inhibitor receptorů pro angiotenzin II a neprilysinu (ARNI) sakubitril‑valsartan dostal do nových doporučených postupů pro léčbu chronického HFrEF. Je doporučen jako účinnější náhrada za inhibitor ACE/sartan pro ambulantní nemocné, kteří jsou i přes dosavadní léčbu stále symptomatičtí a jsou ve stabilizovaném klinickém stavu.
Key words: chronic heart failure – HFrEF – dual neurohumoral inhibition – sacubitril/valsartan – natriuretic peptides.
Summary:
Chronic heart failure leads to long-term activation of neurohumoral systems which have vasoconstricting effect, and cause sodium and water retention. Renin-angiotensin-aldosteron system (RAAS), and sympatoadrenal system (SAS) represent the main elements of these systems. Their pharmacological blockage by angiotensin-converting enzyme (ACE) inhibitors or possible sartans has become together with beta-blockers the mainstay of chronic heart failure with reduced ejection fraction (HFrEF) treatment. In patients who are still symptomatic in spite of appropriate treatment, it is also recommended to add a mineralocorticoid receptor antagonist. There are contraregulatory neurohumoral systems activated in chronic heart failure as well, causing vasodilation, natriuresis, and diuresis. The main constituent part of those contraregulatory systems being natriuretic peptides (NP). Simultaneous inhibition of RAAS at the level of AT1 receptors for angiotensin II and inhibition of neprilysin – enzyme cleaving NPs into inactive metabolites – has been proven to be more effective compared to contemporary standard inhibition of RAAS at the level of ACE by PARADIGM-HF trial. Therefore the first dual inhibitor of both the angiotensin II receptors and the neprilysin (ARNI) sacubitril/valsartan has been added into the new guidelines for the treatment of chronic HFrEF. It is recommended as more effective substitute for ACE inhibitor/sartan for outpatients who are still symptomatic in spite of existing treatment and are in stable clinical condition.
Základem léčby je kombinace inhibitorů RAAS a betablokátorů
Chronické srdeční selhání vede
k dlouhodobé neurohumorální aktivaci,
především systému renin angiotenzin aldosteron (RAAS)
a systému sympatoadrenálního (SAS), ale také systému
endotelinového a vazopresinového. Jejím výsledkem je
vazokonstrikce, retence sodíkových iontů a vody s cílem
udržet dostatečný srdeční výdej a střední arteriální
tlak nezbytný k adekvátní perfuzi životně důležitých
orgánů a periferních tkání. Pokud je takováto
neurohumorální aktivace zapojena krátkodobě (např. při akutním
inzultu vedoucím k systolické dysfunkci levé srdeční
komory), je prospěšná a může být až život zachraňující.
Je li však zapojena dlouhodobě, jako je tomu při chronickém
srdečním selhání, je jednoznačně škodlivá. K vazokonstrikci,
která zvyšuje afterload, a k retenci sodíkových iontů
a vody, které zvyšují preload, se přidává rovněž
proliferace vaziva a hypertrofie kardiomyocytů, jejich apoptóza
a další nepříznivé děje, jež srdeční selhání zhoršují
a uzavírají tak bludný kruh. Současně se však aktivují
také kontraregulační neurohumorální systémy, které naopak mají
škodlivým důsledkům aktivace RAAS, SAS a dalších zabránit,
nebo je alespoň mitigovat. Hlavním z těchto systémů jsou
natriuretické peptidy ANP a BNP, jež se tvoří v myokardu
a uvolňují se do oběhu vlivem zvýšeného napětí
selhávajícího myokardu. Natriuretické peptidy (NP) mají účinky
vazodilatační, natriuretické, antiproliferační, antifibrotické
a antiapoptotické. Při chronickém srdečním selhání se
mezi neurohumorálními působky vazokonstrikčními,
antinatriuretickými a promitotickými a působky
vazodilatačními, natriuretickými a antimitotickými vytváří
určitá rovnováha. Správnost tohoto patogenetického konceptu
srdečního selhání byla potvrzena mimořádným úspěchem
farmakologické blokády vazokonstrikčních a antinatriuretických
neurohumorálních systémů. Blokátory RAAS (inhibitory ACE
a blokátory receptorů AT1 pro angiotenzin II –
sartany) a betablokátory jsou v současnosti
u srdečního selhání se sníženou ejekční frakcí
levé komory (heart failure with reduced ejection fraction, HFrEF)
léky první volby. Dalšími neurohumorálními blokátory, které
by se měly podávat každému symptomatickému nemocnému s HFrEF,
jsou blokátory mineralokortikoidních receptorů (spironolakton nebo
eplerenon). Všechny tyto přípravky příznivě ovlivňují![OBR. 1 algoritmus léčby chronického srdečního selhání se sníženou ejekční frakcí levé komory podle doporučených postupů evropské i České kardiologické společnosti z roku 2016; podle [2] – Špinar, et al., 2016. aCei – inhibitor angiotenzin konvertujícího enzymu; arni – duální inhibitor receptoru pro angiotenzin II a neprilysinu, angiotensin receptor-neprilysin inhibitor; Crt – srdeční resynchronizační léčba, cardiac resynchronization therapy; ef – ejekční frakce; h‑isd – hydralazin/izosorbid dinitrát; hfref – srdeční selhání se sníženou ejekční frakcí levé komory, heart failure with reduced ejection fraction; iCd – implantabilní kardioverter-defi brilátor; lvad – mechanická podpora levé komory, left ventricle assist device; Mra – blokátor mineralokortikoidních receptorů; QRS – kmity komorového komplexu na EKG; sf – srdeční frekvence; vt/vf – komorová tachykardie/fi brilace komor, ventricular tachycardia/ventricular fi brillation](https://www.remedia.cz/photo-a-31092---.jpg) nejen
symptomy srdečního selhání, ale rovněž zlepšují prognózu
nemocných včetně vlivu na významný pokles mortality. Jejich
účinek byl vyzkoušen a potvrzen v mnoha randomizovaných
kontrolovaných klinických studiích, a proto jsou
v současnosti inhibitory ACE (nebo při jejich intoleranci či
kontraindikacích sartany), betablokátory a ev. blokátory
mineralokortikoidních receptorů základem léčby HFrEF založené
na důkazech [1,2] (obr. 1).
nejen
symptomy srdečního selhání, ale rovněž zlepšují prognózu
nemocných včetně vlivu na významný pokles mortality. Jejich
účinek byl vyzkoušen a potvrzen v mnoha randomizovaných
kontrolovaných klinických studiích, a proto jsou
v současnosti inhibitory ACE (nebo při jejich intoleranci či
kontraindikacích sartany), betablokátory a ev. blokátory
mineralokortikoidních receptorů základem léčby HFrEF založené
na důkazech [1,2] (obr. 1).
Zvýšení aktivity natriuretických peptidů
Druhou teoretickou možností, jak farmakologicky zmírnit symptomy srdečního selhání a zabránit jeho progresi, je stimulovat kontraregulační neurohumorální systémy s vazodilatačními, natriuretickými a antiproliferačními vlastnostmi, především systém NP. K tomuto cíli vedou dvě možné cesty – první je exogenní podávání NP připravených metodami genetického inženýrství a druhou je zabránění jejich biodegradaci, čímž se zvýší jejich plazmatické koncentrace. První cesta byla vyzkoušena a přinesla zklamání. Rekombinantně připravený lidský BNP (nesiritid), který se musí podávat parenterálně (v i.v. infuzi), sice měl při akutním srdečním selhání příznivé hemodynamické, neurohumorální a renální účinky a v klinické studii u akutního srdečního selhání (ASCEND HF) také vedl k mírné redukci dušnosti, ale při dlouhodobém podávání nesnížil ani mortalitu, ani morbiditu [3,4]. Nesiritid je registrován a přechodně byl (nad)užíván ve Spojených státech amerických, v Evropě registrován není.
Natriuretické peptidy jsou biodegradovány dvojím způsobem. Prvním je vazba na receptor typu C (NPRC, tzv. clearancový receptor) a druhým jejich hydrolýza na inaktivní peptidy enzymem neutrální endopeptidázou (NEP), který je znám také pod řadou synonym, např. dnes dominantně používaný termín neprilysin, ale též enkefalináza, vazopeptidáza nebo atripeptidáza. Zatímco ovlivnit expresi nebo aktivitu receptorů NPRC neumíme, inhibovat enzym NEP dokážeme. S perspektivou nového léčebného principu chronického srdečního selhání byly zkoušeny různé inhibitory NEP (např. racekadotril, ekadotril a kandoxatril). Při akutním podání byla pozorována celá řada příznivých účinků, např. zvýšení plazmatické koncentrace ANP, zvýšení natriurézy, snížení tlaku v pravé síni a tlaku v zaklínění plicnice. Farmaceutický průmysl se soustředil na léčebné využití inhibitorů NEP především u hypertenze, a proto bylo velkým zklamáním, že chronicky podávaný candoxatril nevedl k významnému poklesu krevního tlaku (TK) [5]. To mělo za následek zastavení dalšího klinického výzkumu této skupiny látek. Pravděpodobným vysvětlením, proč inhibice NEP nevedla k trvalému poklesu TK, je fakt, že substrátem enzymu NEP jsou nejen peptidy s vazodilatačními účinky (NP, bradykinin aj.), ale také peptidy s účinky vazokonstrikčními (např. angiotenzin II, endotelin aj.). Při inhibici NEP jsou tedy vazodilatační a jiné prospěšné účinky NP znehodnoceny opačnými účinky např. angiotenzinu II.
Duální inhibice NEP a RAAS
Logickým řešením tohoto problému byla kombinovaná inhibice NEP a RAAS. Byla vyvinuta řada duálních inhibitorů, jejichž hlavním představitelem byl omapatrilát, látka, která současně inhibuje NEP a ACE (kininázu II, a jak se později ukázalo, ještě další enzym štěpící bradykinin ‒ aminopeptidázu P). Omapatrilát byl zkoušen ve velkých klinických studiích jednak u nemocných se srdečním selháním (studie OVERTURA), jednak u nemocných s arteriální hypertenzí (studie OCTAVE). Komparátorem byl v obou případech inhibitor ACE enalapril. Ve studii OVERTURA nebyl u 5 770 nemocných s HFrEF zjištěn žádný rozdíl ani v mortalitě, ani v hospitalizacích pro srdeční selhání mezi omapatrilátem podávaným v denní dávce 1× 40 mg a enalaprilem podávaným v dávce 2× 10 mg [6]. Pravděpodobným vysvětlením může být již výše zmíněný fakt, že inhibice NEP sice vede k chtěnému a prospěšnému zvýšení aktivity NP, ale současně také inhibuje biodegradaci vazokonstrikčně a antidiureticky působícího angiotenzinu II.
Do studie OCTAVE bylo zařazeno celkem 25 302 hypertoniků, jimž byl podáván buď omapatrilát v denní dávce titrované od 10 mg do 80 mg 1× denně, nebo enalapril titrovaný v dávce od 5 mg do 40 mg 1× denně. Omapatrilát se sice ukázal být ve snížení TK superiorní k enalaprilu (snížil více systolický TK za 8 týdnů, v průměru o 3,6 mm Hg), ale významně častěji se při jeho podávání vyskytoval angioedém (2,17 % vs. 0,68 %) [7]. Ze vzniku angioedému je obviňován bradykinin a substance P. Omapatrilát inhibuje hned tři enzymy, které bradykinin odbourávají – ACE (kininázu II), NEP a aminopeptidázu P. Tím byl vysvětlován trojnásobný výskyt angioedému při léčbě hypertoniků omapatrilátem ve studii OCTAVE. Zvýšený výskyt nežádoucích účinků, zejména angioedému, a také non superiorita omapatrilátu ve srovnání s enalaprilem u pacientů s HFrEF vedly k ukončení klinického výzkumu této látky i všech příbuzných molekul v této třídě léků. V té době se zdálo, že duální inhibice RAAS a NP představuje slepý koncept.
Nová léková skupina ARNI a její zástupce – sakubitril valsartan
Výzkum však pokračoval a po letech
přišla společnost Novartis s molekulou pojmenovanou zprvu jen
kódovým označením LCZ696, která měla vlastnosti jednak
blokátoru receptorů AT1 pro angiotenzin II (valsartanová
část molekuly) a jednak inhibitoru neprilysinu – NEP
(sakubitrilová část molekuly). Pro tuto novou třídu 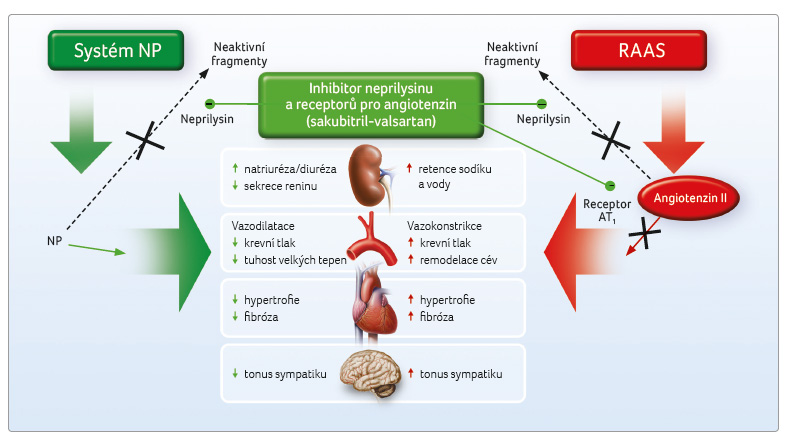 duálních
inhibitorů se začal používat termín ARNI (z anglického
Angiotensin Receptor – Neprilysin Inhibitor). Schéma účinku
ARNI je shrnuto na obr. 2.
Protože nová kombinace sakubitril valsartan neblokuje ACE
(kininázu II), ale blokuje receptor pro angiotenzin II a aktivní
metabolit sakubitrilu AHU377 neinhibuje aminopeptidázu P,
předpokládalo se, že riziko vzniku angioedému bude u tohoto
léku podstatně nižší než u omapatrilátu. Výzkumníci,
kteří začali sakubitril-valsartan klinicky testovat, se také
poučili z chyb ve studiích s omapatrilátem
a podávali sakubitril-valsartan dvakrát denně, což zaručuje
vyrovnané plazmatické koncentrace a dostatečnou inhibici
neprilysinu i angiotenzinu II po celých 24 hodin [8].
Zkoušená denní dávka 200 mg je ekvivalentní dávce 160 mg
valsartanu, tedy dávce vyzkoušené v klinických studiích
s valsartanem. Současně sakubitril v této dávce
obsažený vede k téměř kompletní inhibici NEP.
duálních
inhibitorů se začal používat termín ARNI (z anglického
Angiotensin Receptor – Neprilysin Inhibitor). Schéma účinku
ARNI je shrnuto na obr. 2.
Protože nová kombinace sakubitril valsartan neblokuje ACE
(kininázu II), ale blokuje receptor pro angiotenzin II a aktivní
metabolit sakubitrilu AHU377 neinhibuje aminopeptidázu P,
předpokládalo se, že riziko vzniku angioedému bude u tohoto
léku podstatně nižší než u omapatrilátu. Výzkumníci,
kteří začali sakubitril-valsartan klinicky testovat, se také
poučili z chyb ve studiích s omapatrilátem
a podávali sakubitril-valsartan dvakrát denně, což zaručuje
vyrovnané plazmatické koncentrace a dostatečnou inhibici
neprilysinu i angiotenzinu II po celých 24 hodin [8].
Zkoušená denní dávka 200 mg je ekvivalentní dávce 160 mg
valsartanu, tedy dávce vyzkoušené v klinických studiích
s valsartanem. Současně sakubitril v této dávce
obsažený vede k téměř kompletní inhibici NEP.
Při klinickém zkoušení sakubitril-valsartanu byla prakticky vynechána fáze II klinického hodnocení a nový lék byl rovnou testován u nemocných s HFrEF proti aktivní léčbě enalaprilem ve velké mortalitně morbiditní studii PARADIGM HF (Prospective comparison of ARNI with ACE I to Determine Impact on Global Mortality and morbidity in Heart Failure) [9]. Studie byla navržena tak, aby bylo minimalizováno riziko nežádoucích účinků. Aby se zabránilo vzniku hypotenze a byla zajištěna skutečně 24hodinová inhibice účinků angiotenzinu II i neprilysinu, byla denní dávka přípravku podávána dvakrát denně místo jednou denně, jak tomu bylo u vysoké dávky omapatrilátu v dřívějších studiích. U všech pacientů byla rovněž před randomizací testována tolerance jak enalaprilu v denní dávce 2× 10 mg, tak sakubitril valsartanu v denní dávce 2× 200 mg v průběhu vstupní periody. V průběhu této periody tak byli identifikováni nemocní, kteří byli náchylní k hypotenzi a/nebo k angioedému, a ti pak nebyli do studie zařazeni. Do studie PARADIGM HF bylo zařazeno 8 442 pacientů se srdečním selháním ve funkční třídě NYHA II‒IV (klasifikace New York Heart Association), kteří měli na začátku studie hodnotu ejekční frakce levé komory ≤ 0,40, v průběhu studie byla tato hodnota dodatkem k protokolu snížena na ≤ 0,35, a současně měli zvýšené plazmatické koncentrace NP (BNP ≥ 150 pg/ml nebo NT proBNP ≥ 600 pg/ml). Jak již bylo řečeno výše, pacienti byli v poměru 1 : 1 randomizováni k užívání buď sakubitril-valsartanu v dávce 2× 200 mg denně, nebo enalaprilu v denní dávce 2× 10 mg denně. Primárním sledovaným ukazatelem byl součet úmrtí z kardiovaskulárních příčin a hospitalizací pro srdeční selhání [9].
Klinická studie PARADIGM HF
skončila jednoznačným úspěchem. Její výsledky byly poprvé
prezentovány na výročním sjezdu Evropské kardiologické
společnosti v roce 2014 v Barceloně a současně
publikovány v časopise New England Journal of Medicine
[10]. Podle pravidel, předem stanovených protokolem, byla studie
ukončena předčasně po průměrné době sledování 27
měsíců, protože byly překročeny hranice pro jednoznačný
prospěch z léčby sakubitril-valsartanem. V době
ukončení studie se primární složený ukazatel objevil u 914
(21,8 %) nemocných, kteří užívali sakubitril-valsartan,
a u 117 nemocných (26,5 %), kteří užívali enalapril
(HR [hazard ratio] = 0,80 pro sakubitril-valsartan; Cl
[interval ![GRAF 1A–C hlavní výsledky klinické studie paradiGM‑hf; podle [10] – McMurray, et al., 2014. (a) výskyt primárního složeného ukazatele – kardiovaskulárních úmrtí nebo hospitalizací pro srdeční selhání; (b) kardiovaskulární mortalita; (c) celková mortalita. hr – poměr rizik, hazard ratio; nnt – počet nemocných, které je třeba léčit, aby se zabránilo vzniku jedné příhody, number needed to treat](https://www.remedia.cz/photo-a-31094---.jpg) spolehlivosti] 0,73‒0,87; p < 0,001)
(graf 1a). Přípravek
též vedl k významnému poklesu kardiovaskulární mortality
(HR = 0,80; CI 0,71‒0,89; p < 0,001)
(graf 1b), stejně
jako celkové mortality (HR = 0,84; CI 0,76‒0,93;
p < 0,001)
(graf 1c).
Ve srovnání s enalaprilem snížil také riziko
hospitalizací pro srdeční selhání
o 21 % (p < 0,001),
zmírnil symptomy a zlepšil toleranci zátěže (p < 0,001).
Co se týká bezpečnosti, pacienti, kteří užívali
sakubitril-valsartan, sice měli vyšší výskyt hypotenze, ale
nižší výskyt případů zhoršení renálních funkcí,
hyperkalemie a kašle než pacienti, kteří užívali
enalapril. Výskyt angioedému byl zanedbatelný a žádný
z případů nebyl klinicky závažný. Studie tak prokázala,
že duální inhibice sakubitril-valsartanem je významně účinnější
jak v prevenci úmrtí, tak i v prevenci hospitalizací
než v současnosti standardně používaná inhibice RAAS
inhibitory ACE. V léčbě chronického srdečního selhání se
nám tak poprvé dostává do rukou lék, který se nepřidává
k již používaným přípravkům, ale má ambice nahradit
inhibitory RAAS (inhibitory ACE nebo sartany), protože je účinnější
a přinejmenším stejně bezpečný. Při podskupinové analýze
nebyly nalezeny žádné skupiny nemocných, kteří by z duální
inhibice měli větší, nebo naopak menší přínos než ostatní
[10].
spolehlivosti] 0,73‒0,87; p < 0,001)
(graf 1a). Přípravek
též vedl k významnému poklesu kardiovaskulární mortality
(HR = 0,80; CI 0,71‒0,89; p < 0,001)
(graf 1b), stejně
jako celkové mortality (HR = 0,84; CI 0,76‒0,93;
p < 0,001)
(graf 1c).
Ve srovnání s enalaprilem snížil také riziko
hospitalizací pro srdeční selhání
o 21 % (p < 0,001),
zmírnil symptomy a zlepšil toleranci zátěže (p < 0,001).
Co se týká bezpečnosti, pacienti, kteří užívali
sakubitril-valsartan, sice měli vyšší výskyt hypotenze, ale
nižší výskyt případů zhoršení renálních funkcí,
hyperkalemie a kašle než pacienti, kteří užívali
enalapril. Výskyt angioedému byl zanedbatelný a žádný
z případů nebyl klinicky závažný. Studie tak prokázala,
že duální inhibice sakubitril-valsartanem je významně účinnější
jak v prevenci úmrtí, tak i v prevenci hospitalizací
než v současnosti standardně používaná inhibice RAAS
inhibitory ACE. V léčbě chronického srdečního selhání se
nám tak poprvé dostává do rukou lék, který se nepřidává
k již používaným přípravkům, ale má ambice nahradit
inhibitory RAAS (inhibitory ACE nebo sartany), protože je účinnější
a přinejmenším stejně bezpečný. Při podskupinové analýze
nebyly nalezeny žádné skupiny nemocných, kteří by z duální
inhibice měli větší, nebo naopak menší přínos než ostatní
[10].
Přesvědčivé výsledky studie PARADIGM HF vedly k tomu, že se nová léková skupina ARNI, resp. její zatím jediný zástupce sakubitril valsartan, dostala do nových doporučení Evropské i České kardiologické společnosti pro léčbu chronického srdečního selhání [1,2] (obr. 1). Podle nich je ARNI doporučen (se sílou doporučení I a s úrovní důkazů A) jako náhražka inhibitoru ACE (ev. sartanu) u ambulantních nemocných, kteří jsou při standardní léčbě (tj. inhibitorem ACE/sartanem, betablokátorem a ev. diuretikem) ve stabilizovaném stavu a stále symptomatičtí.
V současné době probíhá obdobná klinická studie pod akronymem PARAGON HF (Efficacy and Safety of LCZ696 Compared to Valsartan, on Morbidity and Mortality in Heart Failure Patients with Preserved Ejection Fraction), která testuje účinek sakubitril-valsartanu u pacientů se srdečním selháním se zachovanou ejekční frakcí levé komory (heart failure with preserved ejection fraction, HFpEF). Tato studie navazuje na slibné výsledky pilotní studie PARAMOUNT (Prospective comparison of ARNI with ARB on Management Of heart failUre with preserved ejectioN fracTion) [11].
Duální inhibitor sakubitril valsartan dostal obchodní název Entresto a byl na základě výše uvedených výsledků studie PARADIGM HF registrován jak americkým Úřadem pro kontrolu potravin a léčiv (FDA), tak i Evropskou lékovou agenturou (EMA) pro léčbu srdečního selhání se sníženou ejekční frakcí levé komory. V České republice v současnosti probíhá správní řízení pro stanovení výše a podmínek úhrady tohoto nového přípravku.
Nejen léčba srdečního selhání
Dosavadní klinický výzkum a vývoj duálního inhibitoru receptoru pro angiotenzin II a neprilysinu – sakubitril valsartanu ‒ byl zaměřen naprosto dominantně na léčbu srdečního selhání. Nicméně vlastnosti tohoto nového přípravku ho předurčují rovněž k terapii hypertenze. Zcela nedávno byly publikovány výsledky studie PARAMETER (Prospective comparison of Angiotensin Receptor neprilysin inhibitor with Angiotensin Receptor blocker MEasuring arterial sTiffness in the eldERly study) [12]. Cílem této studie bylo zhodnotit krátkodobé (12 týdnů) i dlouhodobé (52 týdnů) účinky sakubitril valsartanu ve srovnání s blokátorem receptorů pro angiotenzin II olmesartanem na ukazatele centrální aortální hemodynamiky a na arteriální tuhost u starších nemocných se systolickou hypertenzí a zvýšeným pulzovým tlakem (pulse pressure, PP). Do studie bylo zařazeno 454 starších nemocných se systolickým TK ≥ 150 mm Hg a PP > 60 mm Hg. Po 12 týdnech snížil sakubitril-valsartan centrální aortální systolický tlak v průměru o 3,7 mm Hg více než olmesartan (‒12,6 mm Hg oproti ‒8,9 mm Hg; p = 0,01) a pulzový tlak v průměru o 2,4 mm Hg více než olmesartan (‒6,4 mm Hg vs. ‒4,0 mm Hg; p = 0,012). Podobně byl sakubitril valsartan účinnější ve snížení brachiálního systolického TK (Δ ‒3,8 mm Hg; p = 0,016) a brachiálního PP (Δ ‒2,8 mm Hg; p = 0,013). Při 24hodinovém ambulantním monitorování TK byl při podávání sakubitril valsartanu pokles všech tlaků nejvýraznější v nočním období. Větší pokles TK přetrvával i po 52 týdnech léčby, vymizela však statistická významnost rozdílů proti olmesartanu, protože v průběhu studie bylo povoleno přidávání dalších antihypertenziv (v pořadí amlodipin, hydrochlorotiazid). Počet pacientů, jimž bylo pro nedostatečnou kontrolu hypertenze potřeba přidat další antihypertenziva, byl při léčbě sakubitril valsartanem významně nižší než při terapii olmesartanem. Sakubitril valsartan rovněž vedl k většímu poklesu rychlosti šíření karotido femorální pulzové vlny (pulse wave velocity, PWV), tento pokles byl tím výraznější, čím vyšší byla výchozí hodnota PWV, tedy čím byla tuhost tepen větší.
Pro úplnost je třeba uvést, že existují také duální inhibitory NEP a ECE (endotelin konvertující enzym). Příkladem je daglutril, perorálně podávaná látka s kódovým označením CGS 26303, která byla zatím zkoušena pouze v experimentech na zvířatech. Tento duální inhibitor byl testován na hypertenzních krysách ve snaze zabránit u nich přechodu hypertrofie levé komory do srdečního selhání. Účinek duálního inhibitoru CGS 26303 byl v těchto experimentech větší než samotná inhibice NEP a byl srovnatelný s účinkem samotného inhibitoru ACE [13]. U krys s experimentální hypertrofií levé komory, která byla navozena bandáží aorty, duální inhibitor daglutril zmírnil remodelaci a zlepšil diastolickou funkci srdce [14]. V jiném experimentálním uspořádání byla na krysách zkoušena dokonce i trojitá neurohumorální inhibice ACE, ECE a NEP. Trojitá neurohumorální inhibice snížila u krys s chronickým srdečním selháním krevní tlak o něco více než samotná inhibice ACE nebo duální inhibice ECE/NEP a také vedla k výraznějšímu zmenšení systolického i diastolického rozměru levé komory [15]. Výsledky experimentů s duální neurohumorální inhibicí ECE/NEP, nebo dokonce s trojitou inhibicí ACE/ECE/NEP zatím však nebyly natolik přesvědčivé, aby byl zahájen klinický výzkum na lidech.
Seznam použité literatury
- [1] Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016; 37: 2129–2200.
- [2] Špinar J, Hradec J, Špinarová L, Vítovec J. Souhrn Doporučených postupů ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání z roku 2016. Připraven Českou kardiologickou společností. Cor Vasa 2016; 58: 597–636.
- [3] Publication Committee for the VMAC Investigators (Vasodilatation in the Management of Acute CHF). Intravenous neseritide vs nitroglycerin for treatment of decompensated congestive heart failure: a randomized controlled trial. JAMA 2002; 287: 1531–1540.
- [4] Yancy CW, Krum H, Massie BM, et al. Safety and efficacy of outpatient nesiritide in patients with advanced heart failure: results of the Second Follow‑Up Serial Infusions of Nesiritide (FUSION II) trial. Circ Heart Fail 2008; 1: 9–16.
- [5] Bevan EG, Connell JM, Doyle J, et al. Candoxatril, a neutral endopeptidase inhibitor: efficacy and tolerability in essential hypertension. J Hypertens 1992; 10: 607–613.
- [6] Packer M, Califf R, Konstam MA, et al. Comparison of omapatrilat and enalapril in patients with chronic heart failure: the Omapatrilat Versus Enalapril Randomized Trial of Utility in Reducing Events (OVERTURE). Circulation 2002; 106: 920–926.
- [7] Kostis JB, Packer M, Black HR, et al. Omapatrilat and enalapril in patients with hypertension: the Omapatrilat Cardiovascular Treatment vs. Enalapril (OCTAVE) trial. Am J Hypertens 2004; 7: 103–111.
- [8] McMurray JJV. Neprilysin inhibition to treat heart failure: a tale of science, serendipity, and second chances. Eur J Heart Fail 2015; 17: 242–247.
- [9] McMurray JJV, Packer M, Desai AS, et al. Dual angiotensin receptor and neprilysin inhibition as an alternative to angiotensin‑converting enzyme inhibition in patients with chronic systolic heart failure: rationale for and design of the Prospective comparison of ARNI with ACEI to Determine Impact on Global Mortality and morbidity in Heart Failure trial (PARADIGM‑HF). Eur J Heart Fail 2013; 15: 1062–1073.
- [10] McMurray JJ, Packer M, Desai AS, et al. PARADIGM‑HF Investigators and Committees. Angiotensin‑neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371: 993–1004.
- [11] Solomon SD, Zile M, Pieske B, et al. Prospective comparison of ARNI with ARB on Management Of heart failUre with preserved ejectioN fracTion (PARAMOUNT) Investigators. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double‑blind randomised controlled trial. Lancet 2012; 380: 1387–1395.
- [12] Williams B, Cockroft JR, Kario K, et al. Effects of sacubitril‑valsartan versus olmesartan on central hemodynamics in the elderly with systolic hypertension. Hypertension 2017; 69: 411–420.
- [13] Emoto N, Raharjo SB, Isaka D, et al. Dual ECE/NEP inhibition on cardiac and neurohumoral function during the transition from hypertrophy to heart failure. Hypertension 2005: 45: 1145–1152.
- [14] Tan M, Wu B, Chen I, et al. Dual ECE/NEP inhibition improves diastolic function and ameliorated cardiac remodeling in rats with myocardial dysfunction secondary to pressure overload by aortic binding. Exp Clin Cardiol 2014; 19: 358–368.
- [15] Mellin V, Jeng AY, Monteil C, et al. Triple ACE‑ECE‑NEP inhibition in heart failure: a comparison with ACE and dual ECE‑NEP inhibition. J Cardiovasc Pharmacol 2005: 46: 390–397.