Nový pohled na buprenorfin v léčbě nádorové bolesti
Souhrn
Sláma O. Nový pohled na buprenorfin v léčbě nádorové bolesti. Remedia 2023; 33: 404–406.
Základní lékovou skupinou pro léčbu středně silné a silné nádorové bolesti jsou silné opioidy. V současné době je v České republice dostupná celá řada zástupců této skupiny a lékař musí při volbě léku u konkrétního pacienta zohlednit řadu faktorů. Lepší pochopení mechanismu analgetického účinku a znalost nežádoucích účinků umožňují individuální volbu, která zohledňuje širší klinický kontext i individuální charakteristiky pacienta. Buprenorfin je silný opioid s jedinečným profilem působení na různé opioidní receptory. Díky tomu dosahuje analgetického účinku zcela srovnatelného s ostatními čistými agonisty opioidních receptorů. Analgetický účinek maximální doporučené dávky buprenorfinu TTS (140 μg/h) je dostatečný ke zvládnutí bolestivých stavů u většiny pacientů v pokročilých fázích nádorové nemoci. Profil nežádoucích účinků se zdá být příznivější než u ostatních silných opioidů: buprenorfin je méně tlumivý a působí méně nevolnosti, zvracení a zácpy a nižší riziko rozvoje tolerance. Díky specifickému metabolismu nedochází ani při významné renální insuficienci k akumulaci aktivních metabolitů v plazmě. Jedinečné farmakodynamické a farmakokinetické vlastnosti buprenorfinu z něj dělají účinné analgetikum s příznivým bezpečnostním profilem pro silné nádorové bolesti. Zvláště významný prospěch mohou mít z léčby buprenorfinem starší pacienti a pacienti s renálním selháváním.
Klíčová slova: nádorová bolest – buprenorfin – nežádoucí účinky opioidů – bezpečná léčba silnými opioidy.
Summary
Slama O. New approach to buprenorphine in the treatment of cancer pain. Remedia 2023; 33: 404–406.
Strong opioids are the mainstay of moderate to severe cancer pain management. Currently, many different drugs from this group are available in the Czech Republic and the physician has to consider various factors when choosing a specific one for a given patient. Better understanding of the analgesic effect and the knowledge of side effects make an individual choice possible in a way respecting the broader clinical context and patient characteristics. Buprenorphine is a strong opioid with a unique profile of action achieved through different opioid receptors. Thanks to this trait, its analgesic effect is no weaker than that of pure opioid receptor agonists. The maximum recommended dose of buprenorphine TTS (140μg/h) is capable of getting the pain under control in most patients with advanced cancer. The side effect profile seems to be more favorable than in other strong opioids: buprenorphine causes less sedation, less nausea, vomiting and constipation and its intake is associated with lower risk of tolerance development. Its metabolism is specific in such a way that active metabolites of buprenorphine do not accumulate in plasma even in severe renal insufficiency. Unique pharmacodynamic and pharmacokinetic properties thus make buprenorphine an effective analgesic drug with a favorable safety profile for the treatment of severe cancer pain. Patients who may profit from buprenorphine the most are those of higher age and those suffering from renal insufficiency.
Key words: cancer pain – buprenorphine – side effects of opioids – safe treatment with strong opioids.
Opioidy jako lék první volby při středně silné a silné nádorové bolesti
Jedním z nejčastějších a nejzávažnějších symptomů pokročilého onkologického onemocnění je bolest. Hodnocení a léčba nádorové bolesti vyžadují komplexní přístup, který zohledňuje nejen patofyziologické charakteristiky bolesti (nocicepci), ale také psychologické, sociální a spirituální souvislosti tzv. celkové bolesti [1]. K mírnění tělesné bolesti využíváme analgetika a koanalgetika. Světová zdravotnická organizace (WHO) v roce 2018 formulovala nová doporučení pro farmakoterapii nádorové bolesti [2]. Doporučení již nepracují se schematickým „analgetickým žebříčkem“, který evokoval představu, že při léčbě bolesti vždy nejdříve začínáme paracetamolem, metamizolem nebo jinými neopioidními analgetiky a teprve tehdy, když po několika dnech nedosáhneme úlevy, přidáváme slabé opioidy (tramadol), pokud je bolest hodně silná a stadium nemoci velmi pokročilé, přecházíme na silné opioidy. Dle WHO jsou u středně silné a silné nádorové bolesti silné opioidy lékovou skupinou první volby. V současné době je v ČR dostupná řada silných opioidů v různých lékových formách. Specifické postavení v této skupině patří buprenorfinu.
Farmakologický profil buprenorfinu
Buprenorfin je atypický opioid. Jeho účinek je dán jeho komplexním působením na různých opioidních receptorech, tj. μ, κ, δ i ORL1 (opioid receptor‑like 1). Buprenorfin je parciálním agonistou μ‑receptorů, antagonistou κ‑ a δ‑receptorů a agonistou ORL1 receptorů. Částečný agonismus na μ‑opioidních receptorech navozuje silnou antinocicepci. Současně ale vykazuje stropový efekt na útlum dechového centra a euforii a nižší výskyt některých nežádoucích účinků. Stropovým efektem v této souvislosti rozumíme skutečnost, že od určité („stropové“) dávky nedochází při dalším navýšení k nárůstu supresivního účinku na dechové centrum. Antagonismus na κ‑ a δ‑opioidních receptorech snižuje incidenci zácpy, dechového útlumu, úzkosti a vzniku závislosti. Plný agonismus ORL1 přispívá ke spinální analgezii. Některé studie naznačují, že tento mechanismus snižuje u buprenorfinu potenciál ke vzniku závislosti a navození tolerance, které jsou někdy při dlouhodobém užívání pozorovány u čistých agonistů [3,4].
Buprenorfin je látka s nízkou molekulovou hmotností a vysokou lipofilitou. To vede k jeho dobré biologické dostupnosti. Po absorpci se buprenorfin váže z 96 % na proteiny, zejména na α‑ a β‑globulin, a vykazuje velký distribuční objem. Primárním místem metabolizace buprenorfinu, stejně jako ostatních opioidů, jsou játra. Buprenorfin podléhá výraznému first‑pass efektu (přibližně z 90 %). Proto při perorálním podávání nemá prakticky žádný analgetický účinek. Hlavním metabolitem je norbuprenorfin, který má stejnou afinitu k μ‑receptoru jako morfin, ale výrazně nižší analgetickou aktivitu. Buprenorfin se tak řadí k opioidům bez významných aktivních nebo toxických metabolitů. Většina buprenorfinu je během 4-6 dnů eliminována žlučí. Metabolismus buprenorfinu je při snížené renální clearance ovlivněn pouze minimálně, a pro pacienty s renální dysfunkcí je tak velmi bezpečnou variantou [3,4]. Buprenorfin je metabolizován v játrech. Intenzita a trvání účinku mohou být u pacientů s poruchami jaterních funkcí změněny. Z toho důvodu by takoví pacienti měli být během léčby buprenorfinem pečlivě sledováni [5].
Lékové formy buprenorfinu
Pro léčbu bolesti jsou dostupné různé lékové formy buprenorfinu: transdermální systémy (náplasti), sublinguální a bukální tablety. V České republice jsou aktuálně pro léčbu bolesti k dispozici náplasti v síle 35, 52,5 a 70 μg/h s frekvencí výměny náplasti dvakrát týdně a relativně nově také náplasti v síle 5, 20, 30 a 40 μg/h s frekvencí výměny jednou týdně. Tyto nižší dávkové síly jsou určeny primárně k léčbě chronické nenádorové bolesti.
Buprenorfin v léčbě nádorové bolesti
Existuje robustní evidence o účinnosti buprenorfinu v léčbě různých typů nádorové bolesti [6,7]. Buprenorfin prokázal svou účinnost v léčbě somatické i viscerální bolesti (např. bolest kostních metastáz, bolest při nádoru slinivky, žaludku nebo orgánů v pánvi) a také neuropatické bolesti (bolest při nádorovém útlaku nebo infiltraci míchy a periferních nervů). Svého času bylo otázkou odborných diskusí, jak v kontextu léčby nádorové bolesti rozumět skutečnosti, že je buprenorfin „pouze“ parciálním agonistou μ‑opioidních receptorů. Zaznívaly argumenty, že buprenorfin má pouze částečný (tedy slabší) analgetický účinek, a není proto vhodný pro léčbu silné nádorové bolesti. Publikovaná data a klinická zkušenost však jednoznačně ukazují, že v ekvianalgetických dávkách buprenorfin dosahuje analgetického účinku zcela srovnatelného s ostatními čistými agonisty μ‑opioidních receptorů (např. morfin, fentanyl, hydromorfon, oxykodon).
Bolest u pacientů s dlouhodobým přežitím s metastatickým onemocněním
Pokroky současné onkologie zcela změnily „krajinu“ života s onkologickou nemocí. Mnohé z nádorů, které byly v minulosti spojeny s velmi krátkou prognózou, se dnes díky novým léčebným metodám proměnily v chronická onemocnění. Onemocnění sice není zcela vyléčitelné, pacienti však s metastatickým onemocněním při léčbě žijí často řadu let. Bolest působená např. metastázami do skeletu tak může pacienta provázet pět a více let. To má závažné důsledky pro strategii léčby bolesti a pro volbu analgetika. Část pacientů s „chronickým“ metastatickým onemocněním potřebuje silné opioidy. Cílem zde ale není pouze zmírnit bolest (zajistit komfort), ale především udržet a zlepšit celkovou funkční zdatnost a kvalitu života. Při volbě opioidu tak nabývají na významu některé nežádoucí účinky, které se v kontextu terminální péče nejevily jako relevantní: např. otázka lékových interakcí, imunosupresivní účinky, vliv opioidů na koncentrace pohlavních hormonů atd. Dlouhodobé užívání opioidů rovněž znamená nový kontext z hlediska rizika rozvoje tolerance a různých forem poruch z užívání opioidů (např. abúzus, nesprávné užívání opioidů, psychická závislost). Buprenorfin má minimum významných lékových interakcí, nemá imunosupresivní účinek, nevede k hypogonadismu a má menší potenciál vzniku tolerance a rozvoje závislosti. S ohledem na výše popsané farmakologické vlastnosti lze buprenorfin doporučit u této skupiny pacientů jako silný opioid první volby [8].
Bolest v pokročilých fázích nádorové nemoci
Důvodem rezervovaného postoje některých lékařů k buprenorfinu v kontextu léčby bolesti u pacientů s velmi pokročilým nádorovým onemocněním je obava, že v průběhu progrese nemoci bude potřeba eskalovat dávku tak, že buprenorfin „narazí“ na svůj dávkový strop a nebude ke zvládnutí bolesti stačit. Dle souhrnů údajů originálního přípravku i generických přípravků transdermálního buprenorfinu je za maximální bezpečnou dávku považována uvolňovaná dávka 140 μg/h. To odpovídá ekvivalentu perorálního morfinu (oral morphine equivalent, OME) 240-300 mg/den. Při bližším pohledu na dávky, které jsou potřeba k dostatečnému zmírnění nádorové bolesti u pacientů v posledních měsících a týdnech života, nacházíme velkou variabilitu (10–3 000 mg OME). Potřebná dávka závisí na řadě proměnných.
Ukazuje se, že jednou z nejvýznamnějších je věk pacienta. V zajímavé studii z prostředí amerických domácích a lůžkových hospiců byla u 7 201 pacientů s nádorovou bolestí léčených různými silnými opioidy srovnávána potřebná dávka opioidů v posledním měsíci života [9]. Střední hodnota se pohybovala kolem 100-120 mg/den OME. To odpovídá buprenorfinu 70 μg/h. Potřebná dávka opioidů velmi významně klesala v závislosti na věku pacienta. Ve věkové kategorii 40-49 let potřebovalo ≥ 120 mg/den OME více než 54 % pacientů, v kategorii 80-89 let pouze 19 % pacientů (graf 1) [9]. Výsledky této retrospektivní studie potvrzují také vlastní zkušenosti autora, že dávka buprenorfinu 140 μg/h je dostatečná ke zvládnutí bolestivých stavů u většiny pacientů v pokročilých fázích nádorové nemoci. V případě nedostatečného účinku této dávky (při současné optimální kombinaci neopioidních analgetik a koanalgetik) lze zvážit přechod na jiný druh silného opioidu (tzv. rotace opioidů), přidání jiného opioidu do kombinace (tzv. duální opioidní terapie) nebo navýšení dávky buprenorfinu ve formě transdermálního terapeutického systému (TTS; např. na 3× 70 μg). Autor má klinickou zkušenost, že tento „off label“ postup v některých případech vede k významnému zlepšení kontroly bolesti při zachování přijatelného profilu nežádoucích účinků.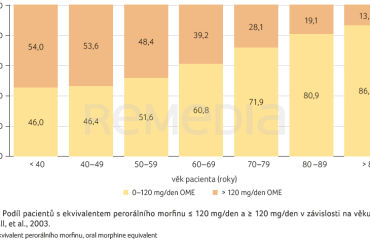
Léčba průlomové bolesti u pacientů léčených transdermálním buprenorfinem
Zařazení buprenorfinu mezi parciální agonisty μ‑receptorů někdy vedlo k nedorozumění ohledně možností kombinace buprenorfinu a jiných opioidů při léčbě průlomové bolesti. Buprenorfin neobsazuje všechny μ‑opioidní receptory. V analgetických dávkách je tak dostatek volných receptorů a při řešení průlomových bolestí lze kombinovat transdermální buprenorfin s perorálním nebo parenterálním morfinem nebo sublinguálním či parenterálním fentanylem, aniž by došlo k oslabení jejich analgetického účinku [3,7].
Buprenorfin v léčbě bolesti u pacientů v závěru života
V prostředí péče o pacienty v závěru života je při volbě silného opioidu potřeba zohlednit rovněž přítomnost ostatních symptomů (především dušnost a úzkost). U pacientů s výraznou dušností (která není kauzálně řešitelná) a úzkostí nabývají na významu některé „vedlejší“ účinky silných opioidů. Klinicky významný účinek na zmírnění subjektivního dechového distresu (dušnosti) byl zatím prokázán pouze u čistých agonistů μ‑opioidních receptorů (morfin, hydromorfon, fentanyl). Rovněž u euforizujícího a anxiolytického účinku existuje významná evidence a klinická zkušenost s čistými agonisty. Účinek buprenorfinu v těchto indikacích zatím nebyl systematicky zkoumán. V některých případech terminální paliativní péče je proto výhodné pacienta převést z buprenorfinu na některý z čistých agonistů. Největší zkušenost je s morfinem.
Závěr
Jedinečné farmakodynamické a farmakokinetické vlastnosti buprenorfinu z něj dělají účinné analgetikum s příznivým bezpečnostním profilem pro léčbu středně silné a silné nádorové bolesti. Zvláště významný prospěch mohou mít z léčby buprenorfinem pacienti s dlouhodobou nádorovou bolestí, starší pacienti a pacienti s renálním selháváním. U těchto skupin by měl být buprenorfin zvažován jako silný opioid první volby.
Literatura
[1] Sláma O, et al. Farmakoterapie nádorové bolesti. In: Modrá kniha české onkologické společnosti (2023), 29. vydání. Dostupné na: https://www.linkos.cz/lekar‑a‑multidisciplinarni‑tym/personalizovana‑onkologie/modra‑kniha‑cos/aktualni‑vydani‑modre‑knihy/29‑33‑farmakoterapie‑nadorove‑bolesti/
[2] WHO Guidelines for the Pharmacological and Radiotherapeutic Management of Cancer Pain in Adults and Adolescents. Geneva: World Health Organization; 2018. Dostupné na: https://www.ncbi.nlm.nih.gov/books/NBK537492/pdf/Bookshelf_NBK537492.pdf
[3] Gudin J, Fudin J. A Narrative Pharmacological Review of Buprenorphine: A Unique Opioid for the Treatment of Chronic Pain. Pain Ther 2020; 9: 41−54.
[4] Vranová V. Nová transdermální forma nízkodávkovaného buprenorfinu. Bolest (Tigis) 2023; 2: 61−63.
[5] SPC Buprenorfin Stada. Dostupné na: https://prehledy.sukl.cz/prehled_leciv.html#/detail‑reg/0251682
[6] Pergolizzi JV Jr, Mercadante S, Echaburu AV, et al. The role of transdermal buprenorphine in the treatment of cancer pain: an expert panel consensus. Curr Med Res Opin 2009; 25: 1517−1528.
[7] Degnan M, Mousa SA. A narrative review of buprenorphine in adult cancer pain. Exp Rev Clin Pharmacol 2020; 13: 1159–1167.
[8] Chwistek M, Sherry D, Kinczewski L, et al. Should Buprenorphine be considered a first‑line opioid for the treatment of moderate to severe cancer pain? J Pain Symptom Manage 2023; S0885‑3924(23)00566‑3. Online ahead of print.
[9] Hall S, Gallagher RM, Gracely E, et al. The terminal cancer patient: effects of age, gender, and primary tumor site on opioid dose. Pain Med 200