O inhibici IL‑17A aktuálně z klinických studií – sekukinumab dlouhodobě účinný u ankylozující spondylitidy i psoriatické artritidy
Souhrn:
Je remise či minimální aktivita onemocnění dosažitelným a udržitelným cílem při podávání sekukinumabu, inhibitoru IL‑17A, u nemocných s psoriatickou artritidou? Přináší tato terapie dlouhodobou úlevu od symptomů, zmírnění únavy nebo zpomalení radiografické progrese u pacientů s ankylozující spondylitidou? A je nějak ovlivněna předchozí léčbou inhibitory TNFα, nebo nikoliv?
O nových výsledcích týkajících se podávání sekukinumabu v terapii spondyloartritid (SpA) se měli možnost dozvědět účastníci satelitních sympozií společnosti Novartis, která byla součástí odborného programu jubilejního 70. výročního kongresu EULAR (European League Against Rheumatism) 2017 v Madridu. Získali také mj. přehled o tom, jaká je role interleukinu 17A (IL 17A) v indukci zánětu, entezitidy a nové kostní formace a že inhibice daného cytokinu cílí na zánětlivé i strukturální změny nemoci.
Za odlišnosti v patologii různých zánětlivých onemocnění mohou rozdíly vznikající na molekulární úrovni – na bázi různých cytokinů uvolňovaných imunitními buňkami. Vznikají tak skupiny chronických autoimunitních chorob, pro něž je vždy klíčový určitý „hráč“. Třeba v případě revmatoidní artritidy a velkobuněčné arteriitidy je to cytokin IL 6, ale v případě psoriázy, psoriatické artritidy (PsA) nebo axiální SpA je to osa IL 17/23.
„Víme, že spondyloartritidy zahrnují široké spektrum onemocnění s různými kloubními a mimokloubními projevy, na jejichž patogenezi se z velké části podílí genetická predispozice, dále pak faktory vnějšího prostředí. Progresi choroby ovlivňují jak geneticko imunitní interakce, tak remodelace kostní tkáně i reakce na zánětlivý podnět včetně mechanického poškození. Stěžejní roli při všech těchto procesech přitom hraje cytokin IL 17A,“ konstatoval prof. Dirk Elewaut, PhD, z Universiteit Gent, Belgie.
Je známo, že největší genetická souvislost byla popsána s antigenem HLA B27, jehož patogenní úloha stále není jasná. Jedna z hypotéz (Bowness et al., Annual Review of Immunology 2015) je např. založena na přirozené imunologické funkci HLA B27, kdy imunitní odpověď vůči vlastním antigenům nebo artritogenním peptidům může být imunopatologická. „Může také dojít k tomu, že se HLA-B27 chybně prostorově poskládá a nastane autofagie,“ objasnil prof. Elewaut.
„Th17 a kol.“ jako hlavní producenti
Profesor Elewaut dále připomněl, že pacienti se SpA mají vyšší množství naivních CD4+ T lymfocytů, které se v přítomnosti IL 23, transformujícího růstového faktoru beta (TGFβ), IL 6 a dalších cytokinů diferencují především na Th17 buňky, jež jsou hlavním producentem právě IL 17A. Ten má mnoho biologických účinků včetně indukce IL 6, IL 8, TNFα, chemokinů apod. v různých cílových buňkách, jako jsou fibroblasty, epiteliální a endotelové buňky, makrofágy, dendritické buňky, chondrocyty a osteoblasty. „Cytokin IL 17A má tedy na jedné straně velmi důležité postavení v ochraně proti extracelulárním parazitům, na straně druhé však podporuje vznik zánětu a destrukci kostní i chrupavčité tkáně, pokud je exprimován chronicky a na nevhodných místech,“ objasnil prof. Elewaut.
Kromě Th17 lymfocytů patří mezi další zdroje IL 17A v patogenezi SpA také buňky vrozené imunity – například γδ T lymfocyty, invariantní NK T lymfocyty, CD4/CD8+ T lymfocyty, mastocyty nebo neutrofily –, které se nacházejí v kůži, ve střevní mukózní tkáni či v plicích a hrají roli v ochraně bariérové funkce a epiteliální integrity (Smithová et al., Arthritis & Rheumatology 2014). „Většina z nich je aktivována IL 23, který může být významně produkován dendritickými buňkami a makrofágy v souvislosti s mikrobiální reakcí,“ upřesnil prof. Elewaut a dodal, že sekrece IL 17 a dalších prozánětlivých cytokinů vede ke vzniku entezitidy, synovitidy, střevních zánětů nebo k osteoproliferaci.
V této souvislosti upozornil na několik recentních prací, např. Reinhardtové a kol. (Arthritis & Rheumatology 2016) nebo Cuthberta a kol. (Arthritis & Rheumatology 2017), jež se zmiňují o roli vrozených lymfoidních buněk, konkrétně ILC3 a γδ T lymfocytů, v rozvoji entezitidy. „Populace těchto buněk, které produkují velké množství IL 17A, se totiž nacházejí právě v oblasti entezí, tedy na rozhraní kosti a svalového úponu,“ doplnil prof. Elewaut. Ukazuje se však, že se mohou vyskytovat i v oblasti aorty nebo řasnatého tělesa.
Interleukin 17A společným faktorem pro poškození kůže a kosti
Profesor Georg Schett z Friedrich Alexander Universität Erlangen Nürnberg, Německo, dodal, že IL 17 je mj. charakteristický pro vznik psoriatických lézí a jeho exprese u takto nemocných navíc vede ke ztrátě kostní hmoty (Uluçkan et al., Science Translational Medicine 2016). „Ukázalo se, že při zánětlivých stavech byly rezidentní buňky, které se nacházejí v kůži, jako jsou keratinocyty, γδ T lymfocyty či vrozené lymfoidní buňky, schopny exprimovat IL 17A, jenž systémově inhiboval funkci osteoblastů a osteocytů prostřednictvím Wnt signalizace,“ vysvětlil prof. Schett a dodal: „Tato studie tedy naznačuje, že použití blokátorů IL 17A u pacientů s psoriázou pro ně může být přínosné nejen z hlediska kožního onemocnění, ale i s ohledem na zabránění ztrátě kostní hmoty.“
Představil také několik recentních prací, které popisují tzv. prerevmatické změny u nemocných s psoriatickými kožními lézemi. Studie Simona a kol. publikovaná v Annals of the Rheumatic Diseases (2016) např. prokázala, že u pacientů s psoriázou bez symptomů artritidy nebo entezitidy dochází ve srovnání se zdravými kontrolami statisticky významně častěji k rozvoji entezofytů, a to na mechanicky exponovaných kloubních místech. Typicky byly nalezeny na dorzálních a palmárních stranách hlavic metakarpálních kostí, kde jsou lokalizovány funkční enteze pro extenzorové a flexorové šlachy. Faustini a kol. (Annals of the Rheumatic Diseases 2016) zase poukázali na vznik subklinické synovitidy a osteitidy metakarpofalangeálních kloubů u pacientů s psoriázou.
Profesor Schett shrnul, že terapie cílená na IL 17 ovlivňuje u nemocných s PsA celé spektrum jejich postižení – od kožních lézí přes entezitidu a strukturální poškození až po synovitidu.
Zaměřeno na psoriatickou artritidu
„Slyšeli jsme o klíčové roli IL 17A v patogenezi spondyloartritid. A já se ptám, zda můžeme podáváním sekukinumabu dosáhnout remise či nízké aktivity nemoci. Z programu klinického hodnocení FUTURE u nemocných s psoriatickou artritidou vyplývá, že ano, a dokonce dlouhodobě,“ uvedl své vystoupení Dr. Peter Nash z University of Queensland, Austrálie. Připomněl, že sekukinumab byl testován v randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích fáze III FUTURE 1 (dvouletá s tříletou extenzí) a FUTURE 2 (pětiletá), které potvrdily jeho účinnost a bezpečnost u nemocných s aktivní PsA, tedy s minimálně třemi bolestivými a třemi oteklými klouby, a to i přes dřívější terapii léky modifikujícími chorobu nebo inhibitory tumor nekrotizujícího faktoru alfa (TNFα).
Studie FUTURE 2: dva roky účinnosti sekukinumabu…
Doktor Nash se podrobněji věnoval
nejnovějším výsledkům studie FUTURE 2 (McInnes et al.,
Rheumatology 2017), do níž bylo zařazeno 397 nemocných,
randomizovaných do čtyř ramen – k podávání
placeba, sekukinumabu v dávce 300 mg subkutánně, nebo
150 mg subkutánně, nebo 75 mg subkutánně v týdnu 0, 1,
2, 3 a 4, a následně každé 4 týdny rovněž
subkutánně. Pacienti v placebovém rameni byli v 16. týdnu,
res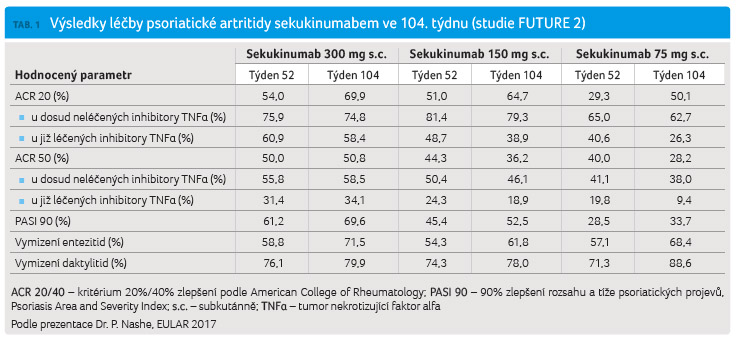 p. ve 24. týdnu převedeni na aktivní léčbu.
Primárního cílového ukazatele, tedy odpovědi ACR 20
(kritérium 20% zlepšení podle American College of Rheumatology)
ve 24. týdnu, dosáhlo 54 %, resp. 51 %, resp. 29,3 %
nemocných léčených 300 mg, resp. 150 mg, resp. 75 mg
sekukinumabu a 15,3 % s placebem (p < 0,0001
pro první dvě srovnání; p < 0,05 pro třetí).
Podobný trend byl zaznamenán také v 52. týdnu
a v případě odpovědi ACR 50. „Recentní data
ukazují setrvalé zlepšení odpovědi ACR 20 i ACR 50
během dvouleté terapie sekukinumabem,“ komentoval Dr. Nash
a upřesnil, že ve 104. týdnu byla ACR 20
zaznamenána u 69,9 %, resp. 64,7 %, resp. 50,1 %
pacientů léčených 300 mg, resp. 150 mg, resp. 75 mg
sekukinumabu, a ACR 50 u 50,8 %, 36,2 % a 28,2 %.
p. ve 24. týdnu převedeni na aktivní léčbu.
Primárního cílového ukazatele, tedy odpovědi ACR 20
(kritérium 20% zlepšení podle American College of Rheumatology)
ve 24. týdnu, dosáhlo 54 %, resp. 51 %, resp. 29,3 %
nemocných léčených 300 mg, resp. 150 mg, resp. 75 mg
sekukinumabu a 15,3 % s placebem (p < 0,0001
pro první dvě srovnání; p < 0,05 pro třetí).
Podobný trend byl zaznamenán také v 52. týdnu
a v případě odpovědi ACR 50. „Recentní data
ukazují setrvalé zlepšení odpovědi ACR 20 i ACR 50
během dvouleté terapie sekukinumabem,“ komentoval Dr. Nash
a upřesnil, že ve 104. týdnu byla ACR 20
zaznamenána u 69,9 %, resp. 64,7 %, resp. 50,1 %
pacientů léčených 300 mg, resp. 150 mg, resp. 75 mg
sekukinumabu, a ACR 50 u 50,8 %, 36,2 % a 28,2 %.
Jak ukazuje tabulka 1, dlouhodobá účinnost sekukinumabu byla potvrzena jak u osob dosud neléčených inhibitory TNFα, tak u těch již předléčených, a dále v různých klinicky významných oblastech pro PsA, jako jsou PASI 90 (index rozsahu a tíže psoriatických projevů), entezitidy či daktylitidy. „Podávání sekukinumabu v obou vyšších dávkách tedy nabízí kontinuální zlepšení příznaků a domén aktivní nemoci, navíc s dobrým bezpečnostním profilem,“ shrnul Dr. Nash.
… a dosažení minimální aktivity nemoci…
Ve zbývající části svojí prezentace se Dr. Nash zaměřil na to, zda je možné při podávání sekukinumabu dosáhnout u pacientů s PsA cílového ukazatele léčby – tedy minimální (minimal disease activity, MDA) nebo velmi nízké aktivity onemocnění či remise nebo nízké aktivity onemocnění podle kritérií PASDAS (Psoriatic Arthritis Disease Activity Score) a DAPSA (Disease Activity for Psoriatic Arthritis).
V této souvislosti nejprve upozornil na subanalýzu studie FUTURE 2 (Coatesová et al., Annals of the Rheumatic Diseases 2016), jež poukázala na udržitelnou MDA během jednoho roku terapie sekukinumabem. V 52. týdnu dosáhlo uvedeného cílového ukazatele 35,5 % pacientů léčených 300 mg sekukinumabu a 33 % nemocných užívajících 150 mg sekukinumabu, přičemž u podskupiny dosud neléčených inhibitory TNFα to bylo 41,3 % a 39 % a u těch, kteří měli na inhibitory TNFα neadekvátní odpověď, pak 23,3 % a 20,7 %. Ukázalo se rovněž, že MDA je při podávání sekukinumabu setrvalá bez ohledu na dobu od stanovení diagnózy. „U podstatné části MDA respondérů přitom byla zaznamenána také velmi nízká aktivita onemocnění – konkrétně u 39,4 % v rameni s vyšší dávkou sekukinumabu a u 31 % s dávkou nižší,“ uvedl Dr. Nash. Z výsledků dále vyplynulo, že u pacientů s MDA došlo po roce léčby sekukinumabem ke statisticky významnému zlepšení příznaků únavy, kvality života související se zdravotním stavem a ke zvýšení produktivity práce ve srovnání s non respondéry.
… bez ohledu na délku trvání onemocnění psoriatickou artritidou nebo na předchozí terapii
Doktor Nash se dále zmínil o aktuálních datech post hoc analýzy studie FUTURE 2 (Coatesová et al., EULAR 2017), která prokázala, že nemocní léčení sekukinumabem jsou schopni dosáhnout nízké aktivity onemocnění podle skóre PASDAS (hodnota 4 až maximálně 14) a udržet ji po dobu dvou let. Hodnota PASDAS je vypočítána na základě globálního hodnocení pacientem a lékařem podle škály VAS (hodnocení intenzity bolesti na 100 mm dlouhé úsečce), SF 36 PCS (souhrn tělesných komponent dotazníku SF 36), počtu oteklých kloubů, počtu citlivých kloubů, entezitidy, daktylitidy a hodnoty C reaktivního proteinu (CRP).
Nízké aktivity PASDAS dosáhl v 16. týdnu větší podíl osob léčených sekukinumabem, konkrétně 38,5 % v rameni s 300 mg a 34,3 % v rameni se 150 mg, v porovnání s placebem (16,1 %). Ve 104. týdnu to pak bylo 59 %, resp. 49,4 % pro vyšší, resp. nižší dávku sekukinumabu. „Pacienti dosud neléčení inhibitory TNFα si nízkou aktivitu PASDAS udrželi častěji než ti již předléčení,“ upřesnil Dr. Nash s tím, že tento terapeutický cílový ukazatel byl evidován u podobného počtu jedinců léčených sekukinumabem bez ohledu na dobu od stanovení diagnózy (≤ 2 roky vs. > 2 roky).
Jiná z aktuálních post hoc analýz studie FUTURE 2 (Smolen et al., EULAR 2017) se zase zaměřila na to, zda je při podávání sekukinumabu možno dosáhnout remise nebo minimální aktivity PsA podle skóre DAPSA. To je definováno pěti parametry – počtem oteklých kloubů, počtem citlivých kloubů, globálním hodnocením pacientem na VAS, hodnocením bolesti na VAS a CRP –, kdy remise nastává při hodnotě < 1,9 a nízká aktivita při hodnotě ≤ 3,2. „Potvrdilo se, že i tento terapeutický cílový ukazatel je v našich silách a že je dlouhodobě udržitelný,“ konstatoval Dr. Nash. Dodal, že v 16. týdnu bylo v remisi 14,4 %, resp. 10 % nemocných léčených 300 mg, resp. 150 mg sekukinumabu versus 4,6 % v placebové skupině, nízkou aktivitu pak mělo 27,8 %, resp. 34 % versus 13,8 % jedinců. „Větší podíl nemocných v remisi byl v podskupině dosud neléčené inhibitory TNFα a v podskupině s včasnou diagnózou PsA,“ doplnil Dr. Nash. Nízké aktivity nemoci nebo remise pak po dvou letech dosáhlo 65,6 % pacientů v rameni s vyšší dávkou sekukinumabu a 53,2 % s dávkou nižší.
Doktor Nash také dokumentoval setrvalé a statisticky významné zlepšení funkce, příznaků únavy a kvality života související se zdravím ve 104. týdnu u pacientů léčených sekukinumabem, kteří dosáhli remise podle DAPSA. Všech pět položek tohoto skóre mělo v případě remise hodnotu nižší než 1 na rozdíl od ostatních klinických stavů, tedy nízké, střední a vysoké aktivity PsA.
Zaměřeno na ankylozující spondylitidu
Nejnovější data sekukinumabu u nemocných s ankylozující spondylitidou (AS) prezentoval na kongresu EULAR v Madridu Dr. Xenofon Baraliakos z Ruhr Universität Bochum, Německo. Upozornil nejprve, že v různých klinických studiích byla prokázána efektivita inhibitorů TNFα při léčbě AS – odpovědi podle ASAS 40 (40% zlepšení v kritériích hodnocení nemoci podle Assessment of SpondyloArthritis International Society) dosáhlo okolo 40‒50 % pacientů. Nicméně stále značná část z nich na tuto terapii neodpověděla, nebo ji netolerovala, případně ji musela ukončit z důvodu významné toxicity. Po selhání anti TNFα léčby zůstává účinný právě sekukinumab, jenž byl testován v klinickém programu MEASURE.
Do něj byli zařazeni dospělí pacienti s aktivní AS definovanou podle modifikovaných tzv. newyorských kritérií BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) ≥ 4 a s bolestí zad na VAS > 40 mm, kteří adekvátně neodpovídali na léčbu nesteroidním antirevmatikem, maximálně jedním inhibitorem TNFα či je netolerovali.
Studie MEASURE 1: sekukinumab má setrvalý efekt…
Dvouletá randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie MEASURE 1 s tříletou extenzí zahrnula 371 nemocných, přičemž zhruba 70 % z nich mělo předchozí zkušenost s anti TNFα terapií. Randomizováni byli do jednoho ze tří ramen – k podávání placeba, sekukinumabu v iniciální dávce 10 mg/kg intravenózně v týdnu 0, 2 a 4 a následně v udržovací dávce 150 mg subkutánně, nebo 75 mg subkutánně každé 4 týdny. Pacienti v placebové skupině, kteří v týdnu 16, resp. 24 nezaznamenali léčebnou odpověď, mohli být převedeni na sekukinumab.
„Z předchozích údajů víme, že během dvouletého podávání sekukinumab poskytl rychlé a setrvalé zmírnění symptomů AS. Z naší nejnovější analýzy publikované v Clinical and Experimental Rheumatology 2017 vyplývá, že jeho účinnost přetrvává až do 156. týdne sledování, přičemž nebyla pozorována žádná nová bezpečnostní rizika,“ konstatoval Dr. Baraliakos. Upřesnil, že z 290 osob, které dokončily hlavní fázi studie, jich 274 vstoupilo do fáze prodloužené (260 dokončilo 156 týdnů léčby). Průměrná doba expozice sekukinumabu byla 137,8 týdne. Po třech letech zaznamenalo odpověď ASAS 20 celkem 80,2 % nemocných léčených sekukinumabem v dávce 150 mg a 75,5 % pacientů s dávkou 75 mg, ASAS 40 pak 61,6 %, resp. 50 % jedinců. „Kontinuální zlepšení bylo pozorováno také v případě indexu aktivity BASDAI, funkčního indexu BASFI (Bath Ankylosing Spondylitis Functional Index) a indexu mobility BASMI (Bath Ankylosing Spondylitis Metrology Index) i ve všech ostatních měřených parametrech, a to bez ohledu na předchozí expozici inhibitorům TNFα,“ komentoval Dr. Baraliakos.
… dlouhodobě zmírňuje únavu a radiografickou progresi
V souvislosti se studií MEASURE 1
se Dr. Baraliakos zmínil o recentní práci Kviena
a kol., prezentované na EULAR 2017, jež poukázala
na dlouhodobé zmírnění únavy při podávání sekukinumabu.
V podskupině nemocných dosud neléčených přípravky
anti TNFα zaznamenalo zlepšení skóre FACIT F
(Functional Assessment of Chronic Illness Therapy Fatigue)
po třech letech 74,3 % léčených vyšší dávkou
sekukinumabu a 69,3 % dávkou nižší, v podskupině
pacientů, kteří měli neadekvátní odpověď
na inhibitory TNFα, to bylo 81,3 %, resp. 69,6 %
(podrobněji viz tab. 2).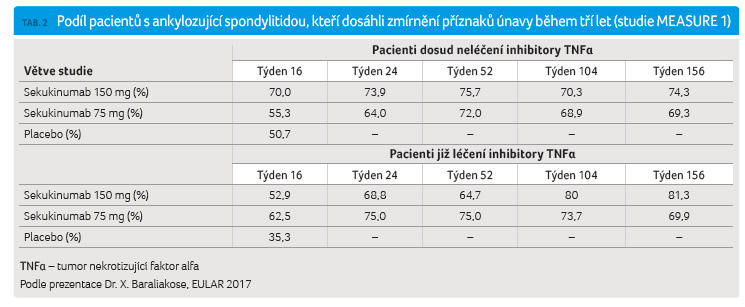
Jiná subanalýza studie MEASURE 1 (Braun et al., Annals of the Rheumatic Diseases 2017) zase naznačila nízkou radiografickou progresi u jedinců s AS, kteří byli po dobu dvou let léčeni sekukinumabem v dávce 150 mg. „Průměrná změna skóre mSASSS (modified Stoke Ankylosing Spondylitis Spinal Score) od počátku sledování do 104. týdne byla 0,3, v podskupině nemocných s vysokou hodnotou CRP pak 0,48 a se syndesmofyty 0,49,“ doplnil s tím, že v případě inhibitorů TNFα byla změna skóre mSASSS větší, ačkoliv nejde o přímé srovnání dvou biologických léčiv v klinických studiích.
Studie MEASURE 2: na expozici anti TNFα léčbě nezáleží
Poté se již Dr. Baraliakos zabýval aktuálními výsledky pětileté randomizované, dvojitě zaslepené, placebem kontrolované studie MEASURE 2, která zahrnula 219 nemocných s AS (55 % bez předchozí zkušenosti s anti TNFα terapií) a měla obdobné uspořádání jako MEASURE 1. Odlišností bylo, že v úvodní fázi byl sekukinumab podáván subkutánně a že z placeba byli všichni nemocní v 16. týdnu převedeni na aktivní léčbu. Primárního cílového ukazatele, tedy ASAS 20 v 16. týdnu, dosáhlo 61,1 % pacientů léčených sekukinumabem v dávce 150 mg, 41,1 % s dávkou 75 mg a 28,4 % s placebem (p < 0,001 pro srovnání s vyšší dávkou sekukinumabu), ASAS 40 pak 36,1 %, resp. 26 %, resp. 10,8 %. Ukázalo se dále, že účinnost sekukinumabu přetrvávala po dobu dvou let.
Jak vyplývá z recentní
subanalýzy Marzo Ortegaové a kol., prezentované na
EULAR 2017, sekukinumab v dávce 150 mg poskytl setrvalé
zmírňování symptomů a zlepšování funkce
u nemocných s AS až do třetího roku sledování,
navíc s vysokou mírou udržení efektivity, přes 80 %,
a s příznivým bezpečnostním profilem. „V rameni
s vyšší dávkou sekukinumabu dokončilo 156 týdnů léčby
86 pacientů ze 106 léčených a v rameni
s nižší dávkou 76 ze 105 pacientů –
častější přerušení terapie v této skupině bylo částečně
způsobeno nedostatečnou odpovědí nebo rozhodnutím nemocného,“
vysvětlil Dr. Baraliakos. Upřesnil, že ve 156. týdnu
byla odpověď ASAS 20 zaznamenána u 70,1 % osob
léčených sekukinumabem v dávce 150 mg (v 52. týdnu
to bylo 74,2 %) a u 54,3 % léčených sekukinumabem
v dávce 75 mg (v 52. týdnu to bylo 62,5 %),
přičemž obdobné trendy byly pozorovány i u ASAS 40.
Výsledky dalších ukazatelů účinnosti sledovaných mezi
2. a 3. rokem studie MEASURE 2 ukazuje tabulka 3.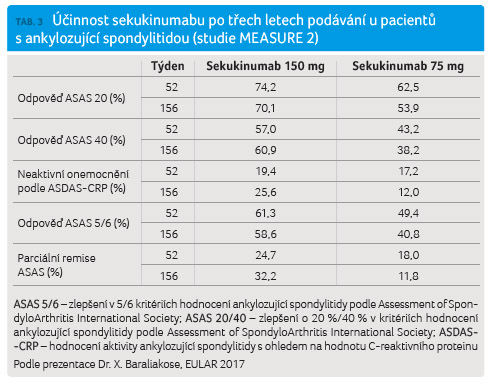
Doktor Baraliakos představil i další práci Marzo Ortegaové a kol., publikovanou v Arthritis Care & Research (2017), která mj. zdokumentovala dvouletou efektivitu sekukinumabu ve studii MEASURE 2 s ohledem na předchozí expozici biologikům. „Klinicky významné zlepšení v 16. týdnu bylo zaznamenáno jak u osob dosud neléčených inhibitory TNFα, tak u těch již předléčených a přetrvalo až do 52. týdne, resp. 104. týdne,“ uvedl.
Konstantní a zvládnutelný bezpečnostní profil
Jak dále poznamenali Dr. Nash a Dr. Baraliakos, z aktuálních dat o sekukinumabu rovněž vyplývá, že nebyla zjištěna žádná nová bezpečnostní rizika při jeho dlouhodobém podávání u nemocných s AS i PsA. Souhrnná analýza Maeseho a kol. (EULAR 2017), do níž byla zařazena data z devíti studií u psoriázy a ze tří studií u PsA, ukázala, že mezi nejčastější nežádoucí účinky u obou diagnóz patřily nazofaryngitida, infekce horních cest dýchacích, bolesti hlavy a artralgie. Výskyt zvlášť sledovaných nežádoucích příhod, jakými jsou kandidové infekce, závažné infekce, idiopatické střevní záněty, neutropenie či významné kardiovaskulární příhody, byl srovnatelný s předchozími hlášeními. Zaznamenány nebyly žádné případy tuberkulózy – ať už nově vzniklé nebo reaktivované.
Pokud se týká bezpečnosti léčby sekukinumabem u AS, ze souhrnné analýzy Deodhara a kol. (EULAR 2017), ve které byla využita data od 510 pacientů ze studií MEASURE 1, 2 a 3, vyplynulo, že během tříletého sledování nebyla identifikována žádná nová bezpečnostní rizika. Adjustovaná incidence jakýchkoliv nežádoucích účinků činila 159,2 na 100 pacientoroků, těch závažných pak 5,4 na 100 pacientoroků. Nejčastěji byly hlášeny nazofaryngitida, průjem, bolesti hlavy a záněty horních cest dýchacích.
Incidence nežádoucích účinků se zvláštním zřetelem byla nízká a v souladu s předchozími údaji během kratší expozice sekukinumabu, přičemž se nevyskytly žádné případy suicidiálního chování nebo deprese.
Redakčně zpracovala Ing. Jana Tlapáková