Osteoporóza u mužů
Osteoporóza u mužů se stává závažným zdravotním problémem. Muže postihuje každá třetí zlomenina proximálního femuru a každý pátý muž starší 50 let utrpí během dalšího života osteoporotickou zlomeninu. Zlomenina u mužů je spojena se zvýšenou mortalitou. Úbytek a zhoršování kvality kostní hmoty u mužů má mnohočetné příčiny a významná je zejména sekundární osteoporóza. Suplementace vápníkem a vitaminem D je nutná, pokud není zajištěn jejich doporučený denní příjem. Pravidelná fyzická aktivita přispívá ke tvorbě kosti a snižuje riziko pádů. Riziko osteoporotických zlomenin snižují antiremodelační a osteoanabolické léky, ale také opatření ovlivňující riziko pádů. Je třeba pracovat na kritériích pro diagnostiku a léčení osteoporózy u mužů.
S prodlužující se délkou života se osteoporóza (OP) stává zdravotním, sociálním a ekonomickým problémem také u mužů. Jeden z pěti padesátiletých mužů prodělá během dalšího života nízkotraumatickou zlomeninu. Závislost mezi rizikem zlomenin, množstvím a kvalitou kostní hmoty, pády a dalšími faktory je zatím u mužů méně objasněna než u žen. Málo víme o příčinách vyšší incidence zlomenin u mužů než u žen až do šestého decennia, jakož i o ![Graf 1 Incidence zlomenin v závislosti na věku a pohlaví; podle [32] – Donaldson, et al., 1990.](https://www.remedia.cz/photo-a-28292---.jpg) příčinách zvýšeného rizika zlomenin v oblasti kyčle u starších mužů, kteří v mládí prodělali traumatickou zlomeninu tibie nebo jiných dlouhých kostí. Po šedesátém roce života se incidence zlomenin exponenciálně zvyšuje s věkem u obou pohlaví a vypovídá o zhoršující se kvalitě kostní hmoty (graf 1). Třetina zlomenin v oblasti kyčle, 20 % zlomenin v distálním předloktí, 25 % v oblasti humeru a 42 % klinických zlomenin obratlů vzniká u mužů. Většinou se jedná o nízkotraumatické fraktury. Je třeba zdůraznit, že 61 % neobratlových zlomenin a 58 % zlomenin proximálního femuru vzniká u mužů s osteopenií, zatímco u většiny žen s těmito zlomeninami je prokazována osteoporóza [1]. U mužů je proto zhoršená kvalita kostní hmoty zvažována a léčena (dokonce i po zlomenině) mnohem méně často než u žen [2]. Přestože v České republice jsou registrovány účinné léky pro léčbu osteoporózy u mužů, chybějí stále konkrétní doporučení (koho, kdy a jak léčit).
příčinách zvýšeného rizika zlomenin v oblasti kyčle u starších mužů, kteří v mládí prodělali traumatickou zlomeninu tibie nebo jiných dlouhých kostí. Po šedesátém roce života se incidence zlomenin exponenciálně zvyšuje s věkem u obou pohlaví a vypovídá o zhoršující se kvalitě kostní hmoty (graf 1). Třetina zlomenin v oblasti kyčle, 20 % zlomenin v distálním předloktí, 25 % v oblasti humeru a 42 % klinických zlomenin obratlů vzniká u mužů. Většinou se jedná o nízkotraumatické fraktury. Je třeba zdůraznit, že 61 % neobratlových zlomenin a 58 % zlomenin proximálního femuru vzniká u mužů s osteopenií, zatímco u většiny žen s těmito zlomeninami je prokazována osteoporóza [1]. U mužů je proto zhoršená kvalita kostní hmoty zvažována a léčena (dokonce i po zlomenině) mnohem méně často než u žen [2]. Přestože v České republice jsou registrovány účinné léky pro léčbu osteoporózy u mužů, chybějí stále konkrétní doporučení (koho, kdy a jak léčit).
Rozsah problému
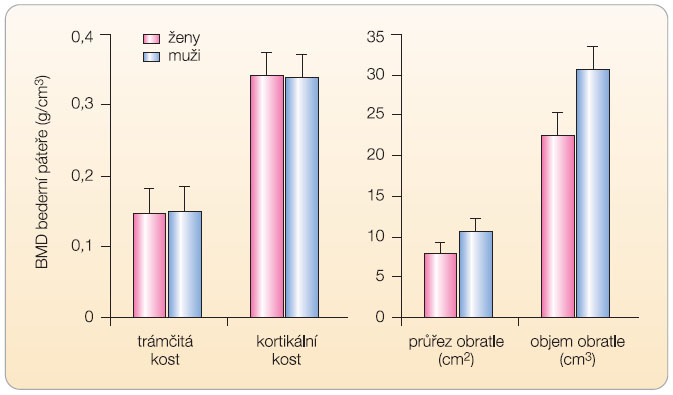 V České republice postihuje OP zhruba 200 000 mužů starších 50 let [3]. Prevalence OP i incidence osteoporotických zlomenin se u mužů zvyšuje s věkem. Nižší prevalenci zlomenin u mužů než u žen vysvětluje kratší střední délka života, chybění zrychleného úbytku kostní hmoty, obvyklého u žen po menopauze, a zřejmě také odlišná geometrie (větší objem) kostí u mužů (graf 2). V České republice bylo v posledních 5 letech každoročně registrováno kolem 3500 zlomenin v oblasti kyčle u mužů ve věku nad 50 let a kolem 2500 těchto zlomenin u mužů ve věku nad 70 let (data ÚZIS, 2009).
V České republice postihuje OP zhruba 200 000 mužů starších 50 let [3]. Prevalence OP i incidence osteoporotických zlomenin se u mužů zvyšuje s věkem. Nižší prevalenci zlomenin u mužů než u žen vysvětluje kratší střední délka života, chybění zrychleného úbytku kostní hmoty, obvyklého u žen po menopauze, a zřejmě také odlišná geometrie (větší objem) kostí u mužů (graf 2). V České republice bylo v posledních 5 letech každoročně registrováno kolem 3500 zlomenin v oblasti kyčle u mužů ve věku nad 50 let a kolem 2500 těchto zlomenin u mužů ve věku nad 70 let (data ÚZIS, 2009).
Osteoporotické zlomeniny proximálního femuru i obratlů jsou asociovány se zvýšeným rizikem úmrtí v dalších 5–10 letech. Riziko úmrtí u mužů stoupá s počtem a závažností dříve prodělaných zlomenin. Ve všech věkových kategoriích je mortalita u mužů vyšší než u žen [4]. Příčina tohoto jevu však není vysvětlena.
U mužů, podobně jako u žen, má pro včasnou prognózu dalších zlomenin význam prodělaná zlomenina. Incidence zlomenin obratlů u mužů je v celé Evropě obdobná (4–7 zlomenin u 1000 mužů). Zlomenina obratle významně zhoršuje kvalitu života a riziko dalších obratlových i neobratlových zlomenin. Po zlomenině obratle však vyhledává lékařskou pomoc jen 20–40 % postižených osob. Dvě třetiny zlomenin obratlů proběhnou bez výraznějších klinických příznaků, ale jsou prokazatelné radiograficky. Také tyto zlomeniny jsou spojeny s vyšší morbiditou a mortalitou.
Příčiny a rizikové faktory
 Jakkoli jsou příčiny úbytku a zhoršování kvality kostní hmoty u mužů individuálně značně rozdílné, lze je rozdělit na primární (idiopatická a involuční osteoporóza) a sekundární (důsledek jiných onemocnění a vlivu léků). Genetické aspekty, idiopatická a involuční OP a různé příčiny sekundární OP (tab. 1) jsou mimo rámec tohoto sdělení a byla jim už v tomto časopise věnována pozornost [8].
Jakkoli jsou příčiny úbytku a zhoršování kvality kostní hmoty u mužů individuálně značně rozdílné, lze je rozdělit na primární (idiopatická a involuční osteoporóza) a sekundární (důsledek jiných onemocnění a vlivu léků). Genetické aspekty, idiopatická a involuční OP a různé příčiny sekundární OP (tab. 1) jsou mimo rámec tohoto sdělení a byla jim už v tomto časopise věnována pozornost [8].
Diagnostika a diferenciální diagnostika úbytku kostní hmoty a zlomenin
Vyhledáni a včas léčeni by měli být muži s významným rizikem OP zlomeniny. Protože nikdy nebyl zjištěn práh BMD, po jehož překročení by byla zlomenina nevyhnutelná, a většina zlomenin vzniká u mužů, kteří jsou postiženi jen osteopenií [1], je již v řadě zemí kritériem pro zahájení medikamentózní léčby prahová hodnota absolutního rizika zlomeniny založená na hodnocení klinických rizikových faktorů podle FRAX [10].
Někdy se diagnostika OP nesprávně omezuje na hodnocení stupně úbytku BMD pomocí dvouenergiové rentgenové absorpciometrie (DXA) v bederní páteři a v proximálním femuru, která nevypovídá o kvalitě kostní hmoty a nebere v úvahu objem kosti. Vyšetření je doporučeno u všech mužů ve věku 70 let a starších a zejména u mužů po nízkotraumatické zlomenině (vč. morfometrické deformity obratle), při onemocněních nebo léčbě navozujících úbytek kostní hmoty a před zahájením léčby glukokortikoidy a antiandrogeny. U posléze uvedené skupiny pacientů je doporučeno kontrolní měření BMD po 6 měsících léčby. V ostatních klinických situacích je opakování osteodenzitometrického vyšetření doporučeno po 1–2 letech.
Protože podle některých epidemiologických studií je závislost rizika zlomenin na BMD rozdílná u mužů a u žen [5], používá většina osteodenzitometrů k výpočtu T-skóre (směrodatná odchylka měření BMD u zdravých mladých dospělých osob) zvlášť databázi pro muže a pro ženy. Referenčním standardem, podle kterého se vypočítává T-skóre a jenž je použit při výpočtu FRAX u mužů, je však databáze pro bělošky ve věku 20–29 let NHANES III. Užívají to i jiné studie [6]. U mužů mladších 50 let se místo T-skóre užívá Z-skóre (směrodatná odchylka měření BMD u zdravých osob stejného věku) a hodnoty nižší než -2 se u nich hodnotí jako nižší než očekávané pro daný věk. Hodnot absolutního rizika zlomeniny podle FRAX lze zatím v České republice užít jen pro informování pacienta o stupni rizika zlomeniny.
Klinická diagnóza má vycházet z anamnézy a klinického vyšetření doplněného hodnocením výsledku DXA, morfologie obratlů (rtg nebo LVA – lateral vertebral assessment) a laboratorního vyšetření. K nutným základním laboratorním vyšetřením patří krevní obraz, FW, CRP, fS-Ca, PO4, ALP, GMT, kreatinin, TSH, testosteron, 25-hydroxyvitamin D, CTX1 a PINP. Nízká BMD nebo zlomenina nejsou vždy projevem OP a u mužů je třeba odlišit primární OP a různé typy sekundární OP. Nemocní s koncentracemi sérového kalcia a fosfátů mimo normální hodnoty, s celkovou aktivitou sérové ALP vyšší než 1,2násobek horní hranice normy, koncentrací osteokalcinu pod dolní hranicí normy, s hodnotami TSH mimo normální hodnoty a nemocní s nálezem paraproteinu nemají být bez dalšího vyšetření a případně konzultace se specialistou léčeni pro OP. Pokud je prokázána OP a její příčina a je objektivně dokumentován stupeň rizika zlomeniny, je užitečným vodítkem při rozhodování o léčbě také posouzení rychlosti úbytku kostní hmoty a stupně osteoklastické osteoresorpce a novotvorby kosti. To lze dokumentovat opakovaným měřením BMD ve vhodném intervalu anebo jednorázovým průkazem koncentrace markeru osteoresorpce (např. CTX1 v séru nebo v moči, marker degradace kolagenu typu I) převyšující horní hranici referenčních hodnot pro mladé dospělé osoby stejného pohlaví [7]. Při involuční osteoporóze nebo při osteoporóze navozené glukokortikoidy může upozornit na nadměrně utlumenou novotvorbu kosti zjištění sérové koncentrace PINP (markeru syntézy kolagenu typu I) nebo osteokalcinu pod dolní mezí referenčních hodnot. Při normální nebo snížené koncentraci markerů remodelace kosti se s věkem riziko zlomenin také zvyšuje, i když pomaleji než při nadměrně zvýšené osteoresorpci.
Nefarmakologická opatření ke snížení rizika zlomenin, úprava modifikovatelných faktorů rizika zlomenin
Prevence OP u mužů se řídí obecnými principy zajištění optimálního vývoje skeletu během dospívání a udržení maxima kostní hmoty v dospělosti a vyšším věku. Primární prevence OP spočívá v zajištění přiměřené fyzické aktivity, přiměřeného přívodu vápníku a bílkovin v potravě, přiměřeného zásobení vitaminem D a C, ve vyloučení toxických vlivů prostředí (kouření, nadměrná konzumace alkoholu, těžké kovy, nadměrný příjem fosfátů apod.). Pokud je u dospělých mužů s osteopenií potvrzena dostatečná produkce sexagenů a nejsou přítomny další příčiny sekundární OP, nedošlo k fraktuře a není zrychlena kostní remodelace, postačuje přiměřený přívod živin, vápníku potravou a vitaminu D potravou a insolací. Pokud není dostatečné zásobení vápníkem a vitaminem D dosažitelné z přirozených zdrojů, je vhodné individuálně zvážit nutnost medikamentózní suplementace vápníkem a vitaminem D.
Tělesná hmotnost se má udržovat přiměřeně výšce postavy, protože neúměrně nízká hmotnost je rizikovým faktorem OP. Strava má být vyvážená a má obsahovat dostatek bílkovin. Vyvážená strava je zásadně doporučena také pro zajištění doporučeného příjmu vápníku. Pokud pacient pravidelně nepije mléko nebo nemá v potravě mléčné výrobky, přijímá denně v potravě kolem 0,5 g vápníku. Pro udržení rovnováhy mezi příjmem a výdejem vápníku a tím také stavu kostí je ale v dospělosti třeba dvojnásobku uvedeného množství. Dalšího půl gramu vápníku lze s výhodou doplnit mléčnými výrobky (denně půl litru nízkotučného mléka, 65 gramů tvrdého tvarohu nebo eidamského sýra nebo čtvrt litru bílého jogurtu). Zvažovat se má také biologická dostupnost vápníku, protože zatímco u dětí je účinnost absorpce vápníku kolem 75 %, v dospělosti je jen 30–50 % a ve stáří ještě klesá. Absorpční schopnost střeva pro vápník klesá při deficitu sexagenů a vitaminu D a při hyperkortisolismu, v přítomnosti kyseliny fytové a šťavelové, nadměrného množství vlákniny, solí hořčíku, draslíku a sodíku. U osob se sníženou produkcí žaludeční šťávy je absorbovatelnost vápníku nalačno velmi špatná, ale při podání s potravou bývá normální. Doporučený denní přívod vápníku, celkově 1 g denně, má být zajištěn u zdravých mužů a také při medikamentózní léčbě OP. Pokud se podá až 500 mg vápníku, absorbuje se rychle aktivním transportem, při podání většího množství vápníku se absorbuje pasivním transportem podle koncentračního gradientu, a proto pomaleji. Proto je vhodné vápník podávat při jídle a v dávkách nejvýše 500 mg. Podání vápníku večer před ulehnutím snižuje noční vrchol koncentrace parathormonu v krvi. Doporučený denní přívod 800 IU vitaminu D je vhodné zajistit celoročně při OP i při osteopenii. Aktivní metabolity vitaminu D (1α-hydroxyvitamin D a kalcitriol) jsou vhodné pouze pro léčbu OP u pacientů se zhoršenými funkcemi ledvin.* Vitamin D se uplatňuje také úpravou myopatie navozené hypovitaminózou D a následně snížením rizika pádů, a tím i zlomenin (zejména u starých osob v ústavní péči).
Pro nemocné s OP je vhodné doporučit cvičení, která zatěžují skelet a stimulují osteoblasty k novotvorbě kostní hmoty. Zejména je doporučováno pravidelné zatěžování skeletu rychlou chůzí, 2–4 hodiny denně. Fyzicky aktivní muži mají významně nižší riziko zlomenin v oblasti kyčle než muži s nízkou fyzickou aktivitou [9].
Terapie
Cílem léčby OP je zlepšit anebo alespoň udržet množství a kvalitu kostní hmoty a zabránit tak zlomeninám a zachovat nebo zlepšit kvalitu života.
Léčba involuční osteoporózy
Antiresorpční léčba
Cílem zpomalení remodelace kosti pomocí antiresorpčních léků je zabránit dalšímu zhoršování mikroarchitektury kosti, úbytku kostní hmoty a umožnit delší sekundární mineralizaci kosti. Vytváření nové kostní hmoty však tyto léky nenavozují. V České republice jsou pro léčbu OP u mužů registrovány kalcitonin a dusíkaté bisfosfonáty (alendronát, risedronát, kyselina zoledronová). Denosumab je registrován k léčbě sekundární OP navozené androgen deprivační terapií. Ibandronát a stroncium ranelát nejsou v České republice pro léčbu OP u mužů registrovány. Mechanismus útlumu osteoresorpce uvedenými léky je rozdílný. Kalcitonin na několik hodin účinně tlumí aktivitu osteoklastů, ale jakmile koncentrace léku v krvi klesá, osteoklastická osteoresorpce pokračuje. Dusíkaté bisfosfonáty inhibicí farnesyldifosfát syntázy tlumí účinnost osteoklastů a navozují jejich apoptózu. Jednotlivé dusíkaté bisfosfonáty se liší nejenom stupněm vazby na kostní minerál, ale také stupněm biologického účinku a způsobem podávání. Denosumab ovlivněním signální dráhy ligandu pro RANK brání diferenciaci a tlumí funkci a přežívání osteoklastů.
Účinnost a bezpečnost registrovaných léků byla ověřena v klinických studiích 3. fáze u nemocných splňujících kritéria pro zařazení do studie a tím potvrzenou OP. Kritéria pro zařazení pacientů do jednotlivých studií však nebyla jednotná a nešlo o přímé porovnání léků u téže populace pacientů se zcela obdobným absolutním rizikem zlomeniny na začátku studie. V klinické praxi tato kritéria většina nemocných nesplňuje. Před zahájením léčby u jednotlivých pacientů je proto třeba vyloučit jiná metabolická a nádorová kostní onemocnění a během léčby očekávanou účinnost léku individuálně ověřovat.
Kalcitonin byl k léčbě OP u mužů klinicky testován ve třech malých studiích, které prokázaly zvýšení BMD páteře a některé i proximálního femuru [11–13]. Snížení rizika zlomenin však nebylo ověřováno.
Dusíkaté bisfosfonáty:
Alendronát (10 mg denně) v prospektivní studii u 241 mužů o průměrném věku 63 let (31–87 let, u třetiny pacientů byla zjištěna nízká koncentrace testosteronu v krvi) a s BMD v páteři nebo v kyčli ≤ -2,0 SD zvyšoval po 2 letech BMD 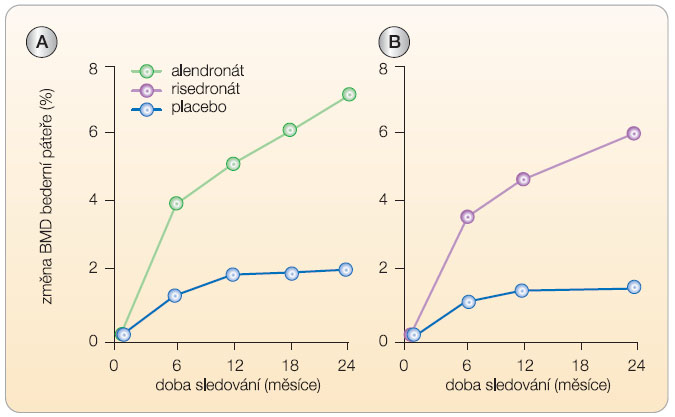 bederní páteře a krčku femuru a snížil průkazně riziko zlomenin obratlů (RR 0,9; 95% CI: 0–0,88; p = 0,01), graf 3 [14].
bederní páteře a krčku femuru a snížil průkazně riziko zlomenin obratlů (RR 0,9; 95% CI: 0–0,88; p = 0,01), graf 3 [14].
Risedronát (35 mg jednou za týden) byl testován v prospektivní studii u 284 mužů (randomizovaných v poměru 2 : 1 do skupiny léčené a kontrolní) o průměrném věku 62 let (36–84 let) a s BMD v páteři ≤ -2,5 SD a v krčku femuru ≤ -1 SD (nebo s BMD v páteři ≤ -1 SD a v krčku femuru ≤ -2 SD). Po 2 letech léčby se významně zvýšila BMD bederní páteře a krčku femuru. Léčba byla účinná i u pacientů s nízkou sérovou koncentrací testosteronu (graf 3). Studie dokumentovala trend ke snížení rizika zlomenin [15]. Další kontrolované studie prokázaly při 18měsíční léčbě risedronátem zvýšení BMD a snížení rizika zlomenin v oblasti kyčle u mužů po iktu a starších 65 let [16] a zvýšení BMD a snížení rizika zlomenin obratlů u mužů s Alzheimerovou chorobou [17].
Kyselina zoledronová byla klinicky testována v randomizované multicentrické a dvojitě zaslepené studii u 302 mužů s OP. Infuzi s 5 mg kyseliny zoledronové dostávalo jednou ročně 154 mužů a 148 mužů bylo léčeno alendronátem (tableta, 70 mg jednou za týden). U obou skupin se po dvou letech zvýšila BMD v bederní páteři o 6 %. Další studie účinku kyseliny zoledronové na riziko zlomenin u mužů a žen (průměrný věk 75 let) po zlomenině v oblasti kyčle prokázala po roce léčby snížení rizika neobratlových zlomenin [18]. Hojení zlomenin nebylo léčbou nepříznivě ovlivněno. Podmínkou podání kyseliny zoledronové je dostatečná hydratace pacienta. Reakce akutní fáze (horečka, artralgie, myalgie) do 3 dnů po infuzi uvádí 45 % pacientů; příznaky lze zmírnit opakovaným podáváním paracetamolu; většinou odeznívají do 3 dnů. Při opakovaných infuzích procento pacientů s tímto nežádoucím účinkem výrazně klesá. Útlum kostní remodelace po infuzi kyseliny zoledronové se mírně upravuje během dalšího ročního intervalu, kdy osteoblasty nejsou vystaveny opakované inhibici, jako je tomu při léčbě jinými dusíkatými bisfosfonáty.
Léčba perorálními dusíkatými bisfosfonáty není vhodná u pacientů neschopných zůstat ve vzpřímené poloze po dobu 30 minut, při krvácení do GIT v posledním roce, u pacientů s rekurentní nebo aktivní vředovou chorobou gastroduodenální, gastroezofageálním refluxem nebo pokud je prokázána striktura, achalasie nebo porucha motility jícnu. Tato léčba není vhodná při kontraindikaci podávání vápníku nebo vitaminu D, při koncentraci vápníku v séru nižší než 2,1 mmol/l a přesahující 2,65 mmol/l, při deficienci vitaminu D (S-25(OH)D < 25 nmol/l), při leukopenii (< 2 500/ml), při zvýšení ALT nad dvojnásobek normy, snížení S-albuminu < 30 g/l, při clearance kreatininu < 0,6 ml/s. Osteonekróza čelisti jako komplikace léčby dusíkatými bisfosfonáty se uvádí při léčbě nádorových onemocnění, ale při léčbě OP je mimořádně vzácná. Léčba by měla trvat po dobu 4–5 let, po kterou klinické studie doložily její bezpečnost pro kvalitu kosti. U některých pacientů může déletrvající nadměrný útlum kostní remodelace, zejména při léčbě alendronátem, navodit atypickou zlomeninu.
Denosumab je plně lidská monoklonální protilátka proti RANK ligandu. Ve dvojitě zaslepené kontrolované studii u 1468 mužů s androgen deprivační terapií pro karcinom prostaty se po 2 letech podávání denosumabu (s.c. 60 mg vždy po 6 měsících) BMD významně zvýšila v bederní páteři, v krčku femuru, v celkovém proximálním femuru a v radiu. Po 3 letech byla incidence nových zlomenin obratlů u léčených mužů o 62 % nižší než v placebové skupině (1,5 % vs. 3,9 %; p < 0,006) [19].
Osteoanabolická léčba
![Graf 4 Změny denzity kostního minerálu (BMD) (A) v bederní páteři, (B) v proximálním femuru a změny sérové koncentrace markerů degradace a syntézy kolagenu typu I (C) S-PINP a (D) S-CTX) během 3 let léčení glukokortikoidy indukované osteoporózy alendronátem nebo teriparatidem; podle [31] – Saag, et al., 2009.](https://www.remedia.cz/photo-a-28296---.jpg) Pro léčbu OP u mužů a glukokortikoidy indukované OP u mužů je v České republice registrován rekombinantní fragment PTH 1-34 (teriparatid). Lék má plně zachovanou biologickou účinnost nativního PTH na kostní i kalciofosfátový metabolismus. Kvalita novotvořené kostní hmoty je zcela normální. Lék se aplikuje s.c. jednou denně pomocí injekčního pera. Zajištění dostatečného denního přívodu vápníku (1–1,5 g denně) a vitaminu D (800 IU denně) je nutným předpokladem pro plnou účinnost léčby. Doporučená doba podávání je 24 měsíců. Ve velké prospektivní studii u 437 mužů s idiopatickou OP navodil teriparatid (20 µg s.c. jednou za den) po 11 měsících sledování zvýšení BMD bederní páteře o 5,9 % a v krčku femuru o 1,5 % (p < 0,001) [20]. Stupeň zvýšení BMD při léčbě teriparatidem byl u mužů obdobný jako při léčbě teriparatidem u žen (graf 4). Sledování pacientů z prospektivní studie po dalších 30 měsíců prokázalo pokles BMD po ukončení léčby teriparatidem [21]. Pokud pacienti dostávali po ukončení anabolické léčby antiresorpční léky, BMD se udržela a riziko středních a těžkých deformit obratlů se snížilo o 83 % (p < 0,01).
Pro léčbu OP u mužů a glukokortikoidy indukované OP u mužů je v České republice registrován rekombinantní fragment PTH 1-34 (teriparatid). Lék má plně zachovanou biologickou účinnost nativního PTH na kostní i kalciofosfátový metabolismus. Kvalita novotvořené kostní hmoty je zcela normální. Lék se aplikuje s.c. jednou denně pomocí injekčního pera. Zajištění dostatečného denního přívodu vápníku (1–1,5 g denně) a vitaminu D (800 IU denně) je nutným předpokladem pro plnou účinnost léčby. Doporučená doba podávání je 24 měsíců. Ve velké prospektivní studii u 437 mužů s idiopatickou OP navodil teriparatid (20 µg s.c. jednou za den) po 11 měsících sledování zvýšení BMD bederní páteře o 5,9 % a v krčku femuru o 1,5 % (p < 0,001) [20]. Stupeň zvýšení BMD při léčbě teriparatidem byl u mužů obdobný jako při léčbě teriparatidem u žen (graf 4). Sledování pacientů z prospektivní studie po dalších 30 měsíců prokázalo pokles BMD po ukončení léčby teriparatidem [21]. Pokud pacienti dostávali po ukončení anabolické léčby antiresorpční léky, BMD se udržela a riziko středních a těžkých deformit obratlů se snížilo o 83 % (p < 0,01).
Léčba sekundární osteoporózy
 Léčba OP má být kauzální. Protože polovina až dvě třetiny onemocnění OP u mužů má prokazatelné sekundární příčiny úbytku kostní hmoty, je předpokladem zahájení jakékoli léčby klinické a laboratorní vyšetření a zjištění příčiny OP. Pokud je u mužů s nízkou kostní hmotou vyloučeno jiné metabolické nebo nádorové onemocnění skeletu, ale je prokázána některá z příčin sekundární OP (hypogonadismus, hyperkortisolismus, hypertyreóza, hyperparatyreóza, gastrointestinální onemocnění, onemocnění pojiva nebo zánětlivá onemocnění), je nutné včas diagnostikovat a léčit základní příčinu úbytku kostní hmoty (tab. 1). Na tomto místě lze zmínit jen studie věnované léčbě OP navozené deficiencí testosteronu a léčbě OP indukované glukokortikoidy.
Léčba OP má být kauzální. Protože polovina až dvě třetiny onemocnění OP u mužů má prokazatelné sekundární příčiny úbytku kostní hmoty, je předpokladem zahájení jakékoli léčby klinické a laboratorní vyšetření a zjištění příčiny OP. Pokud je u mužů s nízkou kostní hmotou vyloučeno jiné metabolické nebo nádorové onemocnění skeletu, ale je prokázána některá z příčin sekundární OP (hypogonadismus, hyperkortisolismus, hypertyreóza, hyperparatyreóza, gastrointestinální onemocnění, onemocnění pojiva nebo zánětlivá onemocnění), je nutné včas diagnostikovat a léčit základní příčinu úbytku kostní hmoty (tab. 1). Na tomto místě lze zmínit jen studie věnované léčbě OP navozené deficiencí testosteronu a léčbě OP indukované glukokortikoidy.
Léčba při deficienci sexagenů
Až 30 % onemocnění OP u mužů je zapříčiněno deficiencí testosteronu [22]. Antiresorpční i osteoanabolická léčba je u mužů účinná bez ohledu na sérové koncentrace testosteronu, a není tedy důvod k současné hormonální substituci při těchto způsobech léčby [14, 20]. Účinky testosteronu a selektivních modulátorů estrogenních receptorů nebyly až na výjimky ověřeny kontrolovanými randomizovanými studiemi [23, 24]. Zatím nejsou k dispozici data pro doporučení dlouhodobé léčby OP a prevenci zlomenin u mužů testosteronem. Stanovení koncentrace sexagenů v krvi není doporučeno pro populační screening mužů ohrožených zlomeninami, ale je spolu s SHBG (sex hormone binding globulin) nezbytnou součástí laboratorního vyšetření u mužů s prokázanou OP. Substituční léčba testosteronem má jen malý vliv na novotvorbu kosti a výrazně netlumí osteoresorpci, nicméně zpomaluje rychlost úbytku kostní hmoty.
Protože starší muži mají sérovou koncentraci estradiolu významně vyšší než ženy po menopauze, nejsou selektivní modulátory estrogenních receptorů (SERM) studovány ani doporučovány jako terapie involuční OP u mužů. Účinnost těchto léků však byla opakovaně ověřena při léčbě OP u mužů s velmi nízkou sérovou koncentrací estrogenů [25]. Jako perspektivní se uvádí léčba raloxifenem (SERM) nebo toremifenem (antiestrogen) u mužů s antiandrogenní terapií při karcinomu prostaty, kdy navozuje zvýšení BMD a snižuje riziko zlomenin obratlů [26]. Pro účinnost selektivních inhibitorů androgenních receptorů na skelet zatím svědčí jen experimentální studie.
Léčba osteoporózy indukované glukokortikoidy (GlO)
Antiresorpční léčba GIO byla u mužů testována při podávání tří různých dusíkatých bisfosfonátů. Ve studiích s alendronátem a risedronátem se statisticky významně zvyšovala v porovnání s kontrolní skupinou BMD v bederní páteři i v proximálním femuru [27–29]. Ve skupině léčené alendronátem i risedronátem mělo zlomeniny obratlů statisticky významně méně pacientů než v kontrolní skupině [27, 29]. Účinnost kyseliny zoledronové (5 mg v infuzi jednou ročně) v provnání s léčbou risedronátem (tableta, 5 mg denně) byla v uvedené indikaci ověřena v randomizované, dvojitě zaslepené studii u 833 mužů a žen léčených ≥ 7,5 mg prednisonu buď do 3 měsíců (preventivní studie, 88 mužů, 200 žen), nebo déle než 3 měsíce (léčebná studie, 177 mužů a 368 žen). V posléze uvedené studii se po 12 měsících zvýšila BMD bederní páteře při léčbě kyselinou zoledronovou (4,1 %) více než při podávání risedronátu (2,7 %). Pokud byla léčba bisfosfonáty zahájena v prvních 3 měsících terapie glukokortikoidy, kyselina zoledronová navodila po roce zvýšení BMD o 2,6 %, risedronát o 0,64 %. Rozdíl změn BMD byl statisticky významný u mužů i u žen v preventivní i léčebné studii [30]. Při obou způsobech terapie klesaly koncentrace biochemických markerů degradace i syntézy kolagenu typu I již v prvních 10 dnech. Během dalšího sledování zůstávaly koncentrace obou markerů při léčbě risedronátem v rozmezí referenčních hodnot, které byly publikovány u zdravých žen před menopauzou. Při léčbě kyselinou zoledronovou se koncentrace markerů vrátily do tohoto rozmezí po 6–12 měsících. Také při léčbě GIO alendronátem klesaly uvedené markery obdobně jako po podání kyseliny zoledronové, ale výrazný útlum kostní remodelace signalizovaný markery přetrvával po celou dobu léčby [31]. Pro léčení GIO je v České republice hrazeno podání kyseliny zoledronové jednou za rok (5 mg v nejméně 15minutové infuzi) u nemocných, kteří mají hodnotu BMD nižší než -1,5 T-skóre. Alendronát nebo risedronát lze podávat, pokud je OP prokázána osteodenzitometricky (BMD ≤ -2,5 SD).
Osteoanabolická léčba GIO je v České republice zajišťována pouze teriparatidem (rekombinantní fragment 1-34 lidského PTH). Je to kauzální léčba onemocnění, které je způsobeno nadměrným útlumem kostní remodelace glukokortikoidy. Léčbu schvaluje Indikační komise pro muže a ženy léčené glukokortikoidy v denní dávce odpovídající 5 mg nebo více prednisonu po dobu nejméně 6 měsíců, pokud mají T-skóre v oblasti bederní páteře ≤ -2,5 SD. Jde o léčbu první volby.
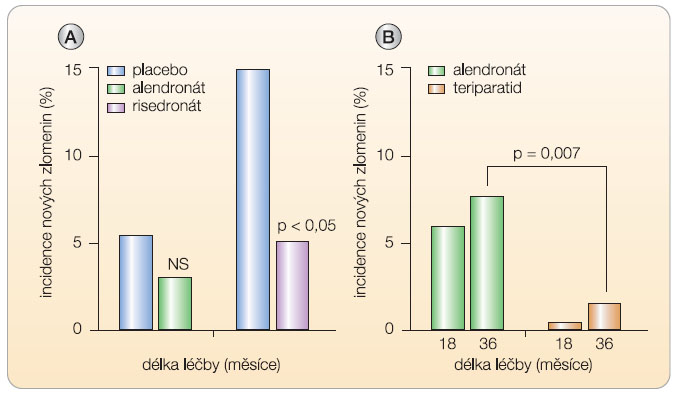 Z přímého porovnání změn markerů při podávání alendronátu nebo teriparatidu je zřejmý významný rozdíl mezi oběma typy léků (graf 5) nejenom co do změny BMD, ale také z hlediska mechanismu účinků. Zatímco alendronát remodelaci kosti tlumí a marker syntézy kostního kolagenu klesá o více než 50 %, při léčbě teriparatidem se již během jednoho měsíce významně zvyšuje novotvorba kosti a vzhledem k mnohem mírnějšímu vzestupu osteoresorpce se otvírá anabolické okno. Účinky antiresorpční a osteoanabolické léčby na riziko zlomenin byly zatím porovnány v jediné randomizované studii s alendronátem a teriparatidem [31]. Po 18 měsících a dále pak po 36 měsících bylo při léčbě teriparatidem v porovnání se skupinou pacientů léčených alendronátem absolutní riziko zlomenin obratlů několikanásobně nižší (graf 5).
Z přímého porovnání změn markerů při podávání alendronátu nebo teriparatidu je zřejmý významný rozdíl mezi oběma typy léků (graf 5) nejenom co do změny BMD, ale také z hlediska mechanismu účinků. Zatímco alendronát remodelaci kosti tlumí a marker syntézy kostního kolagenu klesá o více než 50 %, při léčbě teriparatidem se již během jednoho měsíce významně zvyšuje novotvorba kosti a vzhledem k mnohem mírnějšímu vzestupu osteoresorpce se otvírá anabolické okno. Účinky antiresorpční a osteoanabolické léčby na riziko zlomenin byly zatím porovnány v jediné randomizované studii s alendronátem a teriparatidem [31]. Po 18 měsících a dále pak po 36 měsících bylo při léčbě teriparatidem v porovnání se skupinou pacientů léčených alendronátem absolutní riziko zlomenin obratlů několikanásobně nižší (graf 5).
Závěr
Přestože jedna třetina všech zlomenin proximálního femuru postihuje muže a přestože v České republice jsou registrovány léky osteoporózy u mužů, chybějí zatím doporučené postupy léčby idiopatické, involuční i glukokortikoidy indukované OP u mužů. Jde o nedostatečně diagnostikované a nedostatečně léčené onemocnění, v jehož epidemiologii a patofyziologii zůstává zatím mnoho nerozřešených otázek. Osteodenzitometricky se OP zjistí jen u 21 % mužů s neobratlovými zlomeninami a jen u 39 % mužů, kteří utrpí zlomeninu v oblasti kyčle. Měření BDM je proto jen vhodným doplňkem hodnocení rizika zlomenin podle klinických faktorů. V prevenci zlomenin mužů má zásadní význam nejenom farmakoterapie OP, ale významná jsou také opatření vedoucí ke zlepšení svalové síly a koordinace a opatření ke snížení rizika pádů.
Seznam použité literatury
- [1] Schuit SC, van der Klift M, Weel AE, et al. Fracture incidence and association with bone mineral density in elderly men and women: the Rotterdam Study. Bone 2004; 34: 195–202.
- [2] Curtis JR, Adachi JD, Saag KG. Bridging the osteoporosis quality chasm. J Bone Miner Res 2009; 24: 3–7.
- [3] Štěpán J, Záhora R, Poláková L, et al. Prevalence osteoporozy v Ceske republice. [Prevalence of osteoporosis in the Czech Republic]. Cas Lek Cesk 1998; 137: 237–239.
- [4] Bliuc D, Nguyen ND, Milch VE, et al. Mortality risk associated with low-trauma osteoporotic fracture and subsequent fracture in men and women. JAMA 2009; 301: 513–521.
- [5] Cummings SR, Cawthon PM, Ensrud KE, et al. BMD and risk of hip and nonvertebral fractures in older men: a prospective study and comparison with older women. J Bone Miner Res 2006; 21: 1550–1556.
- [6] Johnell O, Kanis JA, Oden A, et al. Predictive value of BMD for hip and other fractures. J Bone Miner Res 2005; 20: 1185–1194.
- [7] Delmas PD, Eastell R, Garnero P, et al. The use of biochemical markers of bone turnover in osteoporosis. Committee of Scientific Advisors of the International Osteoporosis Foundation. Osteoporos Int 2000; 11 (Suppl 6): S2–17.
- [8] Řehořková P. Osteoporóza u mužů. Remedia 2006; 16: 339–345.
- [9] Forsen L, Bjorndal A, Bjartveit K, et al. Interaction between current smoking, leanness, and physical inactivity in the prediction of hip fracture. J Bone Miner Res 1994; 9: 1671–1678.
- [10] Kanis JA, Borgstrom F, De Laet C, et al. Assessment of fracture risk. Osteoporos Int 2005; 16: 581–589.
- [11] Erlacher L, Kettenbach J, Kiener H, et al. Salmon calcitonin and calcium in the treatment of male osteoporosis: the effect on bone mineral density. Wien Klin Wochenschr 1997; 109: 270–274.
- [12] Trovas GP, Lyritis GP, Galanos A, et al. A randomized trial of nasal spray salmon calcitonin in men with idiopathic osteoporosis: effects on bone mineral density and bone markers. J Bone Miner Res 2002; 17: 521–527.
- [13] Toth E, Csupor E, Meszaros S, et al. The effect of intranasal salmon calcitonin therapy on bone mineral density in idiopathic male osteoporosis without vertebral fractures – an open label study. Bone 2005; 36: 47–51.
- [14] Orwoll E, Ettinger M, Weiss S, et al. Alendronate for the treatment of osteoporosis in men. N Engl J Med 2000; 343: 604–610.
- [15] Boonen S, Orwoll ES, Wenderoth D, et al. Once-weekly risedronate in men with osteoporosis: results of a 2-year, placebo-controlled, double-blind, multicenter study. J Bone Miner Res 2009; 24: 719–725.
- [16] Sato Y, Iwamoto J, Kanoko T, Satoh K. Risedronate sodium therapy for prevention of hip fracture in men 65 years or older after stroke. Arch Intern Med 2005; 165: 1743–1748.
- [17] Sato Y, Kanoko T, Satoh K, Iwamoto J. The prevention of hip fracture with risedronate and ergocalciferol plus calcium supplementation in elderly women with Alzheimer disease: a randomized controlled trial. Arch Intern Med 2005; 165:1737–1742.
- [18] Lyles KW, Colon-Emeric CS, Magaziner JS, et al. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med 2007; 357: 1799–1809.
- [19] Smith MR, Egerdie B, Hernandez Toriz N, et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med 2009; 361: 745–755.
- [20] Orwoll ES, Scheele WH, Paul S, et al. The effect of teriparatide [human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis. J Bone Miner Res 2003; 18: 9–17.
- [21] Kaufman JM, Orwoll E, Goemaere S, et al. Teriparatide effects on vertebral fractures and bone mineral density in men with osteoporosis: treatment and discontinuation of therapy. Osteoporos Int 2005; 16: 510–516.
- [22] Snyder PJ, Peachey H, Berlin JA, et al. Effects of testosterone replacement in hypogonadal men. J Clin Endocrinol Metab 2000; 85: 2670–2677.
- [23] Amory JK, Watts NB, Easley KA, et al. Exogenous testosterone or testosterone with finasteride increases bone mineral density in older men with low serum testosterone. J Clin Endocrinol Metab 2004; 89: 503–510.
- [24] Nair KS, Rizza RA, O'Brien P, et al. DHEA in elderly women and DHEA or testosterone in elderly men. N Engl J Med 2006; 355: 1647–1659.
- [25] Uebelhart B, Herrmann F, Pavo I, et al. Raloxifene treatment is associated with increased serum estradiol and decreased bone remodeling in healthy middle-aged men with low sex hormone levels. J Bone Miner Res 2004; 19: 1518–1524.
- [26] Smith MR, Morton RA, Barnette KG, et al. Toremifene to reduce fracture risk in men receiving androgen deprivation therapy for prostate cancer. J Urol 2010; 184: 1316–1321.
- [27] Adachi JD, Saag KG, Delmas PD, et al. Two-year effects of alendronate on bone mineral density and vertebral fracture in patients receiving glucocorticoids: a randomized, double-blind, placebo-controlled extension trial. Arthritis Rheum 2001; 44: 202–211.
- [28] Wallach S, Cohen S, Reid DM, et al. Effects of risedronate treatment on bone density and vertebral fracture in patients on corticosteroid therapy. Calcif Tissue Int 2000; 67: 277–285.
- [29] Reid DM, Adami S, Devogelaer JP, Chines AA. Risedronate increases bone density and reduces vertebral fracture risk within one year in men on corticosteroid therapy. Calcif Tissue Int 2001; 69: 242–247.
- [30] Reid DM, Devogelaer JP, Saag K, et al. Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet 2009; 373: 1253–1263.
- [31] Saag KG, Zanchetta JR, Devogelaer JP, et al. Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of a randomized, double-blind, controlled trial. Arthritis Rheum 2009; 60: 3346–3355.
- [32] Donaldson LJ, Cook A, Thomson RG. Incidence of fractures in a geographically defined population. J Epidemiol Community Health 1990; 44: 241–245.
- [33] Gilsanz V, Kovanlikaya A, Costin G, et al. Differential effect of gender on the sizes of the bones in the axial and appendicular skeletons. J Clin Endocrinol Metab 1997; 82: 1603–1607.
- [34] Saag KG, Emkey R, Schnitzer TJ, et al. Alendronate for the prevention and treatment of glucocorticoid-induced osteoporosis. Glucocorticoid-Induced Osteoporosis Intervention Study Group. N Engl J Med 1998; 339: 292–299.