Ovlivnění interleukinu 17A v biologické terapii psoriázy a psoriatické artritidy
Souhrn:
Salavec M. Ovlivnění interleukinu 17A v biologické terapii psoriázy a psoriatické artritidy. Remedia 2019; 29: 559–565.
Článek se zabývá ovlivněním interleukinu 17A (IL‑17A) v biologické terapii závažných forem psoriázy a psoriatické artritidy. Je představena funkce IL‑17A v imunologii a patofyziologii kožní psoriázy, entezitidy a psoriatické artritidy, diskutovány jsou klinické aspekty přerušení biologické terapie ovlivňující možnost relapsů onemocnění i faktory léčby zajišťující dlouhodobou remisi včetně tzv. hluboké remise na úrovni genové exprese.
Summary:
Salavec M. Influencing interleukin 17A in biological therapy of psoriasis and psoriatic arthritis. Remedia 2019; 29: 559–565.
The review is focused on influencing interleukin 17A (IL‑17A) in biological therapy of severe types of psoriasis and psoriatic arthritis. The function of IL‑17A in immunology and pathophysiology of dermal psoriasis, enthesitis and psoriatic arthritis is presented. Clinical aspects of interrupting biological therapy influencing the possibility of disease relapses are discussed as well as treatment factors ensuring long‑term remission, including so called deep remission on the level of gene expression.
Key words: psoriasis, psoriatic arthritis, pathogenesis, IL‑17 axis, IL‑17 inhibition, disease remission, disease relapse.
terapie je vhodná k léčbě závažných forem lupénky. Tato terapie ovlivňuje imunologickou kaskádu vedoucí k aktivaci chronického systémového zánětlivého procesu v patogenezi psoriázy. Klíčovou roli hrají T lymfocyty produkující řadu cytokinů, které způsobují proliferaci keratinocytů. Na trhu je v současné době k dispozici dynamicky se rozvíjející nabídka řady biologik ovlivňujících základní cytokiny patogeneze ‒ tumor nekrotizující faktor alfa (TNFα), interleukin 23 (IL 23) a interleukin 17 (IL 17). V brzké době se očekává až devět dostupných biologik ovlivňujících tyto interleukiny zapojené do patogeneze onemocnění. Moderní biologické přípravky většinou vykazují vynikající terapeutickou odezvu s dosažením indexu PASI (Psoriasis Area and Severity Index) 90‒100. Takto rovněž významným způsobem přispívají ke zlepšení kvality života léčených pacientů. Ovlivnění osy IL 17 vykazuje velmi dobrý efekt jak u psoriázy, tak u artropatických forem lupénky.
Funkce IL 17A v imunologii a patofyziologii kožní psoriázy, entezitidy a psoriatické artritidy
Interleukin 17A představuje hlavní efektorový cytokin v patogenezi psoriázy. Existují důkazy indikující, že hlavními zdroji produkce IL 17A u nemocných s lupénkou jsou mastocyty, γδT buňky, αβT buňky a lymfoidní buňky v lezionální kůži a synoviální tekutině. V kůži a kloubech účinkuje IL 17A na buněčné cíle včetně keratinocytů, neutrofilů, endoteliálních buněk, fibroblastů, osteoklastů, chondrocytů a osteoblastů stimulací produkce různých antimikrobiálních peptidů, chemokinů, prozánětlivých a proliferativních cytokinů, které podporují rozvoj zánětu ve tkáni a remodelaci kostní tkáně. Mezi antimikrobiální peptidy stimulované IL 17 řadíme např. lipokalin 2, S100A proteiny, beta defenziny, prozánětlivé cytokiny a chemokiny jako IL 1β, TNFα, IL 6, IL 17C, CXCL1, CXCL3, CXCL5, CXCL8 (IL 8) a CCL20, a konečně i proliferativní cytokiny (např. IL 19). Řadu let se hypoteticky uváděly jako primární zdroj IL 17A u psoriázy Th17 lymfocyty. Tyto buňky se diferencují z naivních T buněk pod vlivem transformujícího růstového faktoru beta 1 (TGF β1) a prozánětlivých cytokinů IL 1β, IL 6 a/nebo IL 21. Diferencované humánní Th17 buňky jsou stimulovány k produkci cytokinů působením IL 23, který též podporuje přežití Th17 buněk. Kromě IL-17A produkují Th17 lymfocyty celou řadu cytokinů (např. IL 17F, IL 21, IL 22, IL 26 a TNFα).
V krvi a v postižené kůži pacientů s lupénkou i v synoviální tekutině nemocných s psoriatickou artritidou (PsA) zjišťujeme zvýšená množství Th17 lymfocytů. Dalším zdrojem IL 17A jsou mastocyty, γδT buňky, αβT buňky a vrozené lymfoidní buňky. Vazbou na receptor zvyšuje IL 17A expresi prozánětlivých cytokinů, ať již genovou transkripcí de novo, či stabilizací mRNA (jednovláknová ribonukleová kyselina) prozánětlivých cytokinů a chemokinů [1]. Jak již bylo uvedeno, Th17 lymfocyty nejsou jediným zdrojem IL 17A. Bez ohledu na zdroj, neutrofily produkovaný IL 17A může být cíleně vázán inhibitory IL 17A. Tyto látky totiž naruší komunikaci na úrovni neutrofil‒keratinocyt a sníží tak příliv neutrofilů do psoriatických lézí. Mastocyty mohou také obsahovat mRNA pro IL 17, produkují menší množství IL 17A a exprimují IL 17 receptor. Neutrofily, mastocyty a další buňky vrozeného imunitního systému hrají také roli v patogenezi PsA. Infiltrace mastocyty a exprese IL 17A jsou též pozorovány v synoviálním zánětu u spondyloartritidy a jak mastocyty, tak neutrofily jsou hlavními buněčnými zdroji IL 17 i u ateroskle
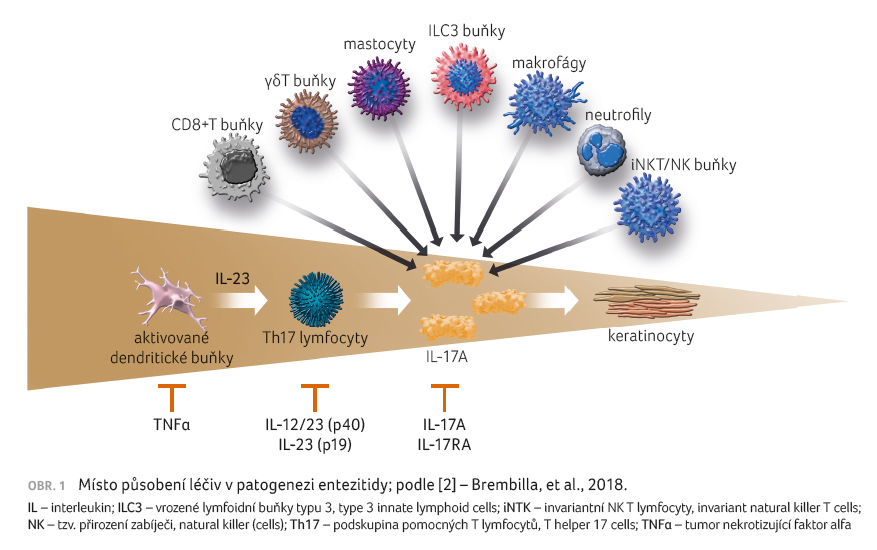
rózy [2]. V dermis psoriatických plaků, stejně jako v periferní krvi a synoviální tekutině pacientů s PsA, jsou zjišťovány zvýšené koncentrace γδT buněk (mohou exprimovat IL 23R, C C chemokinový receptor typu 6 – CCR6 – povrchový buněčný receptor periferních γδT buněk exprimujících IL 17A). Exprese CCR6 a jeho ligandu CCL20 dendritickými a T buňkami v humánních psoriatických lézích (role v komunikaci dendritických a T buněk) vede k T buněčné aktivaci. Stimulace těchto buněk IL 23 a TNFα podporuje i diferenciaci vrozených lymfoidních buněk typu 3 (ILC3), což vyústí v produkci IL 17A, IL 22 a CCR6. Vrozené lymfoidní buňky typu 3 a všechny další popsané buňky byly identifikovány i u entezitidy a v humánní populaci mohou vést při produkci IL 17A k jejímu vzniku (obr. 1).
Vztah mezi IL 17 a TNFα je dán mimo jiné synergickým účinkem v regulaci řady keratinocytárních genů zvýšeně exprimovaných v lézích psoriázy.
V patogenezi psoriázy jsou tedy
IL 17A a IL 23 klíčovými zánětlivými cytokiny.
Interleukin 23 stimuluje diferenciaci,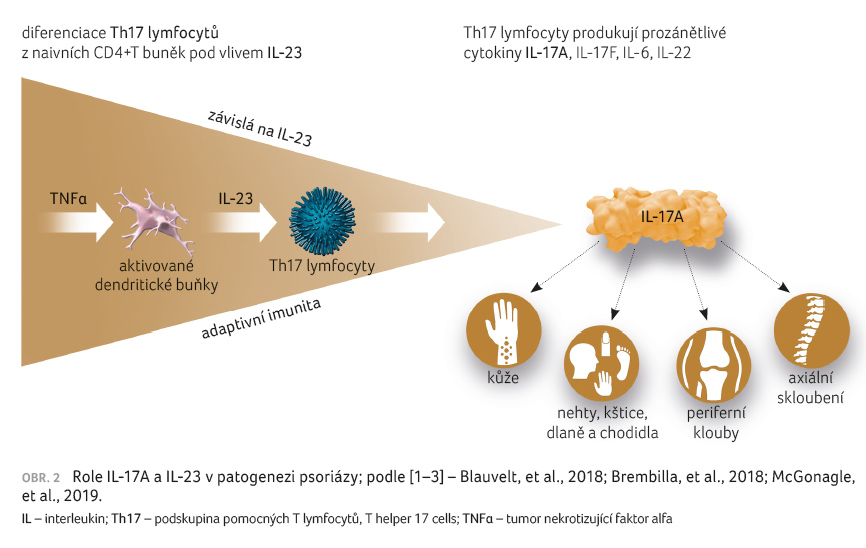 aktivaci, proliferaci
a přežití Th17 lymfocytů, které podporují produkci
efektorových cytokinů, jako jsou IL 17A a IL 22
(obr. 2). Interleukin
17 je však také produkován nezávisle na IL 23.
Interleukin 23 představuje tzv. upstream, IL 17A je
charakterizován jako tzv. downstream. Právě IL 17A tedy přímo
ovlivňuje změny ve tkáni. Vykazuje řadu efektů na různé
buněčné cíle v kůži a v kloubech s podporou
zánětlivého procesu, koagulace a poškození kloubního
a kostního systému. Hlavními cíli IL 17A u psoriázy
jsou keratinocyty, endoteliální buňky a buňky vrozeného
imunitního systému. Centrální úloha IL 23 a IL 17A
v patogenezi psoriázy a PsA vyústila ve vývoj
biologických terapií zacílených na tyto cytokiny. Inhibitory
IL 23 a IL 12/23 vyžadují udržovací dávkování
každých 8‒12 týdnů, zatímco udržovací dávky u inhibitorů
IL 17A jsou v rozmezí čtyř týdnů. Antagonista IL 17
receptoru A je indikován k podání každé dva týdny
[3,4]. Bezpečnostní data z klinických studií inhibitorů
IL 17A ukazují na fakt, že exacerbace zánětlivých
střevních onemocnění (inflammatory bowel disease, IBD) se při
užití inhibice IL 17 vyskytuje zřídka. Užití inhibitorů
IL 17A by nicméně mělo být u nemocných s anamnézou
IBD velmi pečlivě posouzeno [5]. Blokátory IL 17 jsou
též spojovány se zvýšeným rizikem mukokutánních kandidových
infekcí (IL 17 hraje důležitou roli v kontrole infekcí
Candida albicans
na kůži a sliznicích). To vyžaduje pečlivý pravidelný
screening symptomů těchto infekcí.
aktivaci, proliferaci
a přežití Th17 lymfocytů, které podporují produkci
efektorových cytokinů, jako jsou IL 17A a IL 22
(obr. 2). Interleukin
17 je však také produkován nezávisle na IL 23.
Interleukin 23 představuje tzv. upstream, IL 17A je
charakterizován jako tzv. downstream. Právě IL 17A tedy přímo
ovlivňuje změny ve tkáni. Vykazuje řadu efektů na různé
buněčné cíle v kůži a v kloubech s podporou
zánětlivého procesu, koagulace a poškození kloubního
a kostního systému. Hlavními cíli IL 17A u psoriázy
jsou keratinocyty, endoteliální buňky a buňky vrozeného
imunitního systému. Centrální úloha IL 23 a IL 17A
v patogenezi psoriázy a PsA vyústila ve vývoj
biologických terapií zacílených na tyto cytokiny. Inhibitory
IL 23 a IL 12/23 vyžadují udržovací dávkování
každých 8‒12 týdnů, zatímco udržovací dávky u inhibitorů
IL 17A jsou v rozmezí čtyř týdnů. Antagonista IL 17
receptoru A je indikován k podání každé dva týdny
[3,4]. Bezpečnostní data z klinických studií inhibitorů
IL 17A ukazují na fakt, že exacerbace zánětlivých
střevních onemocnění (inflammatory bowel disease, IBD) se při
užití inhibice IL 17 vyskytuje zřídka. Užití inhibitorů
IL 17A by nicméně mělo být u nemocných s anamnézou
IBD velmi pečlivě posouzeno [5]. Blokátory IL 17 jsou
též spojovány se zvýšeným rizikem mukokutánních kandidových
infekcí (IL 17 hraje důležitou roli v kontrole infekcí
Candida albicans
na kůži a sliznicích). To vyžaduje pečlivý pravidelný
screening symptomů těchto infekcí.
Důležitým faktorem v ovlivnění
psoriázy je možná exacerbace lézí po ukončení terapie. Ta
je spojovánas genomickým profilem reziduálního onemocnění.
Relapsy mohou být způsobeny reziduálními paměťovými T buňkami
ve tkáni. Klinický relaps ve stejných okrscích kůže
může být určován i přítomností IL 17A produkujícími
αβT buněčnými klony v psoriatické lezionální kůži
po terapii. Tyto klony produkují podstatně vyšší množství
IL 17A než αβT buněčné klony ve zdravé kůži.
Inhibice IL 17A normalizuje hodnoty dysregulovaných proteinů
včetně IL-1β, IL 8, antagonisty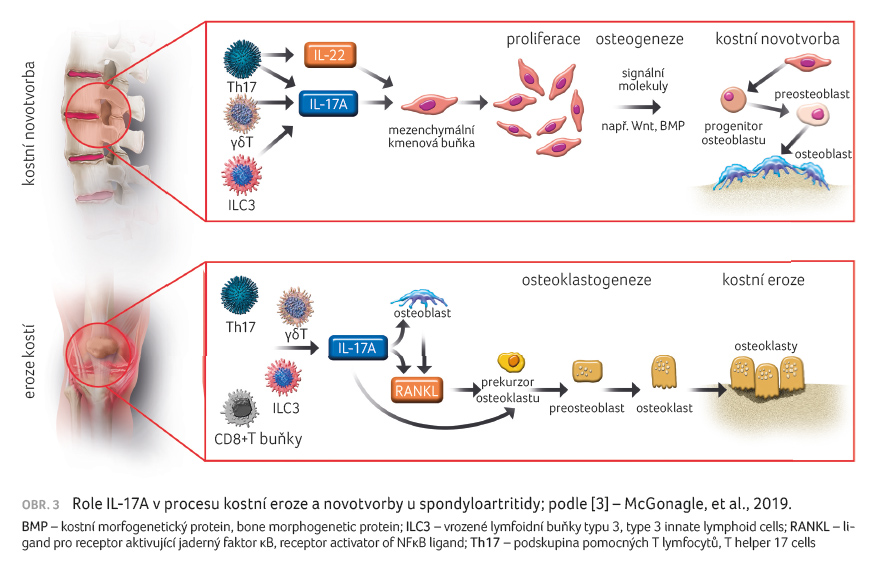 receptoru pro IL 1,
myeloperoxidázy, již výše zmíněných antimikrobiálních
peptidů, matrixmetaloproteinázy 1, 8 a 9 a dalších
cytokinů (CXCL1, CXCL5 a CCL20 – podpora přítomnosti
Th17 lymfocytů). Inhibitor IL 17A sekukinumab snižuje rovněž
hodnoty mRNA klíčových prozánětlivých cytokinů (IL 17A,
IL 23A, IL 12B, IL 17F, IL 22, IL 26)
a snižuje míru exprese genů kódujících prozánětlivé
cytokiny. Tato hluboká imunologická stabilizace na molekulární
úrovni je jedním z předpokládaných mechanismů zodpovědných
za dlouhodobou remisi onemocnění, která byla pozorována
receptoru pro IL 1,
myeloperoxidázy, již výše zmíněných antimikrobiálních
peptidů, matrixmetaloproteinázy 1, 8 a 9 a dalších
cytokinů (CXCL1, CXCL5 a CCL20 – podpora přítomnosti
Th17 lymfocytů). Inhibitor IL 17A sekukinumab snižuje rovněž
hodnoty mRNA klíčových prozánětlivých cytokinů (IL 17A,
IL 23A, IL 12B, IL 17F, IL 22, IL 26)
a snižuje míru exprese genů kódujících prozánětlivé
cytokiny. Tato hluboká imunologická stabilizace na molekulární
úrovni je jedním z předpokládaných mechanismů zodpovědných
za dlouhodobou remisi onemocnění, která byla pozorována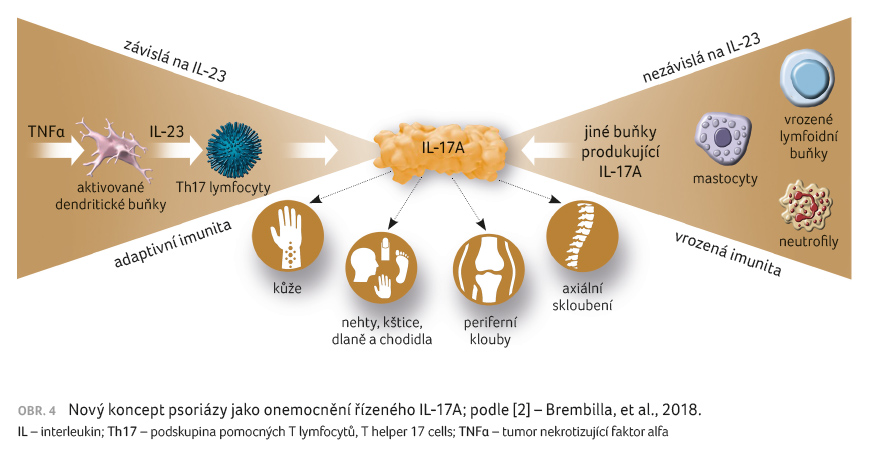 u významné části pacientů po experimentálním
přerušení léčby [6,7]. Interleukin 17A hraje klíčovou
roli v patogenezi PsA s ovlivněním fibroblastů,
osteoblastů a prekurzorů osteoklastů v podpoře zánětu
a kloubního poškození (obr. 3). Inhibice IL 17A sekukinumabem a ixekizumabem
je schválena pro terapii PsA [8,9]. Klinické studie prokázaly
zmírnění kloubních i kožních příznaků a známek
onemocnění s pozitivním vlivem na zlepšení kvality
života při léčbě sekukinumabem [10–13]. Rozdílná odpověď
na inhibitory IL 17A a IL 23 u axiálních
onemocnění (nedostatečná odpověď při užití inhibitorů
IL 12/23 i inhibitoru IL 23 p19; ustekinumab
a risankizumab u axiální spondyloartritidy a ankylozující
spondylitidy) předpokládá, že hlavním zodpovědným cytokinem
v patogenezi axiálních spondyloartritid je IL 17 a jeho
produkce bude z větší části nezávislá na IL 23
(tab. 1, obr. 4). Inhibitory IL 17A tedy vykazují efekt v léčbě
řady aspektů axiálních onemocnění a příznivě ovlivňují
nejen kožní léze, ale i entezitidy, synovitidy, kostní
eroze, novotvorbu kostní tkáně i bolestivost (obr. 5).
u významné části pacientů po experimentálním
přerušení léčby [6,7]. Interleukin 17A hraje klíčovou
roli v patogenezi PsA s ovlivněním fibroblastů,
osteoblastů a prekurzorů osteoklastů v podpoře zánětu
a kloubního poškození (obr. 3). Inhibice IL 17A sekukinumabem a ixekizumabem
je schválena pro terapii PsA [8,9]. Klinické studie prokázaly
zmírnění kloubních i kožních příznaků a známek
onemocnění s pozitivním vlivem na zlepšení kvality
života při léčbě sekukinumabem [10–13]. Rozdílná odpověď
na inhibitory IL 17A a IL 23 u axiálních
onemocnění (nedostatečná odpověď při užití inhibitorů
IL 12/23 i inhibitoru IL 23 p19; ustekinumab
a risankizumab u axiální spondyloartritidy a ankylozující
spondylitidy) předpokládá, že hlavním zodpovědným cytokinem
v patogenezi axiálních spondyloartritid je IL 17 a jeho
produkce bude z větší části nezávislá na IL 23
(tab. 1, obr. 4). Inhibitory IL 17A tedy vykazují efekt v léčbě
řady aspektů axiálních onemocnění a příznivě ovlivňují
nejen kožní léze, ale i entezitidy, synovitidy, kostní
eroze, novotvorbu kostní tkáně i bolestivost (obr. 5).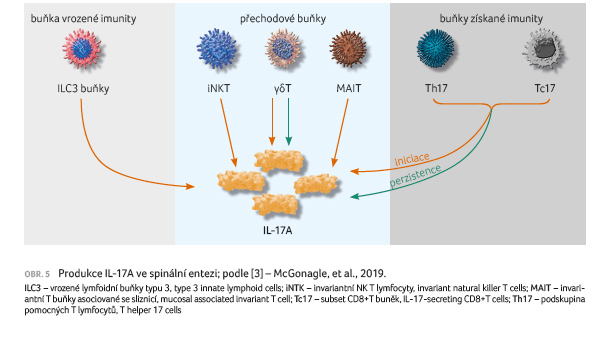
Interleukin 17 podporuje také
vaskulární zánět, endoteliální dysfunkce, koagulaci, trombózu
a arteriální hypertenzi. Zvýšené hodnoty IL 17 byly
pozorovány u nemocných s akutním infarktem myokardu.
V lidské populaci a dle dat z registrů akutního
infarktu myokardu bylo prokázáno, že sérové hodnoty IL 17A
nižší než medián 6,26 pg/ml byly asociovány s vyšším
rizikem mortality a opakovaných infarktů myokardu (řada
nemocných vykazuje však hodnoty IL 17A pod detekčním limitem
esejí při hodnotě 2,5 pg/ml).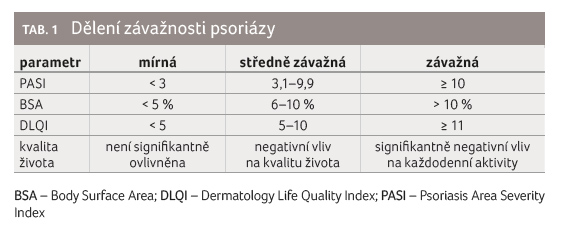
Do vývoje psoriatického procesu je tedy zahrnuta celá řada cytokinů, nicméně uvedená data stavějí IL 17A do role hlavního efektorového cytokinu patogeneze. Interleukin 17 je produkován řadou buněk a účinkuje na řadu buněčných cílů ve tkáni a imunitních buňkách, a hraje tedy důležitou roli ve vrozené a adaptivní imunitě. Lymfocyty Th17 se staly centrálním bodem extenzivního výzkumu a IL 17A byl identifikován jako klíčový efektorový patogenní faktor psoriázy. Účinkuje hlavně na non hematopoetické buňky, zvláště na epiteliální buňky, a vede ke zvýšené proliferaci a narušené diferenciaci keratinocytů. Aktivované keratinocyty proliferují abnormálním způsobem a uvolňují další zánětlivé mediátory a chemokiny zesilující zánětlivou odpověď. Interleukin 17A tedy participuje na vytvoření a zesílení zánětlivé odpovědi podporou uvolnění antimikrobiálních peptidů a prozánětlivých působků. Inhibice IL 17A a inhibice receptoru IL 17A vede k přerušení signálních cest kritických pro vývoj a udržení psoriatických změn a také k rychlému a dramatickému zmírnění kloubních symptomů u PsA.
Klinické aspekty přerušení terapie a dlouhodobé remise
Náhlé přerušení užívání biologické léčby může být v některých případech asociováno s poměrně rychlým relapsem [14‒16]. V literatuře byl popsán po ukončení terapie zaměřené na blokádu receptoru pro IL 17 i tzv. rebound pustulózní psoriázy [14,15]. V kůži pacientů s pustulózní psoriázou jsou zaznamenávány významně vysoké hodnoty IL 17 mRNA v porovnání s hodnotami u dalších klinických typů a zdravých osob. Jak již bylo uvedeno, jde také o možný vliv rezidentních Th17 lymfocytů. Tyto poznatky jsou důležité při zvažování udržovací strategie u pacientů dosahujících úplné klinické odpovědi. Je nutné mít na zřeteli, že produkce IL 17 je udržována rezidentními paměťovými buňkami ve tkáni, a to i v normálně vyhlížející kůži, která vykazovala před léčbou psoriatickou plaku. Náhlé přerušení léčby i přes dobrý klinický efekt lze pozorovat v reálném životě u nemocných podstupujících chirurgické zákroky, vykazujících aktivní infekci či u těhotných žen. Vyskytují se i pacienti se ztrátou compliance (dlouhodobé cestovní pobyty bez možnosti zachovat dosavadní terapii) [6].
Terapie sekukinumabem vykazuje vysoký stupeň kontroly psoriatického onemocnění dle řady studií [8,12,13]. Opakované zavedení této molekuly prokázalo vysokou úroveň odpovědi u pacientů, u kterých byla v rámci klinické studie léčba přerušena [7]. Skóre PASI 75 bylo dosaženo ve 12.‒16. týdnu opakované léčby u více než 90 % pacientů. U skupin, které vykázaly skóre PASI 90 a PASI 100 před přerušením léčby, byly hodnoty opětovného dosažení PASI 75 zaznamenány dokonce u vyššího podílu pacientů [6]. Při výskytu relapsu bylo zavedení opakované terapie následováno rychlým dosažením odpovědi. Absence protilátek proti sekukinumabu pozorovaná u těchto pacientů odpovídá nízkému imunogennímu potenciálu sekukinumabu [8,25].
Lebwohl a kol. [6] publikovali poster o dlouhodobé kontrole psoriázy při experimentálním přerušení terapie sekukinumabem. U 21 % sledovaných pacientů nedošlo k relapsu po dobu jednoho roku od přerušení terapie a u 10 % pacientů bylo pozorováno udržení remise po dobu dvou let. Průměrné skóre PASI u nemocných bez relapsu se pohybovalo v hodnotách 2,7 v prvním roce sledování a 1,7 dva roky po poslední dávce sekukinumabu. Autoři sledovali také vztah mezi vstupními charakteristikami a dlouhodobými výsledky terapie. U pacientů bez relapsu do jednoho roku činila doba onemocnění průměrně 16 let, zatímco u nemocných bez relapsu do dvou let 13,9 roku. To tedy znamená, že trvání onemocnění může být asociováno s dlouhodobými efekty. Čím delší je trvání psoriázy, tím menší je pravděpodobnost dosažení dlouhodobého stavu bez relapsu [6].
Hluboká remise na úrovni genové exprese
Data z odlišné mechanistické studie s pacienty s psoriázou a hodnotou PASI ≥ 75 a s obdobnými vstupními charakteristikami prokázala, že po roce terapie sekukinumabem byla genová exprese v kůži pacientů virtuálně neodlišitelná od zdravých dobrovolníků (měřeno analýzou PCA, Principal Component Analysis). Hodnoty mRNA pro klíčové geny zahrnuté do procesu vývoje kožních lézí psoriázy a cytokiny vztažené k IL 23 a IL 17 patomechanismům byly obdobné ve srovnání s normální zdravou kůží po roční terapii sekukinumabem (obr. 6). Zároveň bylo zjištěno, že 85 % zvýšeně regulovaných genů (up regulace) a 75 % v aktivitě potlačených genů (down regulace) v lezionální psoriatické kůži se vrátilo na hodnoty pozorované u normální zdravé kůže. Aktivita těchto „horkých“ a „studených“ genů se mění v souvislosti s vývojem lézí u lupénky [6].
Sekukinumab tedy navozuje kompletní ovlivnění genové exprese. Kvůli dosažení optimálního efektu by neměl lékař váhat a měl by pokračovat v terapii sekukinumabem. Hluboká molekulární normalizace může vysvětlit dlouhodobé periody bez relapsu zjišťované někdy u psoriatických pacientů po přerušení léčby. Sekukinumab dle autorů modifikuje průběh chronických středně závažných až závažných psoriáz i při pozdním zahájení léčby v průběhu onemocnění. Terapie nemocných v časných stadiích může vykázat dokonce větší potenciál modifikace choroby [6].
Seznam použité literatury
- [1] Blauvelt A, Chiricozzi A. The Immunologic Role of IL‑17 in Psoriasis and Psoriatic Arthritis Pathogenesis. Clin Rev Allergy Immunol 2018; 55: 379‒390.
- [2] Brembilla NC, Senra L, Boehncke WH. The IL‑17 Family of Cytokines in Psoriasis: IL‑17A and Beyond. Front Immunol 2018; 9: 1682.
- [3] McGonagle DG, McInnes IB, Kirkham BW, et al. The role of IL‑17A in axial spondyloarthritis and psoriatic arthritis: recent advances and controversies. Ann Rheum Dis 2019; 78: 1167‒1178.
- [4] SPC Kyntheum. Dostupné na: www.sukl.cz
- [5] Schreiber S, Colombel JF, Feagan BG, et al. Incidence rates of inflammatory bowel disease in patients with psoriasis, psoriatic arthritis and ankylosing spondylitis treated with secukinumab: a retrospective analysis of pooled data from 21 clinical trials. Ann Rheum Dis 2019; 78: 473‒479.
- [6] Lebwohl M, et al. Poster presented at: EADV Conference; Geneva, Switzerland; 13 September 2017. E‑Poster #P1747.
- [7] Mate E, Lebwohl M, Iversen L, et al. Long‑term Psoriasis Control Following Secukinumab Discontinuation Indicates Disease Modification of Moderate‑to‑Severe Psoriasis: Clinical and Mechanistic Results. 2018 Dermcoll, Abstr 224.
- [8] SPC Cosentyx. Dostupné na: www.sukl.cz
- [9] SPC Taltz. Dostupné na: www.sukl.cz
- [10] Strand V, Mease P, Gossec L, et al. Secukinumab improves patient‑reported outcomes in subjects with active psoriatic arthritis: results from a randomised phase III trial (FUTURE 1). Ann Rheum Dis 2017; 76: 203‒207.
- [11] Mease P, van der Heijde D, Landewé R, et al. Secukinumab improves active psoriatic arthritis symptoms and inhibits radiographic progression: primary results from the randomised, double‑blind, phase III FUTURE 5 study. Ann Rheum Dis 2018; 77: 890‒897.
- [12] Langley RG, Elewski BE, Lebwohl M, et al. Secukinumab in plaque psoriasis ‒ results of two phase 3 trials. N Engl J Med 2014; 371: 326‒338.
- [13] Blauvelt A, Reich K, Tsai TF, et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate‑to‑severe plaque psoriasis up to 1 year: Results from the CLEAR study. J Am Acad Dermatol 2017; 76: 60‒69.e9.
- [14] Khemis A, Cavalié M, Montaudié H, et al. Rebound pustular psoriasis after brodalumab discontinuation. Br J Dermato 2016; 175: 1065‒1066.
- [15] Masson Regnault M, Konstantinou MP, Khemis A, et al. Early relapse of psoriasis after stopping brodalumab: a retrospective cohort study in 77 patients. J Eur Acad Dermatol Venereol 2017; 31: 1491‒1496.
- [16] Khemis A, Kelati A, Montaudié H, et al. Successful treatment of severe psoriasis relapse with secukinumab (interteukin 17 A inhibitor) after abrupt brodalumab (interleukin 17 receptor inhibitor) discontinuation: A retrospective study evaluating long‑term efficacy and safety. J Am Acad Dermatol 2018; 79: 758‒760.
- [17] Bissonnette R, Luger T, Thaçi D, et al. Secukinumab demonstrates high sustained efficacy and a favourable safety profile in patients with moderate‑to‑severe psoriasis through 5 years of treatment (SCULPTURE Extension Study). J Eur Acad Dermatol Venereol 2018; 32: 1507–1514.
- [18] Bagel J, Duffin KC, Moore A, et al. The effect of secukinumab on moderate‑to‑severe scalp psoriasis: Results of a 24‑week, randomized, double‑blind, placebo‑controlled phase 3b study. J Am Acad Dermatol 2017; 77: 667–674.
- [19] Reich K, Arenberger P, Mrowietz U, et al. Secukinumab shows high and sustained efficacy in nail psoriasis: 2.5‑year results from the TRANSFIGURE study. PCG congress 2017, Abstr P021.
- [20] Gottlieb A, Sullivan J, Kubanov A, et al. Secukinumab shows high and sustained efficacy in patients with moderate‑to‑severe palmoplantar psoriasis: 2.5‑year results from the GESTURE study. PCG congress 2017, Abstr P026.
- [21] Kavanaugh A, Mease PJ, Reimold AM, et al. Secukinumab for Long‑Term Treatment of Psoriatic Arthritis: A Two‑Year Followup From a Phase III, Randomized, Double‑Blind Placebo‑Controlled Study. Arthritis Care Res 2017; 69: 347–355.
- [22] Nash P, McInnes IB, Rahman P, et al. Secukinumab provides sustained improvements in the signs and symptoms of active psoriatic arthritis: 3‑year results from the phase 3 future 2 study. EULAR 2018, Abstr THU0322. Dostupné na: https://ard.bmj.com/content/77/Suppl_2/379.1
- [23] Kampylafka E, d’Oliveira I, Linz C, et al. Disease interception in psoriasis patients with subclinical joint inflammation by interleukin 17 inhibition with secukinumab – data from a prospective open label study. EULAR 2018, Abstr OP0305. Dostupné na: https://ard.bmj.com/content/77/Suppl_2/199.1
- [24] Baraliakos X, Braun J, Deodhar AA, et al. Long‑Term Evaluation of Secukinumab in Ankylosing Spondylitis: 5 Year Efficacy and Safety Results from a Phase 3 Trial. ACR 2018, Abstr L13. Dostupné na: abstracts.org/abstract/long‑term‑evaluation‑of‑secukinumab‑in‑ankylosing‑spondylitis‑5‑year‑efficacy‑and‑safety‑results‑from‑a‑phase‑3‑trial/
- [25] Blauvelt A, Reich K, Warren RB, et al. Secukinumab re‑initiation achieves regain of high response levels in patients who interrupt treatment for moderate to severe plaque psoriasis. Br J Dermatol 2017; 177: 879‒881.