Perorální antidiabetika skupiny derivátů sulfonylurey
Perorální antidiabetika sulfonylureové řady ve správné indikaci již více než půl století významně přispívají k optimální léčbě diabetu a tím i k prevenci jeho komplikací. Patří do skupiny inzulinových sekretagog mezi tzv. iniciátory inzulinové sekrece. Významně snižují glykémii nalačno i po jídle, tlumí nadprodukci glukózy v játrech a mají i další klinicky významné efekty. Jejich využití limituje hypoglykémie, jejíž výskyt, projevy a následky souvisejí s volbou vhodné látky této skupiny. V nových doporučeních léčby diabetu 2. typu mají stále své místo, i když léčbu jimi dnes většinou obligatorně nezačínáme. Tato léčiva jsou vhodná do kombinace s metforminem, thiazolidindiony i s inzulinem.
Úvod
Sulfonylureová perorální antidiabetika (SU-PAD) patří do skupiny inzulinových sekretagog. Jsou používána v léčbě diabetu 2. typu již více než padesát let a u diabetiků se zachovalou vlastní sekrecí inzulinu znamenala novou alternativu k tehdy jedinému účinnému antidiabetickému léku inzulinu. Dnes jsou SU-PAD vnímána již jako osvědčená rutinně používaná léčiva, kontinuálně ale probíhá výzkum jejich efektů a vývoj nových látek.
SU-PAD obsahují skupinu sulfonylurey a jsou odvozena od sulfonamidů. Jejich hypoglykemický účinek byl náhodně objeven v roce 1942, když byl v léčbě tyfu použit glyprothiazol. Další úpravy molekuly zvýšily jejich hypoglykemickou aktivitu a snížily toxicitu. V roce 1956 tak byly do klinické praxe uvedeni první zástupci tzv. první generace SU-PAD, karbutamid a tolbutamid. O několik let později byla novými zásahy do molekuly syntetizována SU-PAD druhé generace.
U nás byly používány chlorpropamid a tolbutamid, SU-PAD první generace, a glibenklamid jako zástupce druhé generace. Po stažení chlorpropamidu z trhu pro závažné nežádoucí účinky na konci sedmdesátých let minulého století se mohli diabetologové rozhodovat pouze mezi poměrně málo účinným tolbutamidem a dodnes nejpotentnějším glibenklamidem. Až v polovině osmdesátých let minulého století se u nás objevil nejprve gliklazid, který byl jako úzkoprofilový lék doporučen pouze diabetikům s retinopatií, a krátce potom rovněž pro omezenou skupinu diabetiků glikvidon a glipizid. Teprve začátek devadesátých let umožnil volné individuální použití SU-PAD. Koncem devadesátých let minulého století obohatil jejich škálu nový derivát glimepirid. Dnes je k dispozici řada přípravků včetně fixních kombinací SU-PAD s metforminem. Gliklazid je dostupný i v tabletách s řízeným uvolňováním, tedy s rovnoměrným účinkem (gliklazid MR). Od SU-PAD byla odvozena krátkodobá inzulinová sekretagoga glinidy a jsou vyvíjena i další inzulinová sekretagoga, například antagonisté a2-adrenergních receptorů.
Farmakologické vlastnosti
SU-PAD významně snižují glykémii nalačno i po jídle (v průměru o 3–4 mmol/l). To je důsledek zlepšení první fáze inzulinové sekrece a potlačení vystupňované tvorby glukózy v jaterní tkáni. Kompenzace glykémií snižuje metabolické toxické účinky hyperglykémie, tedy inhibici sekrece a účinku inzulinu. Při glykémii vyšší než 20 mmol/l už ale většina SU-PAD neúčinkuje.
SU-PAD zvyšují sekreci inzulinu z β-buněk pankreatu bazálně i prandiálně a předpokládá se, že mají také extrapankreatické účinky. Během rozvoje diabetu se na snížení sekrece inzulinu podílí snížení odpovědi β-buňky na glukózu, neglukózové podněty, snížení regulace syntézy proinzulinu a omezení růstu β-buněk. Chronická hyperglykémie (glukotoxicita) podporuje down regulaci inzulinových receptorů a glukózových přenašečů. Při dlouhodobém podávání SU-PAD může dojít k snížení počtu sulfonylureových receptorů na β-buňkách, k snížení jejich účinku a k nárůstu inzulinové rezistence. SU-PAD rovněž snižují nadprodukci glukózy v játrech a zčásti upravují postreceptorový defekt účinku inzulinu ve svalové a tukové tkáni.
Všechna SU-PAD mají podobný mechanismus účinku. Liší se vazbou na sulfonylureové receptory a vykazují odlišnou farmakokinetiku. Chlorpropamid a tolbutamid (první generace) jsou dnes již obsoletní. SU-PAD druhé generace se liší od zástupců první generace ve velikosti účinné terapeutické dávky (miligramy u druhé generace, gramy u první). Tento rozdíl nemá vliv na sílu jejich účinku, výskyt lékových interakcí a vedlejších účinků je však u druhé generace významně nižší. Podle výsledků některých studií snižuje druhá generace glykémii více než první, ale rozdíl ve snížení hladiny glykovaného hemoglobinu byl zaznamenán jen ojediněle.
Antiagregační účinek SU-PAD nebyl dosud plně objasněn [1]. Některé starší práce [2] popisují v experimentu inhibiční efekt na adhezi a agregaci destiček během léčby gliklazidem, glimepiridem a glibenklamidem. Zdá se, že zatímco glimeprid a glibenklamid inhibují metabolismus kyseliny arachidonové, gliklazid má spíše přímý inhibiční efekt na agregaci destiček [2]. Významnější antiagregační efekt in vitro byl dále popsán u glikvidonu, potvrzen u glibenklamidu, gliklazidu, nejsilnější byl u glimepiridu [1]. Ve starší práci byl popsán antiagregační a také scavengerový efekt u 30 diabetiků s retinopatií [3].
Antiaterogenní efekt byl nověji popsán u králíků, pravděpodobně v důsledku inhibice oxidace LDL částic [4]. Jak prokázalo také ultrazvukové měření stěny karotické arterie u diabetiků 2. typu po třech letech sledování, zpomalila se při léčbě gliklazidem progrese aterosklerózy. Tento antiaterogenní efekt gliklazidu je vysvětlován jeho scavengerovým efektem, příznivým ovlivněním endoteliální funkce a snížením aktivity destiček [5]. Předpokládá se, že antioxidační vlastnosti gliklazidu přispívají ke snížení rizika infarktu myokardu a snížení mortality u pacientů léčených gliklazidem [6, 7].
Mechanismus účinku
SU-PAD mají schopnost ovlivnit draslíkové kanály v buněčné membráně [8]. Draslíkové kanály, jejichž činnost je závislá na množství adenozintrifosfátu (ATP) v buňce, se nacházejí i v β-buňkách pankreatu. V bazálním stavu jsou otevřeny a zajišťují polarizaci membrány β-buňky. Vápníkové kanály, jejichž činnost je závislá na napětí membrány, jsou naopak uzavřeny. Metabolismus glukózy a živin zvyšuje tvorbu ATP, na úrovni Krebsova cyklu jsou to aminokyseliny a na úrovni acetylkoenzymu A mastné kyseliny. Zvýšený poměr ATP a adenozindifosfátu (ADP) způsobí uzavření draslíkových kanálů, tím stoupne množství draslíku v membráně a způsobí její depolarizaci. Vápníkový kanál, závislý na napětí membrány, se otevře a dovolí vstup vápníkových iontů do buňky. V cytosolu tedy stoupne koncentrace vápníku, což způsobí vyprázdnění inzulinu z endoplazmatického retikula, tedy z vnitřních buněčných rezerv. K němu dochází exocytózou ze sekrečních granulí v β-buňkách. Pohyb sekrečních granulí k membráně je zprostředkován mikrotubuly a mikrofilamenty, které jsou aktivovány přímo nebo zvýšením koncentrace vápníkových iontů v buňce. Tímto způsobem je aktivována i adenylátcykláza a fosfolipáza C.
SU-PAD a produkty metabolismu živin ovlivňují stejné draslíkové kanály, jejichž činnost je závislá na ATP, ale odlišným mechanismem. SU-PAD se váží na specifické receptory v membráně β-buňky, které jsou spojeny s draslíkovými kanály, a svou vazbou způsobí jejich uzavření. Zdá se, že důvodem necitlivosti β-buněk ke glukóze je také porucha jejího metabolismu. Estery kyseliny jantarové stimulují biosyntézu proinzulinu i inzulinu, zatímco estery jiných intermediárních metabolitů Krebsova cyklu na syntézu inzulinu nepůsobí. Tyto nálezy mohou pomoci zjistit defektní místa v metabolismu glukózy a umožnit vývoj sekretagog, účinkujících cíleně na konkrétní poruchu.
Draslíkové kanály jsou přítomny i v jiných tkáních. Byly prokázány ve vysoké hustotě v srdečních, hladkých a příčně pruhovaných svalových buňkách a v některých mozkových neuronech. Jsou složeny ze dvou odlišných součástí, z podjednotky, která tvoří pór (Kir 6.2), a z receptoru pro sulfonylureu (SUR), které se spojují do jednoho heteromerního komplexu v poměru 4 : 4. Draslíkové kanály v různých tkáních obsahují různé typy podjednotky SUR. SUR1 je přítomen v β-buňkách, SUR2A v buňkách myokardu a SUR2B v hladké svalovině.
V poslední době se řada experimentálních prací zabývá vazbou SU-PAD na extrapankreatické draslíkové kanály. Afinita SU-PAD v experimentech na zvířecích β-buňkách a na buňkách srdečního a hladkého svalu byla nízká k podjednotce Kir 6.2, ale vysoká k podjednotce SUR a její intenzita se lišila u jednotlivých zástupců. Gliklazid a tolbutamid inhibují selektivně kanály se SUR1 (tedy v β-buňce), glibenklamid a glimepirid blokují všechny tři typy SUR stejnou intenzitou. Inhibice proudů SUR gliklazidem a tolbutamidem je reverzibilní. Inhibice proudů Kir 6.2/SUR2A i Kir 6.2/SUR2B glibenklamidem a glimepiridem je rovněž reverzibilní, u Kir 6.2/SUR1 je po dobu 15 minut ireverzibilní.
Farmakokinetika
SU-PAD jsou slabé kyseliny s malým distribučním objemem (10–15 l). V plazmě se z 90 % váží na albumin, jsou metabolizovány v játrech a vylučovány ledvinami nebo stolicí. Odlišnosti ve farmakokinetice jsou důležité při výběru léčiva u konkrétních pacientů.
Absorpce
Rozdíly v absorpci a biologické dostupnosti jsou dány nejen výběrem konkrétní látky, ale závisejí také na době požití jídla a jeho kvalitě (glykemický index) a na dalších okolnostech.
Rychlost absorpce glibenklamidu kolísá a je individuální. Jeho účinnost může být vyšší, jestliže je podán před jídlem. Glibenklamid v dávce 2,5 mg podaný půl hodiny před snídaní byl účinnější než 7,5 mg glibenklamidu požitých se snídaní. Absorpce glipizidu je rychlá. Je-li podán před snídaní, je vstřebávání ještě rychlejší, účinek je vyšší a stimuluje časově uvolnění inzulinu k jídlu. Absorpce gliklazidu je pomalejší u starších osob. U glikvidonu je biologická dostupnost 60%, není známo, zda je jeho účinnost vyšší, pokud se užívá před jídlem nebo s jídlem. U glimepiridu nebyl pozorován rozdíl v účinku při podání 30 minut před jídlem nebo bezprostředně před jídlem.
Plazmatické hladiny většiny krátce účinkujících SU-PAD klesnou před snídaní na nízké hodnoty. Z tohoto důvodu je považováno za optimální podání léčiva ráno 30 minut před snídaní a další dávky pak s jídlem. Absorpci SU-PAD ve střevě negativně ovlivňuje hyperglykémie a zpomalená motilita. Optimální je synchronizování maximální sekrece inzulinu vyvolané SU-PAD s maximálním vzestupem glykémie po jídle.
Eliminace
Všechna SU-PAD jsou úplně metabolizována v játrech. Metabolity glibenklamidu a glimepiridu jsou zčásti slabě aktivní. Většina SU-PAD se vylučuje ledvinami, a proto je u pacientů s renální insuficiencí zvýšené riziko hypoglykémie. Pouze glikvidon se vylučuje takřka úplně (z 95 %) žlučí do stolice. Glimepirid je vylučován ledvinami jen zčásti (60 %), zbytek je vylučován stolicí.
Dávkování
Tradiční podávání SU-PAD dvakrát denně vychází z jejich poločasu v plazmě [8]. Vzhledem k mechanismu účinku (vazba na sulfonylureové receptory) mohou biologické účinky léčiva trvat déle, než by odpovídalo jeho poločasu, a neexistuje přímý vztah mezi sérovou koncentrací léčiva a glykémií nalačno. V případě glipizidu (plazmatický poločas 1–4 hodiny) může účinek dávky 7,5 mg na snižování glykémie přetrvávat 12–14 hodin. Dnes je preferováno podávání v jedné denní dávce, u léčiv s kratším poločasem se dávka rozdělí. V praxi musíme přihlížet také k řadě dalších faktorů, a proto je někdy nutný i větší počet denních dávek (například u slabě účinného glikvidonu). V dlouhodobé léčbě je důležité nepřekračovat střední dávkování. SU-PAD sníží glykémii v průměru o 3–4 mmol/l, další zvyšování dávky již většinou nemá efekt, a navíc se zvyšuje riziko výskytu nežádoucích účinků. Studie ukázaly, že vysoké dávky mohou zhoršit kompenzaci glykémií a zvýšit frekvenci protrahovaných hypoglykémií [9]. Doporučené dávky SU-PAD však zůstávají nezměněny; měly by být titrovány podle glykémií a hladiny glykovaného hemoglobinu.
Klinické zkušenosti
 SU-PAD jsou v současnosti vnímána jako účinná levná léčiva snižující hyperglykémii, s určitým rizikem hypoglykémie a vzestupu hmotnosti a ne zcela jasným vlivem na kardiovaskulární systém. Úspěch léčby SU-PAD je dán do značné míry tím, jak dobře jsme si vědomi jejich možností a indikací (tab. 1) a zda pečlivě zvažujeme rizika této léčby (tab. 2). Doba, po kterou můžeme tato léčiva s úspěchem použít, je dána také tím, jak úspěšně bráníme jejich léčebnému selhání.
SU-PAD jsou v současnosti vnímána jako účinná levná léčiva snižující hyperglykémii, s určitým rizikem hypoglykémie a vzestupu hmotnosti a ne zcela jasným vlivem na kardiovaskulární systém. Úspěch léčby SU-PAD je dán do značné míry tím, jak dobře jsme si vědomi jejich možností a indikací (tab. 1) a zda pečlivě zvažujeme rizika této léčby (tab. 2). Doba, po kterou můžeme tato léčiva s úspěchem použít, je dána také tím, jak úspěšně bráníme jejich léčebnému selhání.
Účinnost v monoterapii
Ve studii UKPDS (UK Prospective Diabetes Study) [10, 11] byl vyhodnocován efekt monoterapie SU-PAD u 1350 nově diagnostikovaných diabetiků 2. typu (průměrný věk 53 let, průměrná glykémie nalačno 9,1 mmol/l, BMI 26,8 kg/m2). Pacienti v sulfonylureové skupině byli léčeni chlorpropamidem nebo glibenklamidem. Po šesti letech selhala monoterapie (glykémie nalačno > 15 mmol/l nebo rozvoj manifestních symptomů hyperglykémie) u 44 % pacientů,  u 48 % léčených glibenklamidem a u 40 % pacientů léčených chlorpropamidem (p < 0,01).
u 48 % léčených glibenklamidem a u 40 % pacientů léčených chlorpropamidem (p < 0,01).
V prvních třech letech selhala monoterapie u 43 % pacientů s BMI < 30 kg/m2 (kteří byli tehdy klasifikováni jako neobézní, dnes je hranice posunuta k 27 kg/m2), u 53 % po šesti letech (p < 0,001). Diabetici, kteří měli zpočátku sníženou funkci β-buněk, byli z hlediska možného selhání monoterapie rizikovější (p < 0,0001). Rychlejší selhání monoterapie bylo konstatováno u pacientů s vyšší glykémií, mladších, se sníženou rezervou β-buněk a ve skupině s glibenklamidem. To jsou dnes již vysvětlené situace, kdy skupina neobézních diabetiků má zpravidla nižší sekreci inzulinu, a je tedy nutné zahájit inzulinovou léčbu (i v kombinaci s antidiabetiky) včas.
Prospektivní čtyřletá multicentrická randomizovaná klinická studie ADOPT (A Diabetes Outcome Progression Trial) sledovala u pacientů s nově diagnostikovaným diabetem 2. typu účinnost glibenklamidu, rosiglitazonu a metforminu v monoterapii [12]. Kumulativní selhání monoterapie bylo zaznamenáno u 34 % pacientů léčených glibenklamidem (vs. 15 % u pacientů léčených rosiglitazonem a u 21% u pacientů léčených metforminem). Ve srovnání s rosiglitazonem se zvýšilo riziko selhání monoterapie při léčbě glibenklamidem o 64 %, progrese zvyšování glykovaného hemoglobinu a riziko hypoglykémií byly při léčbě glibenklamidem největší. Efekt na zlepšení funkce β-buněk je nejvyšší při léčbě glibenklamidem, je však u všech tří antidiabetik pouze přechodný, po pěti letech se funkce β-buněk vrací k původnímu stavu. Již dlouho je známo, že zvyšování středních dávek SU-PAD glykémii dále nesníží. Praktickou aplikací výsledků studie je včasná kombinace jednotlivých skupin perorálních antidiabetik, nikoli dlouhodobá léčba maximálními dávkami, a přidání dalšího perorálního antidiabetika až po delší době špatné kompenzace (tedy vyšší hladiny glykovaného hemoglobinu). S praktickými zkušenostmi příliš nekoresponduje tvrzení [13], že přidání SU-PAD k metforminu stav účinně nezlepší, protože efekt do šesti měsíců selže. Podle jiné práce se ale kompenzace u pacientů léčených inzulinem v kombinaci se SU-PAD zhorší po ukončení léčby SU-PAD [14].
Účinnost v kombinaci s jinými perorálními antidiabetiky
V současné době je jednoznačně preferována včasná kombinace dostupných antidiabetik. Metformin a SU-PAD mají aditivní účinek na snižování glykémie. Metformin zlepšuje hlavně lačné glykémie a snižuje inzulinovou rezistenci, SU-PAD stimulují sekreci inzulinu a snižují hlavně postprandiální glykémii. Metformin tlumí zvyšování hmotnosti, které provází léčbu SU-PAD, ale výskyt hypoglykémie se při kombinační léčbě ve srovnání s monoterapií metforminem může zvýšit. U diabetiků 2. typu, kteří nebyli uspokojivě kompenzováni při podávání metforminu, vedla léčba kombinací glimepirid/metformin k lepší kontrole glykémií a glykovaného hemoglobinu ve srovnání s monoterapií těmito léčivy. Kombinační léčba byla rovněž spojena s významnějším poklesem koncentrace celkového cholesterolu [15].
V poslední době je publikována řada prací upozorňujících na výhody včasného podávání kombinace SU-PAD a thiazolidindionů, která využívá odlišných mechanismů účinku (SU-PAD – stimulační účinek na β-buňku, thiazolidindiony – inzulin-senzitizující účinek). Rosenstock potvrzuje ve dvou randomizovaných zaslepených studiích kontrolovaných placebem signifikantní snížení glykémie nalačno a snížení hladiny glykovaného hemoglobinu (o 0,63–1,17 %) léčbou kombinací glimepirid/rosiglitazon i příznivý efekt na inzulinovou senzitivitu, funkci β-buněk a markery kardiovaskulárního rizika [16]. Podobně dobré klinické zkušenosti jsou i s kombinací glimepirid/pioglitazon, a to jak ve zlepšení kompenzace glykémií, tak i neglykemických efektů, snášenlivosti a vlivu na cévy [17].
Fixní kombinace
Polypragmazii lze v některých případech předejít použitím fixní kombinace. V ČR jsou k dispozici fixní kombinace glibenklamidu (2,5 mg nebo 5 mg) s metforminem (400 nebo 500 mg) [18]. Fixní kombinace glipizid/metformin není na našem trhu dostupná. Kombinovaný preparát lze dále kombinovat s rosiglitazonem nebo pioglitazonem.
Při podávání fixní kombinace glibenklamid/metformin je vrchol koncentrace glibenklamidu v krvi časnější (za 1–3 hod.) oproti léčbě glibenklamidem v monoterapii (za 4–8 hod.) a závisí na požitém jídle. To je způsobeno vysokým podílem malých částic glibenklamidu v kombinované tabletě. Pacienti by měli léčbu zahajovat nejnižšími dávkami (1,25 mg glibenklamidu/250 mg metforminu), případně 2,5 mg glibenklamidu/400 mg nebo 500 mg metforminu. Jestliže koncentrace glykovaného hemoglobinu dosahuje více než 7 % (dle studie DCCT), popřípadě více než 5 % (dle IFCC – International Federation of Clinical Chemistry), je obvykle doporučeno stejnou dávku podat dvakrát denně. Při hodnotách glykovaného hemoglobinu vyšších než 6 % by se mělo začít s podáváním jedné silnější tablety ráno, dále titrovat dávku na dvakrát denně jednu tabletu (ráno a večer) a postupovat podobně až do maximální denní dávky 10 mg glibenklamidu/2000 mg metforminu, rozdělené do dvou denních dávek. Nedoporučuje se zahajovat léčbu silnějším dávkováním (5 mg/500 mg) kvůli riziku hypoglykémie. Jestliže pacient již užívá maximální dávku metforminu nebo glibenklamidu, pak je vhodné zahájit kombinovanou terapii dávkou nižší. Například pacient s nedostatečnou kompenzací 2000 mg metforminu by mohl zahájit léčbu kombinací 2,5 mg/500 mg dvakrát denně. Maximální doporučená dávka je 10 mg/2000 mg, při kombinační léčbě je povolena dávka 20 mg/2000 mg.
Přímé srovnání jednotlivých SU-PAD
Randomizovaným dvojitě zaslepeným způsobem byla v podmínkách běžné praxe srovnávána léčba gliklazidem s řízeným uvolňováním (30–120 mg denně) a glimepiridem (1–6 mg denně). Studie trvala 27 týdnů a zahrnula 845 diabetiků 2. typu. SU-PAD byla podávána buď jako monoterapie, nebo v kombinaci se stávající léčbou (metforminem nebo inhibitorem a-glikosidázy). Obě SU-PAD byla stejně účinná, gliklazid s řízeným uvolňováním se v této studii ukázal jako bezpečnější. Při léčbě gliklazidem byl zaznamenán nižší výskyt hypoglykémií < 3 mmol/l oproti terapii glimepiridem (3,7 % vs. 8,9 %, p = 0,003) [19].
Ovlivnění hmotnosti
Zvyšování hmotnosti je nejen v léčbě diabetu nežádoucí efekt. Nepochybně souvisí s jasnou vazbou zvýšeného rizika klinických abnormalit, sdružovaných dnes pod pojem metabolický syndrom, a s klinickou manifestací důsledků metabolického syndromu, aterosklerózy a dalších onemocnění (například nádory, deprese).
SU-PAD jsou považována za léčiva s rizikem zvyšování hmotnosti. Obezita, především viscerálního typu, je jedním z diagnostických kritérií metabolického syndromu. I v nových doporučeních pro léčbu diabetu 2. typu [20] jsou v souvislosti s výběrem antidiabetika do kombinace s metforminem popsána SU-PAD jako levná potentní léčiva, snižující koncentraci glykovaného hemoglobinu v průměru o 1,5 %, ale s nevýhodou zvyšování hmotnosti a rizika hypoglykémie. Ve studii UKPDS byl nejvyšší vzestup hmotnosti popsán při podávání inzulinu (4 kg), dále při podávání chlorpropamidu (2,6 kg) a glibenklamidu (1,7 kg). U moderních SU-PAD (glimepirid, glipizid, gliklazid) je však riziko i výskyt hypoglykémie a tedy přírůstku hmotnosti malý. Snášenlivost a bezpečnost metforminu, pioglitazonu a gliklazidu byla analyzována během jednoho roku u 3700 diabetiků 2. typu [21]. Pouze 6 % pacientů bylo vyřazeno pro výskyt vedlejších účinků, v případě léčby metforminem pro gastrointestinální symptomy, v případě podávání pioglitazonu pro otoky, u gliklazidu pro hypoglykémii. Kardiovaskulární riziko bylo u všech léčiv srovnatelné. Skupina pacientů s metforminem zredukovala hmotnost, při léčbě pioglitazonem a gliklazidem došlo k jejímu zvýšení.
Multicentrická retrospektivní studie srovnávala změny hmotnosti při dvanáctiměsíční léčbě glimepiridem a glibenklamidem u 520 diabetiků 2. typu v rutinní klinické praxi [22]. Průměrný pokles hmotnosti (-2,04 6 3,99 kg vs. -0,58 6 3,65 kg, p < 0,001) a BMI (-0,71 6 1,38 kg/m2 vs. -0,20 6 1,28 kg/m2, p < 0,001) byl statisticky významně větší u glimepiridu než u glibenklamidu. Glimepirid i glibenklamid snížily glykémii nalačno (-2,43 6 0,24 mmol/l vs. -3,03 6 0,24 mmol/l; p < 0,001) a koncentraci glykovaného hemoglobinu (-1,23 6 0,09 % vs. -1,26 6 0,09 %; p < 0,001). V obou skupinách došlo také k poklesu koncentrace celkového cholesterolu a LDL cholesterolu. Hladina triglyceridů byla nižší při léčbě glibenklamidem a hladina HDL cholesterolu se zvýšila jen při podávání glimepiridu. Při stejném efektu na kompenzaci glykémie byla tedy léčba glimepiridem spojena se snížením hmotnosti.
Riziko hypoglykémie
Hypoglykémie je nejzávažnějším nežádoucím účinkem a může se objevit kdykoli v průběhu léčby. Není sice častá, je však prolongovanější a v důsledcích nebezpečnější než hypoglykémie po podávání inzulinu. Nejvyšší riziko hypoglykémie provází léčbu glibenklamidem, jehož absorpce i vylučování jsou pomalé a jehož některé metabolity jsou slabě aktivní. Souvislost účinku léčiva a hypoglykémie je v menší míře dokladována u glipizidu, ještě méně u gliklazidu a nejméně u tolbutamidu. Hypoglykémie se vyskytuje častěji na začátku léčby, zejména podáváme-li vysoké dávky. I to je důvod k doporučovaným nízkým počátečním dávkám. Pravděpodobnost hypoglykémie stoupá s vyšším věkem, dále ji zvyšuje menší příjem potravy, porucha funkce ledvin a jater a a kardiovaskulární onemocnění. Starší polymorbidní pacienti užívají také často další léčiva, která mohou hypoglykemizující účinek zvyšovat (např. nesteroidní antirevmatika, fibráty, allopurinol, β-blokátory).
Největší pozornost, pokud jde o možný výskyt hypoglykémie, vyžaduje tedy léčba glibenklamidem, zejména u pacientů s poškozením renálních funkcí nebo u starších diabetiků. K vyšetření hypoglykemických účinků byl u 52 diabetiků průměrného věku 65,1 let sledován v prospektivní, randomizované, dvojitě zaslepené studii efekt glibenklamidu a glipizidu v maximální jedné denní dávce po 23 hodinách lačnění [23]. Tito starší diabetici snášeli lačnění velmi dobře. Vyšší věk by tak neměl být automaticky považován za kontraindikaci léčby SU-PAD. Zdá se, že stimulace sekrece adrenalinu je u těchto pacientů ochranným mechanismem proti hypoglykémii. Rovněž klinická praxe potvrzuje, že riziko hypoglykémie spojené s novějšími deriváty (glimepirid, gliklazid) je nízké.
Kardiovaskulární riziko
Účinky SU-PAD na kardiovaskulární systém nejsou stále zcela vyjasněny. SU-PAD blokují draslíkové kanály, účinky v myokardu se u jednotlivých zástupců liší. Glimepirid a gliklazid mají například k draslíkovým kanálům v myokardu slabší vazbu než glibenklamid. Z experimentů vyplývá, že by SU-PAD mohly zhoršovat ischemické/reperfuzní poškození myokardu. Na druhou stranu ale existují experimentální práce, které prokazují snížení výskytu ischemické fibrilace komor. Klinický význam tento účinek však pravděpodobně nemá, jak dokládají výsledky velkých klinických studií.
Možný vliv na zvýšení incidence náhlé smrti u diabetiků 2. typu léčených tolbutamidem byl jedním ze závěrů UGDP (The University Group Diabetes Program). Tato multicentrická studie byla provedena v USA koncem šedesátých let minulého století. Měla testovat hypotézu, že perorální antidiabetika nebo inzulin by mohly snížením hyperglykémie snížit vaskulární morbiditu a mortalitu u asymptomatických diabetiků nezávislých na inzulinu. Podávání tolbutamidu bylo ale spojeno s neočekávaným zvýšením kardiovaskulární mortality a inzulin ve srovnání s placebem neovlivnil příznivě morbiditu a mortalitu. Studie měla však určité metodické nedostatky (byla například kritizována výběrová kritéria, způsob randomizace, sbíraná data, compliance zařazených pacientů), a tak nejsou všechny její závěry považovány za validní. Navíc v posledních více než dvaceti letech nebyly tyto výsledky klinicky potvrzeny.
Ve studii UKPDS nebyl během jedenácti let zaznamenán zvýšený výskyt makrovaskulárních komplikací ve skupině léčené SU-PAD. Jiná analýza velké skupiny diabetiků s akutním infarktem myokardu ukázala nižší mortalitu těch pacientů, kteří užívali před infarktem SU-PAD [24]. Retrospektivně byl také analyzován průběh akutní mozkové mrtvice u 198 hospitalizovaných diabetiků. U pacientů léčených před příhodou glibenklamidem, glimepiridem nebo glibornuridem byl průběh příznivější než u pacientů bez léčby SU-PAD [25].
Dlouhodobá multicentrická prospektivní studie ADVANCE (Action in Diabetes and Vascular disease) zkoumá dlouhodobou kardiovaskulární prognózu u nemocných diabetem 2. typu léčených gliklazidem a perindoprilem. Zahrnuje víc než 11 000 rizikových pacientů z celého světa a dosud probíhá. Prvotním cílem je zjištění nefatálních cévních mozkových příhod a srdečních infarktů, všech úmrtí z kardiovaskulárních příčin a nových nebo zásadně zhoršených retinopatií a nefropatií.
Nežádoucí účinky
S obecnými nežádoucími účinky léčby používanými SU-PAD se setkáváme jen zřídka (≤ 3 % léčených diabetiků). Projeví se zpravidla do dvou měsíců po zahájení terapie. Patří mezi ně kožní projevy (purpura, fotosenzitivita, pruritus, erythema nodosum, exfoliativní dermatitida), gastrointestinální nesnášenlivost (nauzea, zvracení), poruchy krvetvorby (agranulocytóza, trombocytopenie, dřeňová aplazie), granulomatózní hepatitida, cholestáza, retence vody nebo vazomotorické projevy (tachykardie, bolesti hlavy). Jak již bylo uvedeno, pacienti mají sklon přibývat na hmotnosti, protože SU-PAD podporují vylučování inzulinu. Neplatí to však u novějších léčiv, při podávání glimepiridu bylo naopak pozorováno snížení hmotnosti. To jistě souvisí se správnou strategií léčby, s compliance pacienta i s mechanismem účinku moderních SU-PAD, u kterých je velmi nízké riziko hypoglykémie.
Interakce
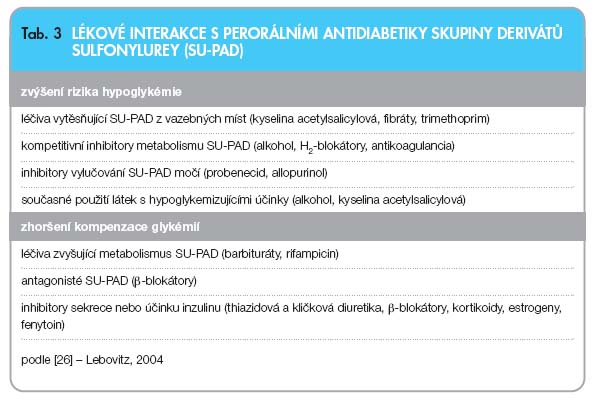 Řada běžně používaných léčiv může zvýšit účinek SU-PAD, a tím i riziko hypoglykémie, nebo naopak zhoršit kompenzaci glykémií (tab. 3). Alkohol a kyselina acetylsalicylová mohou způsobit těžkou protrahovanou hypoglykémii, β-blokátory interferují jak s rozpoznáním, tak i s kontraregulací hypoglykémie. Antikoagluancia jsou kompetitivní inhibitory metabolismu SU-PAD a při společném podávání by měly být redukovány dávky obou léčiv. Riziko klinicky významných interakcí je však při léčbě současnými SU-PAD relativně nízké.
Řada běžně používaných léčiv může zvýšit účinek SU-PAD, a tím i riziko hypoglykémie, nebo naopak zhoršit kompenzaci glykémií (tab. 3). Alkohol a kyselina acetylsalicylová mohou způsobit těžkou protrahovanou hypoglykémii, β-blokátory interferují jak s rozpoznáním, tak i s kontraregulací hypoglykémie. Antikoagluancia jsou kompetitivní inhibitory metabolismu SU-PAD a při společném podávání by měly být redukovány dávky obou léčiv. Riziko klinicky významných interakcí je však při léčbě současnými SU-PAD relativně nízké.
Léčebná strategie
Rok 2008 je charakterizován nejen nástupem nových skupin antidiabetik, ale i určitým posunem v algoritmu léčby diabetu 2. typu. Dnes již by žádný diabetik neměl být léčen pouze dietou a léčba antidiabetiky by měla být zahájena bezprostředně po stanovení diagnózy diabetu.
SU-PAD jsou alternativou u pacientů, u nichž je kontraindikována terapie metforminem hned při stanovení diagnózy diabetu a jako antidiabetika ke kombinační léčbě. SU-PAD se kombinují s metforminem tehdy, jestliže metforminem samotným nelze docílit optimální kompenzace (tedy glykovaný hemoglobin < 5 %). Slibná je také kombinace SU-PAD a rosiglitazonu, která kromě účinného snížení glykémie vykazuje také další významné efekty. Výhodou SU-PAD jsou nepochybně dlouhodobé dobré klinické zkušenosti a nízké náklady na léčbu. Nevýhodou je zvýšení hmotnosti a riziko hypoglykémie, které jsou ale u novějších zástupců nízké.
Seznam použité literatury
- [1] Siluk D, Kaliszan R, Haber P, et al. Antiaggregatory activity of hypoglycaemic sulphonylureas. Diabetologia 2002; 45: 1034–1037.
- [2] Qi R, Ozaki Y, Satoh K, et al. Sulphonylurea agents inhibit platelet aggregation and [Ca2+]i elevation induced by arachidonic acid. Biochem Pharmacol 1995; 49: 1735–1739.
- [3] Jennings PE, Scott NA, Saniabadi AR, Belch JJ. Effects of gliclazide on platelet reactivity and free radicals in type II diabetic patients: clinical assessment. Metabolism 1992; 41(5 Suppl. 1): 36–39.
- [4] Shakuto S, Oshima K, Tsuchiya E. Glimepiride exhibits prophylactic effect on atherosclerosis in cholesterol-fed rabbits. Atherosclerosis 182; 2005: 209–217.
- [5] Katakami N, Katakami Y, Hayaishi-Okano R, et al. Metformin or gliclazide, rather than glibenclamid, attenuate progression of carotid intima-media thickness in subjects with type 2 diabetes. Diabetologia 2004; 47: 1906–1913.
- [6] Danchin, Charpentier G, Ledru F, et al. Role of previous treatment with sulfonylureas in diabetic patients with acute myocardial infarction: result from a nationwide French registry. Diab Met Res Rev 2005; 21: 143–149.
- [7] Johnsen SP, Monster TBM, Olsen ML, et al. Risk and short term prognosis of myocardial infarction among users of antidiabetic drugs. Am J Ther 2006; 13: 134–137.
- [8] Šmahelová A. Sulfonylureová antidiabetika. In Perušičová J (ed.). Perorální antidiabetika, Praha, Galén 2003: 37–74.
- [9] Rambiritch V, Naidoo P, Butkow N. Dose-response relationships of sulfonylureas: will doubling the dose double the response? South Med J 2007; 100: 1072–1073.
- [10] Matthews DR, Cull CA, Stratton IM, et al. UKPDS 26: Sulphonylurea failure in non-insulin-dependent diabetic patients over six years. UK Prospective Diabetes Study (UKPDS) Group. Diabet Med 1998; 15: 297–303.
- [11] Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998; 352: 831–853.
- [12] Kahn SE, Haffner SM, Heise MA, et al.; ADOPT Study Group. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N Engl J Med 2006; 355: 2427–2443.
- [13] Cook MN, Girman CJ, Stein PP, et al. Glycemic control continues to deteriorate after sulfonylureas are added to metformin among patients with type 2 diabetes. Diabetes Care 2005; 28: 995–1000.
- [14] Nybäck-Nakell A, Adamson U, Lins PE, Landstedt-Hallin L. Glycaemic responsiveness to long-term insulin plus sulphonylurea therapy as assessed by sulphonylurea withdrawal. Diabet Med 2007; 24: 1424–1429.
- [15] Charpentier G, Fleury F, Kabir M, et al. Improved glycaemic control by addition of glimepiride to metformin monotherapy in type 2 diabetic patients. Diabet Med 2001; 18: 828–834.
- [16] Rosenstock J, Chou H, Matthaei S, et al. Potential benefits of early addition of rosiglitazone in combination with glimepiride in the treatment of type 2 diabetes. Diabetes Obes Metab 2008 (Epub ahead of print).
- [17] Dorkhan M, Fried A. A review of pioglitazone HCL and glimepiride in the treatment of type 2 diabetes. Vasc Health Risk Manag 2007; 3: 721–731.
- [18] Šmahelová A. Metformin. In: Trendy v diabetologii 12; Praha, Galén 2008 (v tisku).
- [19] Schernthaner G, Grimaldi A, Di Mario U, et al. GUIDE study: double-blind comparison of once-daily gliclazide MR and glimepiride in type 2 diabetic patients. Eur J Clin Invest 2004; 34: 535–542.
- [20] Nathan DM, Buse JB, Davidson MB, et al. Management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: update regarding thiazolidinediones: a consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabet Care 2008; 31: 173–175.
- [21] Belcher G, Lambert C, Edwards G, et al. Safety and tolerability of pioglitazone, metformin, and gliclazide in the treatment of type 2 diabetes. Diabetes Res Clin Pract 2005; 70: 53–62.
- [22] Martin S, Kolb H, Beuth J, et al. Change in patients body weight after 12 months of treatment with glimepiride or glibenclamide in Type 2 diabetes: a multicentre retrospective cohort study. Diabetologia 2003; 46: 1611–1617.
- [23] Burge MR, Schmitz-Fiorentino K, Fischette C, et al. A prospective trial of risk factors for sulfonylurea-induced hypoglycemia in type 2 diabetes mellitus. JAMA 1998; 279: 137–143. Comment in: JAMA 1998; 279: 1441–1442; author reply in: JAMA 1998; 279: 1442–1443.
- [24] Dranchin N, et al. Role of previous treatment with sulfonylureas in diabetic patients with acute myocardial infarction: results from a nationwide French registry. Diabetes Metab Res Rev 2005; 21: 143–149.
- [25] Kunte H, Schmidt S, Eliasziw M, et al. Sulfonylureas improve outcome in patients with type 2 diabetes and acute ischemic stroke. Stroke 2007; 38: 2413–2414.
- [26] Lebovitz HE. Therapy for Diabetes mellitus and related disorders. Fourth ed. American Diabetes Association, Alexandria, Virginia 2004, s. 543.