Pokročilý karcinom prostaty, možnosti léčebného ovlivnění
Pokročilý karcinom prostaty představuje značně heterogenní skupinu onemocnění. Ruku v ruce s šíří celé skupiny jde stejně pestrá paleta léčebných modalit, které umožňují individualizaci léčby pro konkrétního pacienta. Názor a volba poučeného pacienta při rozhodování o typu léčby jsou stejně důležité jako náš předpoklad o biologickém chování nádoru, pravděpodobné délce života pacienta či rozsahu onemocnění. Množství klinických studií se snaží zodpovědět, kdy a jak pacienta léčit, přesto stále nepřevažuje jednotný názor v mnoha otázkách. Významným zlomem bylo rozšíření léčebných možností o cytotoxické režimy, především u pacientů s hormonálně independentním karcinomem prostaty (HICaP). Stále častěji bývají tyto režimy v klinických studiích přesouvány do adjuvantního podání u vysokorizikových pacientů po radikální chirurgické léčbě. Rozšíření léčebné palety o bisfosfonáty u nemocných bez metastatického postižení zlepšuje nejen protinádorovou odpověď, ale jejich preventivní působení zvyšuje kvalitu života. S kvalitou života souvisí i zařazování biologické léčby u pacientů s HICaP. Obdobně jako v ostatních oblastech farmakoterapie onkologicky nemocných, i léčebné možnosti pacientů s karcinomem prostaty se významně rozšiřují, a to jak zařazením nových přípravků, tak i novými léčebnými režimy.
Karcinom prostaty je druhým nejčastějším onkologickým onemocněním u mužů v Evropě. V roce 2008 bylo zjištěno 2,6 milionu nových případů. Proto této diagnóze věnují globální média tak velkou pozornost (BBC). Karcinom prostaty byl příčinou úmrtí i známých osobností (FrancŁois Mitterrand, u nás Pavel Novák). Incidence v ČR v roce 2005 dosáhla 97,9/100 000 obyvatel [1] a prevalence v roce 2009 byla kolem 27 tisíc mužů [2].
Podle dat ÚZIS je i v České republice zřejmý posun diagnostiky karcinomu k časným fázím onemocnění. V době diagnózy převažují nemocní s lokalizovanou formou onemocnění, tedy stadia I a II. Tento zřetelný trend je nepochybně dán aktivní snahou urologů o časnou diagnózu. Osvětové a „preventivní“ akce přivádějí do urologických ordinací muže ve věkových skupinách a ve zdravotní kondici, kdy je snaha o časné stanovení diagnózy smysluplná. I když zavedené stanovování prostatického specifického antigenu (PSA), mnohdy i u neinformovaných nemocných, se stalo prakticky rutinou, nikdy nemůže nahradit pečlivé 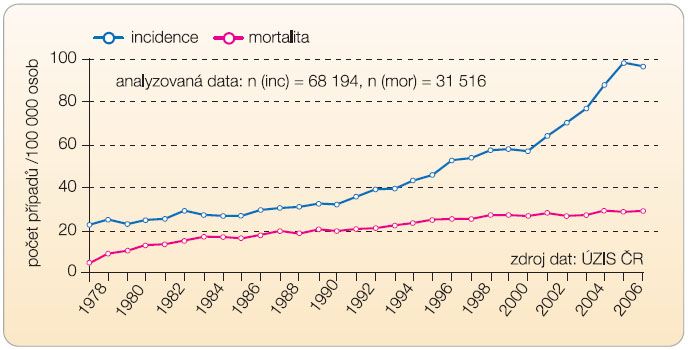 sledování urologem. Ostatně bez bioptického ověření není možné diagnózu karcinomu prostaty bezpečně stanovit a pouhý vzestup PSA nekoreluje s diagnózou zhoubného nádoru prostaty. Stálý nárůst incidence a téměř stabilní mortalita (graf 1) vyvolávají odborné diskuse zaměřené na skutečnost, jak výstižný je histologický odhad maligního náboje karcinomu a jak adekvátní je naše léčba. Zhoubné nádory prostaty se tak řadí ke globálním problémům mužské populace.
sledování urologem. Ostatně bez bioptického ověření není možné diagnózu karcinomu prostaty bezpečně stanovit a pouhý vzestup PSA nekoreluje s diagnózou zhoubného nádoru prostaty. Stálý nárůst incidence a téměř stabilní mortalita (graf 1) vyvolávají odborné diskuse zaměřené na skutečnost, jak výstižný je histologický odhad maligního náboje karcinomu a jak adekvátní je naše léčba. Zhoubné nádory prostaty se tak řadí ke globálním problémům mužské populace.
Postupně se mění náhled na pokročilý karcinom prostaty. Zatímco ještě před desetiletím bychom za lokálně pokročilý hodnotili tumor cT3-4 N0-1 M0(x), eventuálně M1b s minimálním kostním postižením, dnes do skupiny patří i pacienti s biochemickým relapsem po radikální léčbě [3], a navíc i pacienti s vysokorizikovými faktory po radikální chirurgické léčbě. Skupina se tak stává velice širokou, s rozdílným přístupem k léčbě. Pro velkou část nemocných představuje multimodální léčba výrazné prodloužení přežití při dobré kvalitě života. Ovšem i prognóza pacientů s primárně generalizovaným onemocněním se mírně zlepšuje.
Úměrně s rozšířením celé skupiny je stále větší důraz kladen na individualizaci léčby. U každého pacienta si pak klademe otázku, zda vůbec léčit, jaký typ léčby použít a kdy s aplikací léčby začít. Watchful waiting (WW) neboli metoda pečlivého sledování spočívá v pravidelném tříměsíčním klinickém a laboratorním sledování (PSA, PSA-DT – doba zdvojení PSA) a ve vyšetření příslušnými zobrazovacími metodami podle doporučených postupů. Z dnešního pohledu je vhodnou modalitou pro muže s lokalizovaným či lokálně pokročilým karcinomem, u kterých je předpokládaná doba života kratší 15 let či Gleasonovo skóre (GS) z bioptického materiálu 6 a méně. Především je však třeba přihlížet k preferencím poučeného pacienta. U pacientů s lokalizovaným karcinomem prostaty je signálem k zahájení léčby PSA-DT kratší než 2 roky a zvýšení Gleasonova skóre v rebiopsii [4]. U pacientů s pokročilým karcinomem rebiopsie neprovádíme.
Hormonální léčba
V době diagnózy bývá více než 80 % všech karcinomů prostaty citlivých na endokrinní manipulaci. Jejím principem je blokování produkce či eliminace vlivu androgenů. Blokádou androgenních receptorů navodíme apoptózu androgen dependentních buněk. Léčba karcinomu prostaty orchiektomií znamenala začátek hormonální terapie a pozorování efektu kastrace u diseminovaného karcinomu prostaty (CaP) [5] přineslo Hugginsovi a Hodgesovi v roce 1966 Nobelovu cenu.
Princip hormonální terapie vychází z poznatků o přímé závislosti růstu rakovinných buněk prostaty na hladině testosteronu. Při snížení hodnot testosteronu pod kritickou mez (tzv. kastrační hodnoty testosteronu) se růst nádorových buněk zpomaluje, případně se může zcela zastavit. Základním stimulem replikace prostatické buňky je testosteron, androgen produkovaný Leydigovými buňkami varlete. Produkce testosteronu je řízena hypotalamo-hypofyzárně-testikulární osou prostřednictvím gonadotropin releasing hormonů (GnRH, gonadorelin, LHRH – hormon uvolňující LH), následně lutropinem (LH) s folikuly stimulujícím 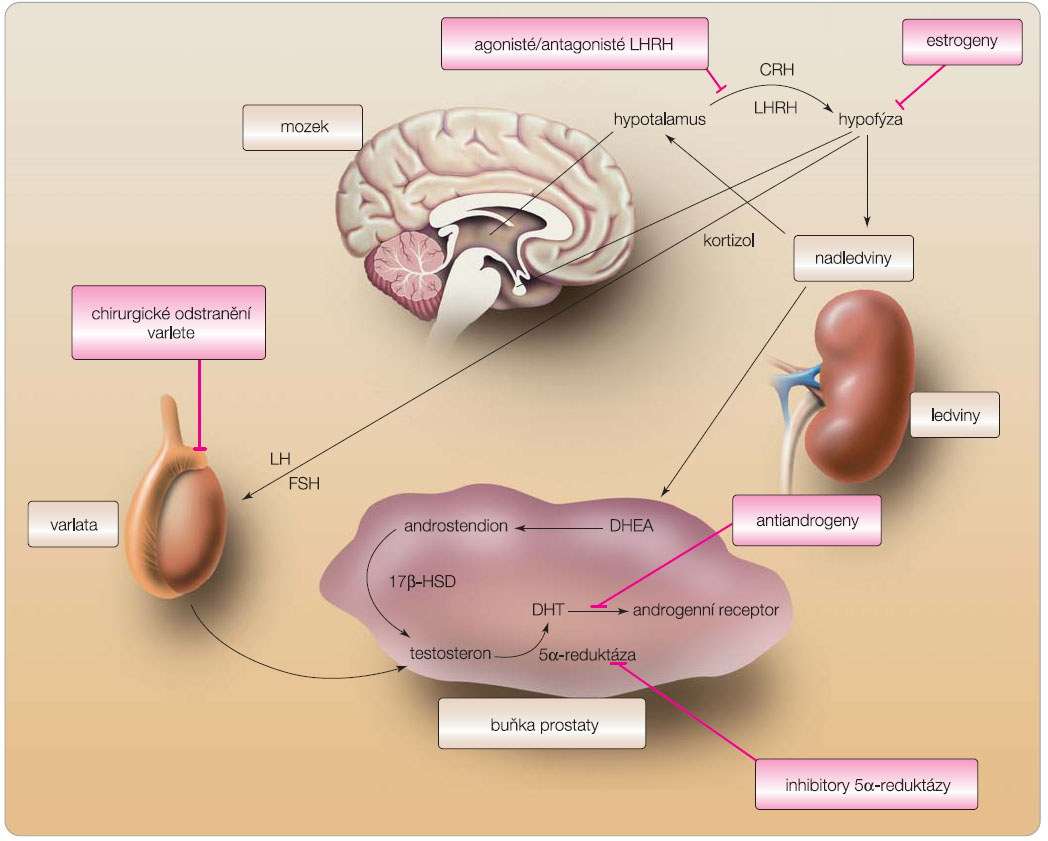 hormonem (FSH) a zpětnovazebnými mechanismy (obr. 1). Testikulární produkce přesahuje 92 %, cca 5 % testosteronu pochází z kůry nadledvin a asi 2 % vznikají periferní konverzí v tukové tkáni z estradiolu. Vlastním účinným androgenem je dihydrotestosteron (DHT) konvertovaný enzymem 5a-reduktázou z testosteronu v prostatické buňce. 5a-reduktáza existuje ve dvou izomerech, především typ II dosahuje vysoké koncentrace v prostatě, kůži i tukové tkáni. DHT vazbou na specifické androgenní receptory (AR) vytváří komplex DHT-AR a spouští kaskádu proteosyntézy a replikace buňky. Cíleným zásahem na jednom nebo několika místech bráníme buněčné replikaci a navodíme apoptózu citlivých nádorových buněk.
hormonem (FSH) a zpětnovazebnými mechanismy (obr. 1). Testikulární produkce přesahuje 92 %, cca 5 % testosteronu pochází z kůry nadledvin a asi 2 % vznikají periferní konverzí v tukové tkáni z estradiolu. Vlastním účinným androgenem je dihydrotestosteron (DHT) konvertovaný enzymem 5a-reduktázou z testosteronu v prostatické buňce. 5a-reduktáza existuje ve dvou izomerech, především typ II dosahuje vysoké koncentrace v prostatě, kůži i tukové tkáni. DHT vazbou na specifické androgenní receptory (AR) vytváří komplex DHT-AR a spouští kaskádu proteosyntézy a replikace buňky. Cíleným zásahem na jednom nebo několika místech bráníme buněčné replikaci a navodíme apoptózu citlivých nádorových buněk.
Endokrinní manipulací navodíme různě dlouhou léčebnou odpověď. U generalizovaného onemocnění se medián léčebné odpovědi pohybuje mezi 12–18 měsíci, medián průměrného přežití při relapsu je 6–12 měsíců. Androgenní suprese vede po několika hodinách k degenerativním změnám cév snížením exprese vaskulárního endoteliálního růstového faktoru (VEGF) v epiteliálních a stromálních buňkách prostaty. Tím dochází k hypoxii tkání, především sekrečních epiteliálních buněk. Netknuty pak zůstávají bazální epiteliální buňky. Na zachování homeostázy prostatické buňky se podílí řada dalších faktorů i signálních cest. Propojením aktivní signální cesty AR s dalšími kaskádami (např. působením růstových faktorů – GF) je na molekulární úrovni vysvětlována nádorová progrese androgen independentních linií. Endokrinní terapie vede k selekci buněk nezávislých na hormonální manipulaci a převahu získávají hormonálně independentní klony buněk. Tak dochází ke ztrátě odpovědi na hormonální léčbu.
Možnosti hormonální léčby
Dramatického poklesu hladin testosteronu je možné dosáhnout cestou chirurgickou nebo farmakologickou. Zlatým standardem hormonální léčby karcinomu prostaty byla po dlouhá léta bilaterální orchiektomie. Orchiektomie navodí kastrační hladiny testosteronu během 3–12 hodin po operaci a klinickou odpověď můžeme očekávat již za 24 hodin u symptomatických nemocných s generalizací. Absolutní indikací k provedení orchiektomie nemocnému s generalizovaným CaP je hrozící léze míšní. Obvykle ji dále volíme u nemocných, kde je zřejmá obtížnější kooperace a nízká compliance při farmakoterapii, nebo při preferenci pacienta. Nevýhodou je ireverzibilita výkonu a velká část pacientů, ale i zdravotníků považuje orchiektomii za mutilující a psychicky deprivující [6]. V klinické praxi bývá provedena orchiektomie jako monoterapie, při selhání léčby je pak doplněna o antiandrogeny na maximální androgenní blokádu (MAB).
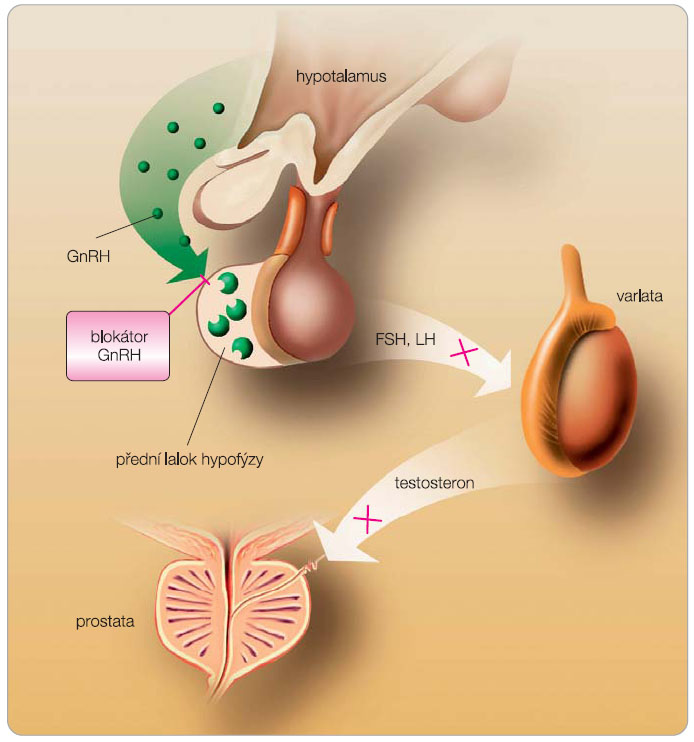 Druhou Nobelovou cenou v léčbě CaP byl v roce 1977 oceněn profesor Andrew Schally. Izoloval a popsal strukturu GnRH, který se podílí na řízení sekrece LH a FSH. Postupně pak byla syntetizována LHRH analoga (LHRH – hormon uvolňující LH, LH-releasing hormone, gonadorelin, GnRH). Od přirozeného dekapeptidu GnRH se liší změnou aminokyselin na pozici 6 a 10. Účinnost syntetických LHRH agonistů je významně vyšší než účinnost přirozeného LHRH. Za fyziologických okolností je LHRH hormon, který hypotalamus vylučuje do předního laloku hypofýzy. Zde se váže na receptor a stimuluje syntézu a sekreci luteinizačního hormonu (LH) a dalších působků. LH uvolněný do cirkulace stimuluje Leydigovy buňky ve varlatech, čímž se aktivuje mechanismus syntézy a uvolňování testosteronu (obr. 2). Aplikace LHRH analog vede přechodně ke zvýšenému uvolňování gonadotropních hormonů – tzv. flare-up fenomén. Po počáteční hyperstimulaci hypofýzy však dochází k útlumu tvorby gonadotropních hormonů. Ten je způsoben tzv. down-regulací receptorů pro LHRH, ke které dochází v důsledku trvalé stimulaci receptorů opakovaným podáváním LHRH analoga; a vysvětluje se vyčerpáním tvorby hormonu. V důsledku toho klesá množství cirkulujícího LH a následně klesá tvorba a uvolňování testosteronu. Kastračních hladin testosteronu dosáhneme kolem 21. dne po aplikaci. Především u pacientů s kostní generalizací může vést vzestup hladin testosteronu v rámci flare-up fenoménu ke zhoršení klinických obtíží. Proto u pacientů s kostním postižením přidáváme přechodně antiandrogeny po dobu 3–4 týdnů v úvodu léčby. U některých nemocných je možné zjistit tzv. miniflare-up fenomén po každé aplikaci LHRH analoga. Prodloužením dávkového intervalu a používáním depotních forem (tříměsíčních a delších) je možné tento nežádoucí efekt omezit.
Druhou Nobelovou cenou v léčbě CaP byl v roce 1977 oceněn profesor Andrew Schally. Izoloval a popsal strukturu GnRH, který se podílí na řízení sekrece LH a FSH. Postupně pak byla syntetizována LHRH analoga (LHRH – hormon uvolňující LH, LH-releasing hormone, gonadorelin, GnRH). Od přirozeného dekapeptidu GnRH se liší změnou aminokyselin na pozici 6 a 10. Účinnost syntetických LHRH agonistů je významně vyšší než účinnost přirozeného LHRH. Za fyziologických okolností je LHRH hormon, který hypotalamus vylučuje do předního laloku hypofýzy. Zde se váže na receptor a stimuluje syntézu a sekreci luteinizačního hormonu (LH) a dalších působků. LH uvolněný do cirkulace stimuluje Leydigovy buňky ve varlatech, čímž se aktivuje mechanismus syntézy a uvolňování testosteronu (obr. 2). Aplikace LHRH analog vede přechodně ke zvýšenému uvolňování gonadotropních hormonů – tzv. flare-up fenomén. Po počáteční hyperstimulaci hypofýzy však dochází k útlumu tvorby gonadotropních hormonů. Ten je způsoben tzv. down-regulací receptorů pro LHRH, ke které dochází v důsledku trvalé stimulaci receptorů opakovaným podáváním LHRH analoga; a vysvětluje se vyčerpáním tvorby hormonu. V důsledku toho klesá množství cirkulujícího LH a následně klesá tvorba a uvolňování testosteronu. Kastračních hladin testosteronu dosáhneme kolem 21. dne po aplikaci. Především u pacientů s kostní generalizací může vést vzestup hladin testosteronu v rámci flare-up fenoménu ke zhoršení klinických obtíží. Proto u pacientů s kostním postižením přidáváme přechodně antiandrogeny po dobu 3–4 týdnů v úvodu léčby. U některých nemocných je možné zjistit tzv. miniflare-up fenomén po každé aplikaci LHRH analoga. Prodloužením dávkového intervalu a používáním depotních forem (tříměsíčních a delších) je možné tento nežádoucí efekt omezit.
Řada klinických studií dokládá srovnatelnou účinnost LHRH analog a bilaterální orchiektomie. Aplikace LHRH analog bývá označována jako chemická kastrace. Přímá (head to head) srovnání jednotlivých LHRH analog se provádějí jen zřídka. Kritériem bývá nejen klinická a biochemická odpověď, ale právě schopnost dosažení a udržení kastračních hladin testosteronu. Ve schopnosti dlouhodobého dosažení kastrační hladiny testosteronu, výskytu „miniflare“ fenoménu a četnosti výskytu „breakthrough“ jsou mezi přípravky rozdíly. Stejně tak jsou i rozdíly ve schopnosti normalizace PSA jako ukazatele léčebné odpovědi.
![Graf 2 Celkové přežití pacientů léčených hormonální terapií v závislosti na hladinách testosteronu v plazmě; podle [9] – Morote, et al., 2007.](https://www.remedia.cz/photo-a-27849---.jpg) Původně byly kastrační hodnoty definovány jako 50 ng/dl, tedy 1,7 mmol/l. Tato hodnota je zlomkem fyziologických hladin. Přesto při použití citlivějších metod je v moderním písemnictví jako kastrační označována hladina 20 ng/dl, tedy 0,7 mmol/l. Jako příklad se uvádí práce Oefeleina [7], který u pacientů po orchiektomii shledal medián hodnot testosteronu 15 ng/dl. Celkové přežití je signifikantně delší u pacientů s hladinami testosteronu nižšími než 0,7 mmol/l proti hladinám v rozmezí 0,7–1,7 a vyšším, viz graf 2 [8, 9]. Ne u všech léčených se podaří dosáhnout poklesu pod 1,7 mmol/l (2–12 %), pokud však použijeme přísnější kritéria, pohybuje se tento neúspěch v rozmezí 13–44 % [10–12].
Původně byly kastrační hodnoty definovány jako 50 ng/dl, tedy 1,7 mmol/l. Tato hodnota je zlomkem fyziologických hladin. Přesto při použití citlivějších metod je v moderním písemnictví jako kastrační označována hladina 20 ng/dl, tedy 0,7 mmol/l. Jako příklad se uvádí práce Oefeleina [7], který u pacientů po orchiektomii shledal medián hodnot testosteronu 15 ng/dl. Celkové přežití je signifikantně delší u pacientů s hladinami testosteronu nižšími než 0,7 mmol/l proti hladinám v rozmezí 0,7–1,7 a vyšším, viz graf 2 [8, 9]. Ne u všech léčených se podaří dosáhnout poklesu pod 1,7 mmol/l (2–12 %), pokud však použijeme přísnější kritéria, pohybuje se tento neúspěch v rozmezí 13–44 % [10–12].
![Graf 3 Změna hladiny sérového prostatického specifického antigenu (PSA) během prvních dvou měsíců léčby degarelixem a leuprorelinem. 11 % pacientů léčených leuprorelinem dostávalo bikalutamid jako prevenci flare-up fenoménu; podle [15] – Klotz, et al., 2008.](https://www.remedia.cz/photo-a-27850---.jpg) V současné době jsou na českém trhu dostupná tři LHRH analoga – goserelin, leuprorelin a triptorelin. Všechny přípravky jsou vhodné k léčbě metastatického karcinomu prostaty. Existující klinická data podporují užití goserelinu v adjuvanci a neoadjuvanci [13]. Adjuvantně k radioterapii lze použít i triptorelin [14]. Blokátory GnRH receptorů (antagonisté), které se vážou na GnRH receptor v hypofýze, jsou novým typem protinádorové endokrinní léčby. Blokují přirozený GnRH a znemožňují vzestup LH a FSH. Jejich podání vede k okamžitému poklesu hladin testosteronu. Kastračních
V současné době jsou na českém trhu dostupná tři LHRH analoga – goserelin, leuprorelin a triptorelin. Všechny přípravky jsou vhodné k léčbě metastatického karcinomu prostaty. Existující klinická data podporují užití goserelinu v adjuvanci a neoadjuvanci [13]. Adjuvantně k radioterapii lze použít i triptorelin [14]. Blokátory GnRH receptorů (antagonisté), které se vážou na GnRH receptor v hypofýze, jsou novým typem protinádorové endokrinní léčby. Blokují přirozený GnRH a znemožňují vzestup LH a FSH. Jejich podání vede k okamžitému poklesu hladin testosteronu. Kastračních ![Graf 4 Hladiny sérového testosteronu během prvního měsíce léčby degarelixem a leuprorelinem; podle [15] – Klotz, et al., 2008.](https://www.remedia.cz/photo-a-27851---.jpg) hladin je pomocí této léčby dosaženo výrazně rychleji ve srovnání s LHRH analogy. Přímé srovnání leuprorelinu a degarelixu dokládá vyšší odpověď při srovnání hladin PSA a ALP. Pokles hladin PSA je významně rychlejší po aplikaci degarelixu, viz graf 3 [15]. Významně rychlejší pokles při podání degarelixu je patrný u hladin testosteronu oproti LHRH analogům (graf 4) [15]. Farmakologický profil LHRH anatagonistů přináší výhody především pacientům s pokročilým onemocněním, symptomatickým, pacientům s vysokým rizikem progrese a agresivními formami CaP.
hladin je pomocí této léčby dosaženo výrazně rychleji ve srovnání s LHRH analogy. Přímé srovnání leuprorelinu a degarelixu dokládá vyšší odpověď při srovnání hladin PSA a ALP. Pokles hladin PSA je významně rychlejší po aplikaci degarelixu, viz graf 3 [15]. Významně rychlejší pokles při podání degarelixu je patrný u hladin testosteronu oproti LHRH analogům (graf 4) [15]. Farmakologický profil LHRH anatagonistů přináší výhody především pacientům s pokročilým onemocněním, symptomatickým, pacientům s vysokým rizikem progrese a agresivními formami CaP.
Degarelix byl na základě výsledků klinických studií fáze III schválen pro klinické použití pro léčbu pokročilého karcinomu prostaty FDA v USA v prosinci 2008 a EMEA v únoru 2009. V České republice zatím není k dispozici. Vyvíjeni byli i další LHRH antagonisté. Jejich podání je bohužel spojeno s významným rizikem hypersenzitivní reakce. Klinické studie probíhají s abarelixem, cetrorelixem, ramorelixem a teverelixem.
Staronově mohou být z armamentária přípravků použity estrogeny, bohužel nedostupné v ČR. Zpětnovazebně vede jejich podání k potlačení sekrece LHRH v hypotalamu a k supresi sekrece LH a prolaktinu. Dále estrogeny blokují účinek 5α-reduktázy a v játrech zvyšují produkci SHBG (sexual hormones binding globulin, globulin vázající pohlavní hormony) a tím snižují účinek volného testosteronu a estrogenů. Kromě typických nežádoucích účinků, obdobných s ostatními přípravky (hot flashes, poruchy libida a potence, gynekomastie a další), jsou pro podávání estrogenů limitující kardiovaskulární komplikace s retencí tekutin, poruchami v metabolismu lipidů a regulací cévního systému. Suprese testosteronu estrogeny nebývá provázena osteoporózou a poruchami kognitivních funkcí [16]. Účinnost diethylstilbestrolu (DES) v dávce 5 mg denně byla dokonce vyšší ve srovnání s orchiektomií. Vyšší však byla i mortalita, především kardiovaskulární. Redukce dávky DES na 1 mg denně snižuje nežádoucí účinky při zachované účinnosti srovnatelné s orchiektomií. V zahraničním tisku, především skandinávském, se stále častěji objevují recentní odkazy na podávání estrogenů, především DES v dávce 1 mg denně.
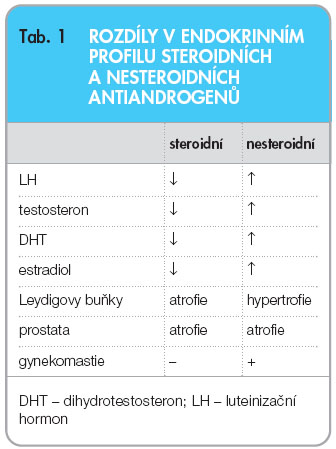 Poslední skupinou hormonálních přípravků podávaných k léčbě zhoubného nádoru prostaty jsou antiandrogeny. Jejich obliba je v České republice ve srovnání s ostatním světem značná; toto se týká především skupiny nesteroidních antiandrogenů. Jejich základním mechanismem účinku je kompetitivní vazba na androgenní receptory, tím blokují působení testosteronu a především dihydrotestosteronu v jejich působení na prostatickou buňku. Pouze tímto periferním účinkem působí tzv. čisté nesteroidní androgeny, potlačením zpětnovazebných mechanismů dochází při jejich aplikaci k nárůstu LH a testosteronu. Steroidní antiandrogeny (cyproteron acetát) svým duálním účinkem navíc inhibují produkci LH a FSH, vedou ke snížení produkce testosteronu a estradiolu s následnou atrofií Leydigových buněk varlete a prostatické žlázy (tab. 1). Vzestup hladin testosteronu při podávání nesteroidních antiandrogenů je několikanásobný proti výchozí hodnotě, shodně i vzestup LH. Při podávání flutamidu byl popsán až 200násobný vzestup. Srovnání účinku nesteroidních a steroidních antiandrogenů v monoterapii nezaznamenalo u metastazujícího či rizikového karcinomu statisticky významný rozdíl [17], jen vyšší množství nežádoucích účinků u nemocných léčených flutamidem.
Poslední skupinou hormonálních přípravků podávaných k léčbě zhoubného nádoru prostaty jsou antiandrogeny. Jejich obliba je v České republice ve srovnání s ostatním světem značná; toto se týká především skupiny nesteroidních antiandrogenů. Jejich základním mechanismem účinku je kompetitivní vazba na androgenní receptory, tím blokují působení testosteronu a především dihydrotestosteronu v jejich působení na prostatickou buňku. Pouze tímto periferním účinkem působí tzv. čisté nesteroidní androgeny, potlačením zpětnovazebných mechanismů dochází při jejich aplikaci k nárůstu LH a testosteronu. Steroidní antiandrogeny (cyproteron acetát) svým duálním účinkem navíc inhibují produkci LH a FSH, vedou ke snížení produkce testosteronu a estradiolu s následnou atrofií Leydigových buněk varlete a prostatické žlázy (tab. 1). Vzestup hladin testosteronu při podávání nesteroidních antiandrogenů je několikanásobný proti výchozí hodnotě, shodně i vzestup LH. Při podávání flutamidu byl popsán až 200násobný vzestup. Srovnání účinku nesteroidních a steroidních antiandrogenů v monoterapii nezaznamenalo u metastazujícího či rizikového karcinomu statisticky významný rozdíl [17], jen vyšší množství nežádoucích účinků u nemocných léčených flutamidem.
Antigonadotropní efekt inhibicí LH a antiandrogenní efekt blokováním aktivity C21-19 desmolázy umožňují bezpečné podávání steroidních antiandrogenů v monoterapii při HD (high dose) podávání 300 mg denně nebo u kombinované terapie v rámci maximální androgenní blokády spolu s LHRH analogy nebo orchiektomií. Využíváme i schopnosti tlumit návaly horka při léčbě LHRH analogy nebo po orchiektomii. Podání steroidních antiandrogenů vede k signifikantnímu snížení výskytu horkosti a menší závažnosti tzv. hot flashes ve srovnání s bikalutamidem [18]. Mezi nesteroidní „čisté“ antiandrogeny patří flutamid, bikalutamid a nilutamid, který již není na českém trhu k dispozici. Aplikaci nesteroidních antiandrogenů provází u dvou třetin pacientů nepříjemná gynekomastie. Její prevencí je profylaktické ozáření mamm před zahájením léčby nebo podávání tamoxifenu. Především v kombinaci tamoxifenu s LHRH analogy je třeba sledovat dobu QTc intervalu. Výhodou monoterapie antiandrogeny je zachování potence a libida. Podle našich sledování není významný rozdíl mezi oběma typy androgenů s ohledem na možnou sexuální dysfunkci. Stejně tak monoterapie antiandrogeny předchází symptomům z nedostatku androgenů. Podání antiandrogenů s výjimkou vysokých dávek steroidních androgenů není z onkologického hlediska srovnatelné s chirurgickou kastrací, ale je spojeno s významně lepší kvalitou života. S kastrací je srovnatelný bikalutamid v dávce 150 mg. Při hodnocení EPC (early prostate cancer) projektu s mediánem sledování 7,4 roku byl prokázán přínos z hlediska času do progrese (progression-free survival) pouze pro skupinu nemocných léčených bikalutamidem 150 mg spolu s radioterapií [19]. Pro podání bikalutamidu v dávce 50 mg i 150 mg jsou platná preskripční omezení. Cena léčby v současné době významně převyšuje onkologicky bezpečnější léčbu LHRH analogy [20]. V rámci klinických studií jsou zkoušeny další přípravky (MDV3100 či abiraterone), jejich uvedení do běžné klinické praxe však není v dohledné době pravděpodobné. Recentní práce jsou spíše zaměřeny na optimalizaci účinnosti dostupných přípravků, např. sekvenčním podáváním antiandrogenů, snížením produkce adrenálních androgenů a estrogenní složky a zásahem na buněčné úrovni pomocí biologické léčby [21].
Léčebné režimy
Zatímco u pacienta s mnohočetnou kostní generalizací není pochyb o nutnosti okamžitého zahájení léčby [22], u ostatních je třeba zvažovat rozsah onemocnění, věk, přítomnost rizikových faktorů i samotnou volbu poučeného muže, eventuálně i jeho blízkých. Pokud pacient souhlasí s radikální radiační nebo chirurgickou léčbou, v případě pokročilého onemocnění zvažujeme význam multimodální léčby. Neoadjuvantní léčba před radikální prostatektomií nemá vliv na celkové ani nádorově specifické přežití [23], i když signifikantně redukuje pozitivní chirurgické okraje a invazi do lymfatických uzlin. V České republice není proto hrazena z veřejného zdravotního pojištění. Jiná je situace v případě radiační léčby. Pro nemocné s CaP nízkého či středního rizika jsou vhodné krátkodobé režimy s neoadjuvantním a konkomitantním podáním hormonální léčby [24], kdy snižují riziko selhání samostatné radioterapie a nezhoršují kvalitu života [25]. Doba trvání hormonální léčby je diskutována u pacientů s vysokorizikovým CaP. Prodloužení hormonální léčby o 6 měsíců po ukončené radioterapii [26] až na více než 5 let [27] je spojeno s nižším rizikem progrese. Kratší doba trvání však nezvyšuje výskyt komorbidit.
Standardem je zahájení aplikace hormonální léčby v monoterapii [28] s výjimkou úvodního přidání antiandrogenu k LHRH analogům k omezení flare-up fenoménu. Monoterapii bychom mohli označit jako hormonální léčbu první linie. Při jejím selhání pak doplňujeme na MAB (maximální androgenní blokádu), tedy k původní aplikaci LHRH analog či k orchiektomii přidáme antiandrogen, nebo naopak k antiandrogenu doplníme LHRH analoga či orchiektomii. Rozšířením monoterapie na MAB prodloužíme léčebnou odpověď přibližně o 6 měsíců. Recentní studie Prostate Cancer Trialists’ Collaborative Group (PCTCG) [29, 30] dokládají nesignifikantní rozdíl při hodnocení doby do progrese a celkového přežití. K dispozici je i hodnocení Cochrane Collaborative group [31]. Doba do progrese byla pouhý jeden rok, beznádorové přežití dosáhlo pouze 5 let. Po pěti letech zjistili signifikantní rozdíl v celkovém přežití, ale pro nežádoucí účinky byla léčba u 10 % pacientů předčasně ukončena. Významný vzestup výskytu nežádoucích účinků a ceny léčby přináší užitek pouze velmi omezené skupině pacientů. Při aplikaci antiandrogenů v rámci MAB je možné po selhání léčby využít krátkodobé odpovědi po vysazení antiandrogenů (withdrawal efect).
Načasování a trvání hormonální léčby představuje stále nedořešený problém. Hormonální léčbu je možné podat časně, či odloženě. Jiným rozdělením je, zda podávání probíhá trvale, či intermitentně. U nemocných s rozsáhlou kostní generalizací nelze kontinuální podávání omezit. Ostatní nemocní mají možnost intermitentního podávání. Výhodou je oddálení doby do hormonální independence a velmi jednoduchá možnost při selhání intermitentní androgenní suprese (IAS) změnit režim na trvalý. Významnou výhodou je omezení nežádoucích účinků, které s sebou endokrinní suprese přináší; jsou to především hot flashes, poruchy kognitivních funkcí, gynekomastie, osteoporóza, zvýšení rizika kardiovaskulárních onemocnění, snížení libida s rozvojem sexuální dysfunkce, anémie. Omezení nežádoucích účinků snižuje náklady na léčbu samu i náklady na léčbu nežádoucích účinků a jejich komplikací. Bezpečnost IAS dokládá množství randomizovaných studií, které kladou důraz na onkologickou bezpečnost léčby bez zkrácení přežití [32]. Naprosto excelentní výsledky nacházíme u nemocných s biochemickým relapsem po radikální léčbě. Přesto bývá tato léčba doporučována ve všech skupinách nemocných, dokonce i u starších mužů s generalizací [33]. Přidání finasteridu do léčebného režimu prodlužuje dobu do zahájení dalšího terapeutického cyklu [34].
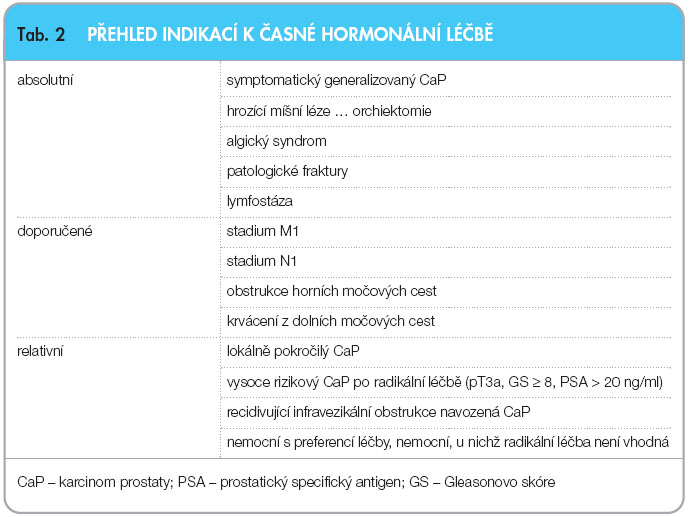 Časné zahájení, resp. oddálení začátku hormonální léčby představuje další velký okruh otázek. Výsledky studie EORTC [35] dokládají mírný trend hovořící ve prospěch časného zahájení léčby, jiné práce, např. EPC program [19], upozorňují na zvýšenou nenádorovou mortalitu – 55 % vs. 11 %. U pacienta se symptomatickým generalizovaným karcinomem je časná endokrinní léčba nezbytná [22], u ostatních je třeba vždy zvažovat i s pacientem jeho preference a přínos terapie (tab. 2).
Časné zahájení, resp. oddálení začátku hormonální léčby představuje další velký okruh otázek. Výsledky studie EORTC [35] dokládají mírný trend hovořící ve prospěch časného zahájení léčby, jiné práce, např. EPC program [19], upozorňují na zvýšenou nenádorovou mortalitu – 55 % vs. 11 %. U pacienta se symptomatickým generalizovaným karcinomem je časná endokrinní léčba nezbytná [22], u ostatních je třeba vždy zvažovat i s pacientem jeho preference a přínos terapie (tab. 2).
Chemoterapie karcinomu prostaty
Malé procento karcinomů prostaty je primárně hormonálně refrakterních, s převahou neuroendokrinní složky. Bývají spojeny s velmi nepříznivou prognózou a s krátkodobým přežitím. Cytotoxická léčba na bázi platiny je léčbou volby. Byly popsány i kompletní remise s přežitím delším než dva roky [36].
Více než 80 % karcinomů prostaty je v době diagnózy hormonálně dependentních. Rozdílná je doba, po kterou si hormonální dependenci zachovávají. Medián trvání odpovědi u generalizovaného onemocnění je 12 měsíců. Progreduje-li onemocnění (rostou hladiny PSA) při kastračních hladinách testosteronu (< 1,7, resp. 0,7 mmol/l), přechází do stadia hormonální independence. Čím kratší doba zdvojení PSA (PSA-DT), s tím horší prognózou je onemocnění spojeno.
Z historických pramenů získáme přehled o nízké úspěšnosti a špatné prognóze pacientů léčených chemoterapií. Objektivním zlomem v přístupu k chemoterapii karcinomu prostaty bylo v devadesátých letech minulého století uvedení kombinace mitoxantronu s prednisonem (MTX + P), která příznivě ovlivnila algický syndrom při kostním postižení, a tím i kvalitu života, nevedla však k prodloužení přežití.
Začátek 21. století znamenal zásadní změnu. Prezentovány byly výsledky dvou studií; studie SWOG 99-16 [37], srovnávající mitoxantron (MTX) s prednisonem (P) vs. docetaxel s estramustinfosfátem (EMP), a dále studie TAX 327 [38], která srovnávala MTX + P vs. docetaxel 75 mg/m2 + prednison 1krát za 3 týdny vs. docetaxel 30 mg/m2 + prednison 1krát týdně. Z výsledků je zřejmé, že EMP zvyšuje toxicitu léčby. Aplikace docetaxelu s prednisonem 1krát za 3 týdny signifikantně prodlužuje dobu přežití oproti kombinaci MTX + P (18,9 vs. 16,4 měsíce) a snižuje riziko smrti o 24 %. Vzhledem k toxicitě je třítýdenní aplikace hodnocena jako optimální. PSA odpověď i klinické snížení bolesti korelují s přežitím. Časný vzestup PSA (do 12 týdnů) je známkou progrese onemocnění [39]. Režim docetaxel s prednisonem je v současné době zlatým standardem pro nemocné s hormonálně independentním karcinomem prostaty, především v dobrém biologickém stavu, s algickým syndromem dobře reagujícím na NSA či na léčbu mírnými opiáty. Pro ostatní jsou vhodnější spíše paliativní režimy, tedy mitoxantron s prednisonem, eventuálně estramustinfosfát v monoterapii. Při jeho aplikaci dosahuje klinická odpověď více než 30 %, jeho podávání je však provázeno závažnými nežádoucími účinky, především hematologickými. Jeho obliba však zůstává poměrně vysoká. U starších mužů lze s menší toxicitou podat vinorelbin s hydrokortizonem [40], kdy lze očekávat odpověď u více než jedné třetiny pacientů. V ČR využíváme režim jako cytotoxickou léčbu II. volby.
Pro velkou část nemocných s hormonálně independentním onemocněním (HICaP) je základním problémem algický syndrom spojený s kostním postižením. Sama bolest zhoršuje kvalitu života, navíc jsou nemocní ohroženi kostními komplikacemi, především zlomeninami. Na kostním postižení u nemocných s CaP se podílí nejen metastatické postižení skeletu, ale i osteoporóza jako důsledek androgenní suprese. Navíc onemocnění postihuje starší muže, kdy v důsledku syndromu stárnutí bývá kostní denzita snížena. U pacientů s HICaP je zařazení bisfosfonátů do základního léčebného protokolu pravidlem. Podle preference pacienta volíme mezi přípravky s doloženou účinností u CaP, tedy mezi zoledronátem a klodronátem [41]. S dobrým analgetickým efektem bývají podávány radioizotopy, perspektivní a dobře tolerovaná je kombinace docetaxelu se 153samariem [42]. Jako slibný se jeví denosumab, který bude v blízké budoucnosti dostupný nejen v rámci klinických studií. Ve srovnání s bisfosfonáty IV. generace podávanými intravenózně denosumab výrazně rychleji normalizuje odpady N-telopeptidu v moči [43], a to i u pacientů předléčených bisfosfonáty.
Kam směřuje léčba karcinomu prostaty
Současné klinické studie se zaměřují na časnou či multimodální léčbu u pacientů s rizikovými faktory po radikální léčbě (GS > 7, pozitivní chirurgické kraje, iPSA > 20 ng/ml). Po radikální prostatektomii (RRP) jsou rizikoví pacienti randomizováni do větve goserelin plus bikalutamid vs. goserelin plus mitoxantron ve studii SWOG 9921. Studie AUO má tři ramena u pacientů hormonálně refrakterních po RRP, a to monoterapii hormonální, hormonální terapii plus ibandronát a třetí pak kombinaci hormonální terapie s ibandronátem a docetaxelem. Do studie TAX 3501, zaměřené na rizikové pacienty po RRP, bylo zatím zařazeno přibližně 70 % z celkového počtu pacientů, kteří mají být sledováni. Srovnává časnou či odloženou léčbu ve dvou větvích, a to leuprorelin v monoterapii vs. leuprorelin plus docetaxel. Na její závěry však budeme ještě dlouho čekat. Zjistit, jak dlouhý je čas do progrese onemocnění (progression-free survival), bylo cílem fáze III Cooperative VA study 553, srovnávající docetaxel s prednisonem vs. pečlivé sledování u pacientů po RRP. Ani zde zatím nejsou závěry k dispozici. Studie RTOG porovnává hormonální léčbu s chemoterapií (EMP, paklitaxel, etoposid) po zevní radioterapii. Dalším projektem, který zahrnuje nemocné s vysoce rizikovým hormonálně dependentním karcinomem lokalizovaným, pokročilým nebo s relapsem po lokální léčbě, je projekt STAMPEDE [44]. Porovnává tři agens (docetaxel, zoledronát a celekoxib) samostatně nebo v kombinaci. Zatím je ve stadiu přijímání pacientů.
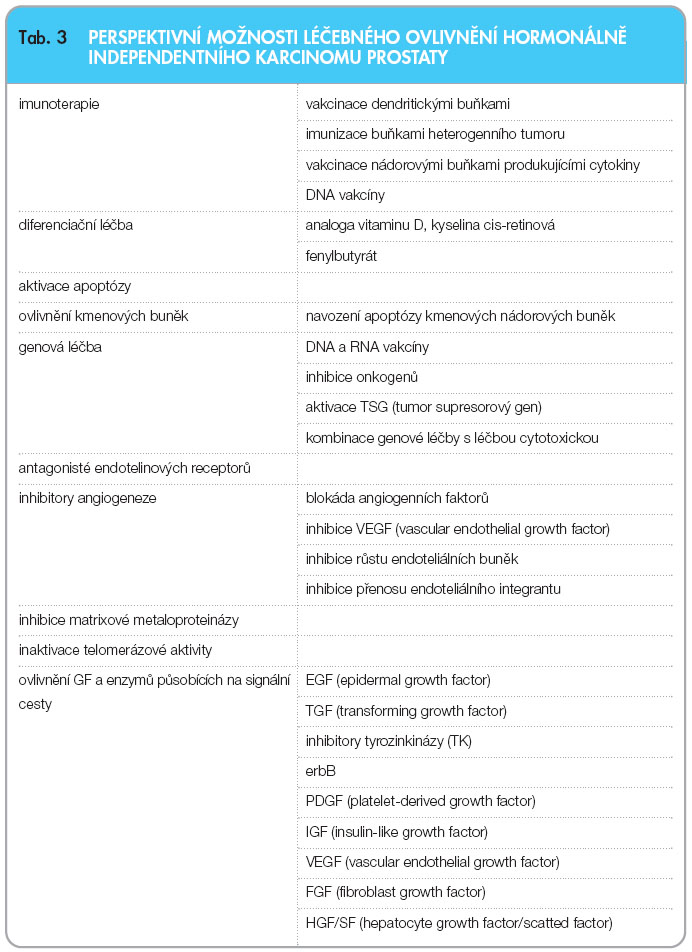 Další studie míří do oblasti hormonálně independentního karcinomu prostaty. Příznivý efekt u HICaP bývá spojován s léčbou, která v léčebných režimech kombinuje biologickou léčbu, např. inhibitory receptoru pro epidermální růstový faktor (EGFR) a jeho signální kaskády (cetuximab, trastuzumab či erlotinib), inhibitory receptoru endotelinu A (atrasentan), inhibitory angiogeneze (thalidomid) a další (tab. 3). Jindy se objevují nové režimy s již osvědčenými přípravky (EMP plus etoposid) [45], snaha o zvýšení senzitivity nádorových buněk (např. ciprofloxacinem při aplikaci docetaxelu nebo doxorubicinu) [46] nebo jen průkaz, že léčba lykopeny není účinná [47]. Sorafenib a sunitinib, inhibitory tyrozinkinázy užívané v urologické onkologii, by mohly mít účinek i u metastatického HICaP [48] po selhání docetaxelu, PFS se pohybuje kolem 12 týdnů. Zkoušeny jsou i léky na bázi platiny (satraplatin), epitilony (ixabepilon a patupilon) či taxany II. generace (XRP-6258) nebo cílené ovlivnění androgenního receptoru abirateronem. Výsledky studií jsou zatím velmi předčasně hodnotitelné [49]. Při podání gefitinibu však žádný efekt prokázán nebyl [50, 51], stejně jako zůstalo bez prokázaného efektu podání kombinace s imatinibem, která navíc zvyšuje toxicitu léčby. Obdobně i inhibitor EGFR vandetanib vede pouze ke zvýšení nežádoucích účinků léčby, bez prokazatelného účinku [52]. Studie, která hodnotí kombinaci docetaxelu s antagonistou endotelinových receptorů typu A atrasentanem, probíhá, ale kombinace se nezdá účinnější než samotný docetaxel s prednisonem [53].
Další studie míří do oblasti hormonálně independentního karcinomu prostaty. Příznivý efekt u HICaP bývá spojován s léčbou, která v léčebných režimech kombinuje biologickou léčbu, např. inhibitory receptoru pro epidermální růstový faktor (EGFR) a jeho signální kaskády (cetuximab, trastuzumab či erlotinib), inhibitory receptoru endotelinu A (atrasentan), inhibitory angiogeneze (thalidomid) a další (tab. 3). Jindy se objevují nové režimy s již osvědčenými přípravky (EMP plus etoposid) [45], snaha o zvýšení senzitivity nádorových buněk (např. ciprofloxacinem při aplikaci docetaxelu nebo doxorubicinu) [46] nebo jen průkaz, že léčba lykopeny není účinná [47]. Sorafenib a sunitinib, inhibitory tyrozinkinázy užívané v urologické onkologii, by mohly mít účinek i u metastatického HICaP [48] po selhání docetaxelu, PFS se pohybuje kolem 12 týdnů. Zkoušeny jsou i léky na bázi platiny (satraplatin), epitilony (ixabepilon a patupilon) či taxany II. generace (XRP-6258) nebo cílené ovlivnění androgenního receptoru abirateronem. Výsledky studií jsou zatím velmi předčasně hodnotitelné [49]. Při podání gefitinibu však žádný efekt prokázán nebyl [50, 51], stejně jako zůstalo bez prokázaného efektu podání kombinace s imatinibem, která navíc zvyšuje toxicitu léčby. Obdobně i inhibitor EGFR vandetanib vede pouze ke zvýšení nežádoucích účinků léčby, bez prokazatelného účinku [52]. Studie, která hodnotí kombinaci docetaxelu s antagonistou endotelinových receptorů typu A atrasentanem, probíhá, ale kombinace se nezdá účinnější než samotný docetaxel s prednisonem [53].
Kombinace docetaxelu s analogy vitaminu D dokládají jistou účinnost, především vysoce dávkovaný kalcitriol podávaný v kombinaci s docetaxelem v dávce 36 mg/m2 vede u části pacientů k dobré odpovědi s poklesem PSA o více než 50 %. U těchto nemocných pak byla v rámci studie Ascent [54] podávána léčba intermitentně. Kritéria intermitentního podávání však splnilo jen 18 % pacientů. Nepochybně slibnou se zdá kombinovaná imunochemoterapie s dendritickými buňkami [55] u nemocných po selhání chemoterapie, kdy je zřejmá dlouhodobá odpověď. Léčba je dobře tolerována. Jistě i program s léčbou pacientů s biochemickým relapsem po RRP přinese zajímavé výsledky.
Závěr
Farmakoterapie představuje jeden z pilířů multimodálního přístupu ke zhoubnému onemocnění prostaty. V mnoha stadiích onemocnění využíváme endokrinní závislosti nádoru, nicméně v posledních letech nabývá na významu i léčba cytotoxická. Zřetelný je rovněž pokus o zařazení kombinovaných terapeutických režimů do adjuvance po radikální léčbě a snaha individualizovat terapii. Snížení nežádoucích účinků hormonální terapie by mělo přinést zařazení LHRH antagonistů do palety léčiv. Naopak zvýšení efektivity by mělo přinést přidání biologických látek. Zatím slibné jsou výsledky s použitím dendritických buněk u pacientů s hormonálně independentním karcinomem prostaty. Zajímavé budou rovněž závěry studií imunoterapie u „minimal disease“ v rámci adjuvantního podání.
Seznam použité literatury
- [1] www.uzis.cz. Navštíveno 10. 2. 2010.
- [2] www.uroweb.cz. Navštíveno 10. 2. 2010.
- [3] Zimmermann RA, Culkin DJ. Clinical strategies in the management of biochemical recurrence after radical prostatectomy. Clin Prostate Cancer 2003; 2: 160–166.
- [4] Klotz L. Active surveillance with selective delayed intervention using PSA doubling time for good risk prostate cancer. Eur Urol 2005; 47: 16–21.
- [5] Huggins C, Hodges CV. The effects of castration, of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Cancer Res 1941; 1: 293–297.
- [6] Hanuš M, Matoušková M. LHRH analoga v léčbě karcinomu prostaty (CAP) EAU Guidelines (EAUG) a realita denní praxe v Evropě a v České republice. Ces Urol 2007; 2: 98–102.
- [7] Oefelein MG, Cornum R. Failure to achieve castrate levels of testosterone during luteinizing hormone releasing hormone agonist therapy: the case for monitoring serum testosterone and a treatment decision algorithm. J Urol 2000; 184: 726–729.
- [8] Morote J, Esquena S, Abascal JM, et al. Failure to maintain a suppressed level of serum testosterone during long-action depot luteinizing hormone-releasing hormone agonist therapy in patiens with advanced prostate cancer. Urol Int 2006; 77: 135–138.
- [9] Morote J, Orsola A, Planas J, et al. Redefining clinically significant castration levels in patients with prostate cancer receiving continuous androgen deprivation therapy. J Urol 2007; 178: 1290–1295.
- [10] Crawford ED, Sartor O, Chu F, et al. A 12-month clinical study of LA-2585 (45.0 mg): a new 6-month subcutaneous delivery system for leuprolide acetate for the treatment of prostate cancer. J Urol 2006; 175: 533–536.
- [11] McLeod D, Zinner N, Tomera K, et al. A phase 3, multicenter, open-label, randomized study of abarelix versus leuprolide acetate in men with prostate cancer. Urology 2001; 58: 756–761.
- [12] Sood R, Jain V. A comparative head on efficacy study of three monthly leuprolide depot vs goserelin depot preparations for treatment in patiens with prostate cancer. Urology 2006; 68 (suppl. 5A): 199.
- [13] Kumar S, Shelley M, Harrison C, et al. Neo-adjuvant and adjuvant hormone therapy for localised and locally advanced prostate cancer. Cochrane Database of Systematic Reviews 2006, Issue 4. Art. No.: CD006019.
- [14] Bolla M, De Reijke TM, Van Tienhoven G, et al. Duration of androgen suppression in the treatment of prostate cancer. N Engl J Med 2009; 360: 2516–2527.
- [15] Klotz L, Boccon-Gibod L, Shore ND, et al. The efficacy and safety of degarelix: a 12-month, comparative, randomized, open-label, parallel-group phase III study in patients with prostate cancer. BJU Int 2008; 102: 1531–1538.
- [16] Sher DS, Pitts WR Jr. The nonsteroideal effects of diethylstilbestrol: The rationale for androgen deprivation therapy without estrogen deprivation in the treatment of prostate cancer. J Urol 2003; 170: 1703–1708.
- [17] Schröder FH, Whelan P, de Reijke TM, et al. Metastatic Prostate Cancer Treated by Flutamide versus Cyproterone Acetate. Final Analysis of the „European Organization for Research and Treatment of Cancer“ (EORTC) Protocol 30892. Eur Urol 2004; 45: 457–464.
- [18] Sakai H, Igawa T, Tsurusaki T, et al. Hot flashes during androgen deprivation therapy with luteinizing hormone-releasing hormone agonist combined with steroidal or nonsteroidal antiandrogen for prostate cancer. Urology 2009; 73: 635–640.
- [19] McLeod DG, Iversen P, See WA, et al. Bicalutamide 150 mg plus standard care vs standard care alone for early prostate cncer. BJU Int 2006; 97: 247–254.
- [20] Matoušková M, Hanuš M. Cena hormonální léčby karcinomu prostaty. Farmakoekonomické aspekty indikací léčby. Urol pro praxi 2007; 6: 291–294.
- [21] Van Allen EM, Ryan CJ. Novel secondary hormonal therapy in advanced prostate cancer: an update. Curr Opin Urol 2009; 19: 315–321.
- [22] Dušek P. Farmakologická léčba karcinomu prostaty. 1. vyd. Praha: Maxdorf, 2010.
- [23] Shelley MD, Kumar S, Wilt T, et al. A systematic review and meta-analysis of randomised trials of neo-adjuvant hormone therapy for localised and locally advanced prostate carcinoma. Cancer Treat Rev 2009; 35: 9–17.
- [24] Lee I, Sandler H. Hormone therapy and radiotherapy for intermediate risk prostate cancer. Semin Radiat Oncol 2008; 18: 7–14.
- [25] Pinkawa M, Piroth MD, Asadpour B, et al. Neoadjuvant hormonal therapy and external-beam radiotherapy versus external-beam irradiation alone for prostate cancer. A quality-of-life analysis. Strahlenther Onkol 2009; 185: 101–108.
- [26] D’Amico AV, Chen MH, Renshaw AA, et al. Interval to testosterone recovery after hormonal therapy for prostate cancer and risk of death. Int J Radiat Oncol Biol Phys 2009; 75: 10–15.
- [27] Souhami L, Bae K, Pilepich M, Sandler H. Impact of the duration of adjuvant hormonal therapy in patients with locally advanced prostate cancer treated with radiotherapy: a secondary analysis of RTOG 85-31. J Clin Oncol 2009; 27: 2137–2143.
- [28] Babjuk M, Matoušková M, Fínek J, et al. Konsensuální doporučené postupy v uroonkologii. Praha: Galen, 2009. 126 s.
- [29] Prostate Cancer Trialists’ Collaborative Group. Maximum androgen blockade in advanced prostate cancer: an overview of 22 randomised trials with 3283 deaths in 5710 patients. Lancet 1995; 346: 265–269.
- [30] Prostate Cancer Trialists’ Collaborative Group. Maximum androgen blockade in advanced prostate cancer: an overview of the randomised trials. Lancet 2000; 355: 1491–1498.
- [31] Schmidt B, Bennett C, Seidenfeld J, et al. Maximal androgen blocade for advanced prostate cancer. Cochrane Database Syst Rev (2) 2004; CD001526.
- [32] Calais da Silva FE, Bono AV, Whelan P, et al. Intermittent androgen deprivation for locally advanced and metastatic prostate cancer: results from a randomised phase 3 study of the South European Uroncological Group. Eur Urol 2009; 55: 1269–1277.
- [33] Pfitzenmaier J, Altwein JE. Hormonal therapy in the elderly prostate cancer patient. Dtsch Arztebl Int 2009; 106: 242–247.
- [34] Shaw G. Oliver RT. Intermittent hormone therapy and its place in the contemporary endocrine treatment of prostate cancer. Surg Oncol 2009; 18: 275–282.
- [35] Schröder FH, Kurth KH, Fossa SD, et al. Early versus delay endocrine treatment of pN1-3 M0 prostate cancer without local treatment of the primary tumor: results of European Organisation for the Research and Treatment of Cancer 30846– a phase III study. J Urol 2004; 172: 923–927.
- [36] Ciszewski A, Shackleton D, Beer TM. Long-term remission of metastatic small cell carcinoma of the prostate. Urology 2008; 71: 546.e3-4.
- [37] Petrylac DP, Tangen C, Hussain M, et al. Docetaxel and estramustin compared with mitoxantron and prednison for advanced refractory prostate cancer. N Engl J Med 2004; 351: 1513–1520.
- [38] Tannock JF, de Wit R, Berry WJ, et al. Docetaxel plus prednison or mitoxantrone plus prednison for advanced cancer. N Engl J Med 2004; 351: 1502–1512.
- [39] Berthold DR, Pond GR, Roessner M, et al. Treatment of hormone-refractory prostate cancer with docetaxel or mitoxantrone: relationships between prostate-specific antigen, pain, and quality of life response and survival in the TAX-327 study. Clin Cancer Res 2008; 14: 2763–2767.
- [40] Caristi N, Maisano R, Iorfida M, el al. Oral vinorelbine as first line chemotherapy in unfit elderly patients with hormone-refractory prostate cancer. J Chemother 2008; 20: 368–373.
- [41] Dearnaley DP, Mason MD, Parmar MK, et al. Adjuvant therapy with oral sodium clodronate in locally advanced and metastatic prostate cancer: long-term overall survival results from the MRC PR04 and PR05 randomised controlled trials. Lancet Oncol 2009; 10: 872–876.
- [42] Fizazi K, Beuzeboc P, Lumbroso J, et al. Phase II trial of consolidation docetaxel and samarium-153 in patients with bone metastases from castration-resistant prostate cancer. J Clin Oncol 2009; 27: 2429–2435.
- [43] Fikazi K, Bosserman L, Gao G, et al. Denosumab treatment of prostate cancer with bone metastases and increased urine N-telopeptide levels after therapy with intravenous bisphosphonates: results of a randomized phase II trial. J Urol 2009; 182: 509–519.
- [44] James ND, Sydes MR, Clarke NW, et al. Systemic therapy for advancing or metastatic prostate cancer (STAMPEDE): a multi-arm, multistage randomized controlled trial. BJU Int 2009; 103: 464–469.
- [45] Spitaleri G, Matei DV, Curigliano G, et al. Phase II trial of estramustine phosphate and oral etoposide in patients with hormone-refractory prostate cancer. Ann Oncol 2009; 20: 498–502.
- [46] Pinto AC, Moreira JN, Simoes S. Ciprofloxacin sensitizes hormone-refractory prostate cancer cell lines to doxorubicin and docetaxel treatment on a schedule-dependent manner. Cancer Chemother Pharmacol 2009; 64: 445–454.
- [47] Schwenke C, Ubrig B, Thurmann P, et al. Lycopene for advanced hormone refractory prostate cancer: a prospective, open phase II pilot study. J Urol 2009; 181: 1098–1103.
- [48] Aragon-Ching JB, Jain L, Gulley JL, et al. Final analysis of a phase II trial using sorafenib for metastatic castration-resistant prostate cancer. BJU Int 2009; 103: 1636–1640.
- [49] Beardsley EK, Chi KN. Systemic therapy after first-line docetaxel in metastatic castration-resistant prostate cancer. Curr Opin Support Palliat Care 2008; 2: 161–166.
- [50] Boccardo F, Rubagotti A, Conti G, et al. Prednisone plus gefitinib versus prednisone plus placebo in the treatment of hormone-refractory prostate cancer: a randomized phase II trial. Oncology 2008; 74: 223–228.
- [51] Curigliano G, Spitaleri G, De Cobelli O, et al. Health-related quality of life in patients with hormone refractory prostate cancer receiving gefitinib. Urol Int 2009; 82: 196–202.
- [52] Horti J, Widmark A, Stenzl A, et al. A randomized, double-blind, placebo-controlled phase II study of vandetanib plus docetaxel/prednisolone in patients with hormone-refractory prostate cancer. Cancer Biother Radiopharm 2009; 24: 175–180.
- [53] Armstrong AJ, Creel P, Turnbull J, et al. A phase I-II study of docetaxel and atrasentan in men with castration-resistant metastatic prostate cancer. Clin Cancer Res 2008; 14: 6270–6276.
- [54] Beer TM, Ryan CW, Venner PM, et al. Intermittent chemotherapy in patients with metastatic androgen-independent prostate cancer: results from ASCENT, a double-blinded, randomized comparison of high-dose calcitriol plus docetaxel with placebo plus docetaxel. Cancer 2008; 112: 326–330.
- [55] Rozkova D, Tiserova H, Fucikova J, et al. FOCUS on FOCIS: combined chemo-immunotherapy for the treatment of hormone-refractory metastatic prostate cancer. Clin Immunol 2009; 131: 1–10.