Posttranskripční a negenomové účinky glukokortikoidů
Glukokortikoidy jsou protizánětlivá léčiva, která ovlivňují expresi genů, transkripci v jádře, posttranskripční a posttranslační mechanismy v cytoplazmě. Aktivita prozánětlivých proteinů je regulována i posttranskripčními mechanismy, které ovlivňují stabilitu mRNA. Pochopení nových signálních drah regulujících protizánětlivou aktivitu glukokortikoidů je cestou k dosažení maximální léčebné odpovědi v organismu.
Úvod
Poslední dobou nacházíme často v literatuře termíny transkripce, transreprese, translace, posttranskripční a posttranslační účinky. Jedná se o mechanismy, jež ovlivňují aktivitu vlastního zánětu i účinek glukokortikoidů. Glukokortikoidy (GK) jsou jedněmi z nejúčinnějších protizánětlivých léků první volby využívaných v terapii zánětlivých a imunopatologických onemocnění, jako jsou asthma bronchiale, revmatoidní artritida, nespecifické záněty střev a autoimunitní choroby. Přesto je u malého počtu pacientů zaznamenávána nižší nebo vůbec žádná odpověď i na vysoké dávky glukokortikoidů. Jiná zánětlivá onemocnění dýchacího ústrojí – chronická obstrukční plicní nemoc, plicní fibróza a akutní syndrom respirační tísně – jsou velkou měrou kortikorezistentní. Aktivita GK se uplatňuje cestou exprese genů, přenosu signálu ovlivňujícího transkripci v jádře, posttranskripční a posttranslační regulací probíhající v cytoplazmě. Výsledky těchto regulací ovlivňují různé aspekty oblasti imunitní odpovědi [1].
Mechanismus účinku
Glukokortikoidy mají široké protizánětlivé, protialergické, imunosupresivní a antiproliferativní účinky. Významně snižují celkový počet eozinofilů, tvorbu prozánětlivých cytokinů T-lymfocyty a alveolárními makrofágy, snižují počet mastocytů a dendritických buněk. GK ovlivňují i aktivitu strukturálních buněk v průduškách. Epiteliální buňky dýchacích cest tvoří menší množství cytokinů a jiných prozánětlivých mediátorů, je snížena propustnost endoteliálních buněk, a tím je i potlačen rozvoj edému a sekrece hlenu mukózními buňkami. GK snižují všeobecnou hypersenzitivitu a ovlivňují i maximální bronchokonstrikční odpověď na provokační stimuly. Na sliznicích dýchacích cest nedochází k atrofickým změnám, na rozdíl od dlouhodobé místní aplikace kortikosteroidů v dermatologii.
Glukokortikoidy zabraňují vzniku chronických ireverzibilních změn, mezi které patří hyperplazie a hypertrofie hladkých svalů dýchacích cest, subendoteliální fibróza a ztluštění bazální membrány sliznice respiračního traktu jako důsledek depozice kolagenu. Nejsou již ale schopné ovlivnit vzniklé strukturální změny dýchacích cest [2, 3]. Vazba glukokortikoidů na receptory v cytoplazmě cílových buněk zahajuje jejich aktivitu a je podstatou vlastního účinku GK. Kortikosteroidní receptory se nacházejí v cytoplazmě téměř všech buněk, zejména v epiteliálních ![Obr. 1 Mechanismus účinku glukokortikoidů; podle [4] – Adcock, Barnes, 2008.](https://www.remedia.cz/photo-a-27878---.jpg) buňkách dýchacích cest a v buňkách endotelu bronchiálních cév. Po navázání GK na glukokortikoidní receptor, který disociuje z multimerického komplexu s chaperon proteiny, dojde k aktivaci tohoto receptoru a ke vstupu komplexu glukokortikoid/GR do jádra. Zde pak působí mechanismem závislým na DNA, který je zprostředkován vazbou na tzv. glukokortikoid odpovídající element (glucocorticoid response element, GRE), a mechanismem nezávislým na DNA; spouštějí se tak děje tzv. transaktivace a transreprese, viz obr. 1 [4]. Transaktivace je vyvolána aktivací transkripce (přepisu genů), která je regulována GRE, což vede k aktivaci protizánětlivých genů. Spuštěný proces transaktivace v dalších genech se podílí na kontrole krevního tlaku, nitroočního tlaku a na kontrole glukoneogeneze. Proto může transaktivace způsobovat i nežádoucí projevy, mezi něž patří diabetes, hypertenze, glaukom, hypokalemie. V případě astmatu se naopak příznivě projeví genovou expresí např. β2-adrenergních receptorů.
buňkách dýchacích cest a v buňkách endotelu bronchiálních cév. Po navázání GK na glukokortikoidní receptor, který disociuje z multimerického komplexu s chaperon proteiny, dojde k aktivaci tohoto receptoru a ke vstupu komplexu glukokortikoid/GR do jádra. Zde pak působí mechanismem závislým na DNA, který je zprostředkován vazbou na tzv. glukokortikoid odpovídající element (glucocorticoid response element, GRE), a mechanismem nezávislým na DNA; spouštějí se tak děje tzv. transaktivace a transreprese, viz obr. 1 [4]. Transaktivace je vyvolána aktivací transkripce (přepisu genů), která je regulována GRE, což vede k aktivaci protizánětlivých genů. Spuštěný proces transaktivace v dalších genech se podílí na kontrole krevního tlaku, nitroočního tlaku a na kontrole glukoneogeneze. Proto může transaktivace způsobovat i nežádoucí projevy, mezi něž patří diabetes, hypertenze, glaukom, hypokalemie. V případě astmatu se naopak příznivě projeví genovou expresí např. β2-adrenergních receptorů.
Kofaktory transkripce, kterými jsou například CBP (CREB binding protein, vazebný protein pro CREB, tj. cAMP-response element-binding protein), SRC-1 (nuclear receptor coactivator 1, steroidní receptorový koaktivátor), GRIP-1 (glucocorticoid receptor interacting protein 1) a p300/CBP asociovaný faktor PCAF (protein coactivator factor), mají vnitřní histon- acetyltransferázovou aktivitu a zvyšují naopak transkripci prozánětlivých genů [5].
Transreprese je – v protikladu k řečenému – „negenomovou cestou“ a je výsledkem inhibiční interakce mezi aktivovaným GR a transkripčními faktory AP-1 (aktivační protein-1), NF-kapaB (nukleární faktor kapaB) a dalšími transkripčními faktory a kofaktory (obr. 1). Důsledkem je snížení či útlum (transreprese prozánělivých genů) tvorby prozánětlivých mediátorů a cytokinů nebo spolupráce při stimulaci genů obrany hostitele, jako jsou toll-like receptory (např. TLR-2) [6, 7].
Těmito cestami se potlačuje exprese řady genů, např. prozánětlivých cytokinů – IL-1 (interleukin), IL-2, IL-3, TNF-α (tumor nekrotizující faktor a) a dalších. Kortikosteroidy zvyšují i genovou transkripci protizánětlivých genů pro lipokortin 1, β2-adrenoreceptor, endonukleázy, např. NEP (neutrální endopeptidáza). Tento mechanismus je molekulárním podkladem dalšího protizánětlivého působení kortikosteroidů během zánětu, jehož vyjádřením je tvorba specifických proteinů. Nejznámějšími z nich jsou glykoproteiny – lipokortiny. GK tak blokují expresi fosfolipázy A2 (enzym zahajující biosyntézu leukotrienů), snižují expresi adhezivních molekul na zánětlivých buňkách atd. Naproti tomu zvyšují tvorbu IL-10 alveolárními makrofágy, která je u astmatiků snížena. Jsou schopné indukovat apoptózu (programovanou buněčnou smrt) lymfocytů i eozinofilů.
Transkripce je přepis genetické informace z DNA do RNA, je to první krok tvorby bílkovin. Translace je sekundární proces tvorby bílkovin (část genové exprese). Jde o sestavení primární struktury bílkoviny podle záznamu v transkripci vytvořené mRNA. Během translace je informace zapsaná v mRNA podle přesných pravidel genetického kódu dekódována a je podle ní sestaven řetězec aminokyselin.
Kromě jiných genů mají GK schopnost aktivovat i geny, které se mohou chovat jako inhibitory transkripce (např. GILZ – glukokortikoidy indukovaný leucinový zip) nebo její průběh potlačují. Mezi následné účinky GK patří aktivace MAP fosfatázy 1 (MKP-1, dříve DUSP1), která potlačuje mechanismus signalizace cytokinů – aktivitu rodiny mitogenem aktivovaných proteinkináz, terminální kinázy SAPK/JNK a p38/SAPK2 kináz. Uvedené kinázy fosforylují posttranskripčním mechanismem transkripční faktory. Indukce MKP-1 a protein tristetraprolin (TTP), který se váže na RNA, zajišťují posttranskripční účinky GK [8–11].
Negenomovým protizánětlivým účinkem GK je i snížení Ca2+ v cytoplazmě a snížení sekrece Cl- iontů. Inhibiční účinek GK na expresi prozánětlivých genů – IL-1α, IL-6, IL-8, INF-β (interferon), GM-CSF (faktor stimulující kolonie granulocytů/makrofágů) – a mnoha chemokinů je vyvolán zásahem do pohybu mRNA a její translace. Přibližně 50 % genů v epitelu dýchacích cest je regulováno posttranskripčními faktory. Exprese a aktivace STAT-6 (signal transducers and activators of transcription) epitelu dýchacích cest nereaguje na kortikoidy. Prozánětlivé cytokiny IL-4, INF-gamma a TNF-α aktivují transkripční faktory NF-kB, Jak-STAT1 a IRF1 (regulační faktor 1 interferonu). Tyto faktory pak indukují NOS (NO syntáza), což vede k dlouhodobému uvolňování vysokých množství NO [1].
Histony
Chromozom je nukleohistonový komplex. Histony obsahují pozitivně nabité (bazické) aminokyseliny. Ty se vážou k negativně nabitým vláknům DNA, která mají kyselý charakter. Základní stavební jednotkou chromatinu je nukleozom; skládá se z 200 párů bází DNA, oktameru histonů tvořících jádro nukleozomu a spojovacího histonu H1, který umožňuje, aby se nukleozomy organizovaly do vyšších struktur.
Histony jsou malé bazické nukleoproteiny, které se podílejí na výstavbě chromatinu v jádře eukaryontních buněk. Mají vysoký obsah kladně nabitých aminokyselin (lysin a arginin). Pomocí tohoto kladného náboje vytvářejí reverzibilní komplexy s DNA. Rozlišuje se pět typů histonů: H1, H2A, H2B, H3 a H4. Histony H2A, H2B, H3 a H4 tvoří vždy ve dvou kopiích oktamery, kolem nichž se obtáčí dvojšroubovicová DNA; tento útvar se nazývá nukleozom. Histon H1 je přítomen v menším množství než ostatní histony, a ačkoli je též vázán na DNA, není součástí nukleozomů. Histony se tak podílejí na uspořádání DNA v eukaryontním chromozomu ve vlákno vyššího řádu.
Každý z histonů H2A, H2B, H3, H4 obsahuje N-koncovou doménu, která vystupuje ven z centrální části nukleozomového jádra, a může tak interagovat s DNA nebo s jinými proteiny. Je tudíž místem, na kterém dochází k většině reverzibilních modifikací histonů, jež ovlivňují strukturu nukleozomu, a tím i přístupnost DNA. K modifikacím histonů probíhajícím na jejich N-konci patří acetylace, fosforylace, methylace, ADP-ribosylace a biotinylace. K některým modifikacím může docházet i na C-konci některých histonů, sem se řadí ubiquitinace a fosforylace. Acetylace, methylace a fosforylace histonů mají vztah ke genové expresi a ke změnám chromatinové struktury. Acetylace histonů transkripci spouští po neutralizaci pozitivního náboje histonů a snížení jejich afinity k DNA, což usnadňuje přístup transkripčních faktorů k DNA. Histonové acetyltransferázy (HAT) dodávají acetylové skupiny k histonům a sbalenou DNA rozvolňují. Naproti tomu histonové deacetylázy (HDAC) acetylové skupiny z histonů odstraňují. Kortikosteroid po vstupu do cytoplazmy buňky vytvoří komplex kortikosteroid-kortikosteroidní receptor a mj. na sebe naváže enzym histondeacetylázu-2 (HDAC2) aktivovanou koaktivačním komplexem. Deacetylace vede k represi transkripce.
Methylace histonů (např. DNA) většinou vypíná transkripci genů. Je tak jedním z vyvolávajících mechanismů epigenetické změny. Fosforylací dochází ke změně nábojů na histonech, čímž fosforylace (hlavně histonu H1 a H3) pozitivně ovlivňuje kondenzaci chromatinu [13].
Posttranslační úpravy
Posttranslačními modifikacemi se označují úpravy proteinů vytvořených ribozomy. Posttranslační úpravy dávají proteinům nové vlastnosti, stabilizují jejich konfirmace, regulují i jejich funkce, ovlivňují jejich rozpoznávání imunitním systémem atd.Následující výčet představuje nejdůležitější posttranslační úpravy:
-
Fosforylace/defosforylace – enzymy kinázy a fosfatázy připojují nebo odpojují fosfátovou skupinu (PO43-) k bílkovině na její serinové/threoninové zbytky nebo tyrozinové zbytky. Fosforylace/ defosforylace často účinkuje jako přepínač mezi aktivní a neaktivní formou proteinu.
-
Glykosylace – napojování cukrů na bílkovinu. Cukernaté zbytky jsou nejčastěji připojovány na serin/threonin u tzv. O-glykoproteinů, nebo na asparagin u tzv. N-glykoproteinů.
-
Methylace – methylování koncové skupiny -NH2 lysinu a argininu vede ke zvýšení bazicity těchto aminokyselin, důsledkem je zesílení iontových interakcí.
-
Proteolýza – odštěpení části molekuly bílkoviny, které vede často k aktivaci nebo k potlačení jejích funkcí.
-
Acetylace – acetylace koncové -NH2 lysinu snižuje jeho bazicitu a zeslabuje tak iontové interakce.
-
Hydroxylace – hydroxylace prolinu nebo lysinu v kolagenu vede ke stabilizaci specifické konfirmace.
-
Ubiquitinace – připojení ubiquitinu na bílkovinu přes lysin. Slouží jako molekulární hodiny určující stáří bílkoviny.
-
Disulfidické můstky – oxidace dvou -SH skupin cysteinu [14].
Posttranskripční úpravy
Posttranskripční regulace genů na molekulární úrovni mohou být příčinou snížené odpovědi na glukokortikoidy nebo i možným místem zvýšení jejich protizánětlivého účinku. Exprese genů může být kontrolována i posttranskripčně, to znamená v období po zahájení tvorby mRNA a před spuštěním její translace. Způsoby posttranskripční kontroly exprese genů:
-
atenuace
-
alternativní sestřih vedoucí k nefunkční mRNA
-
štěpení na 3’ konci vedoucí k nefunkčnosti mRNA
-
zablokování přenosu mRNA do cytoplazmy a její degradace v jádře
-
trans-splicing a RNA-editing [15, 16].
Ačkoli většina aktivit kortikosteroidů je mediována změnami v průběhu transkripce a přestavby chromatinu, je známo, že tvorba proteinů může být snížena narušením stability mRNA. V současnosti je již prokázáno, že mnoho proteinů zánětu je regulováno posttranskripčně mechanismy ovlivňujícími stabilitu mRNA. Cílovou strukturou vyvolávající posttranskripční změny funkce mRNA jsou tzv. elementy II. třídy bohaté na adenylát/uridylát (ARE). V průběhu pochodů v jádře a přepisu RNA, jejího transportu v cytoplazmě a translace regulují mRNA v komplexu s RNA-vázajícími proteiny mnohočetné procesy zajišťující bezchybnou translaci. ARE elementy na jedné straně zvyšují stabilitu mRNA tím, že regulují rychlost rozpadu mRNA závislou na její deadenylaci; naproti tomu vazba mRNA destabilizujících faktorů, např. tristetraprolinu, urychluje deadenylaci mRNA – destabilizaci, a tím její rozpad (obr. 2). Translaci ovlivňuje i interakce s dalšími proteiny, např. tvorba TNF-α, TIA – T-cell intracellular antigen a TIAR – TIA-related protein [17].
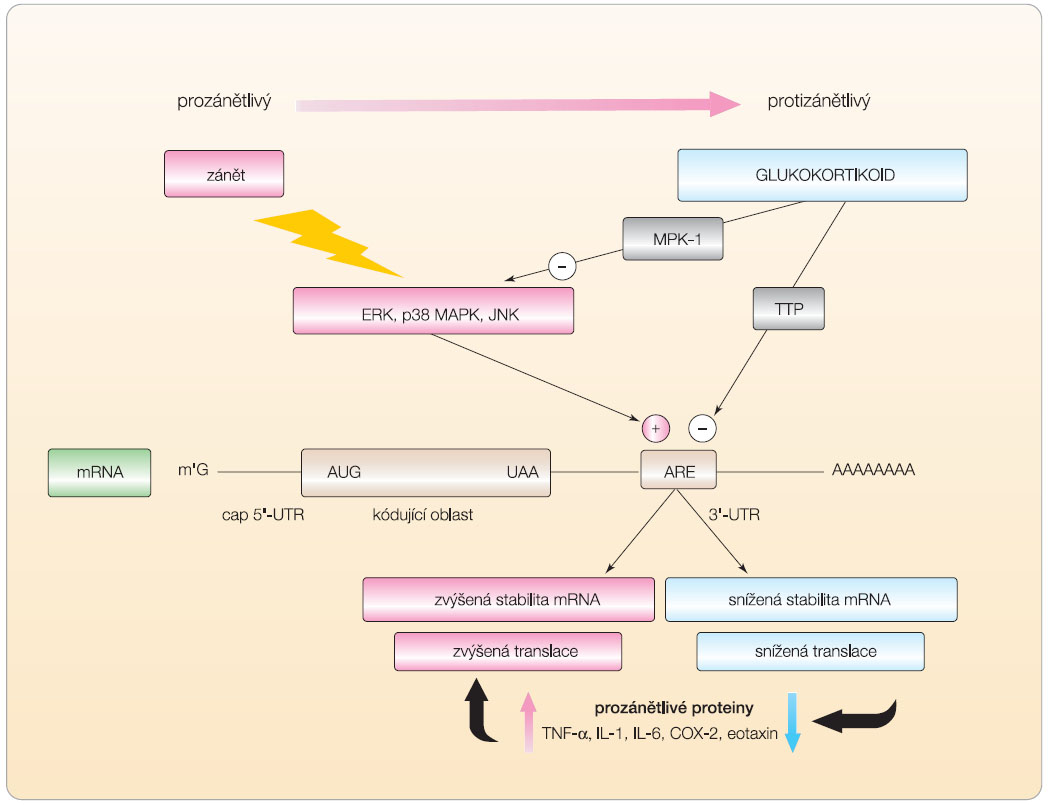 V pokuse na myším modelu se TTP váže na ARE uvnitř mRNA, které kódují TNF-α a GM-CSF. Po vazbě TTP je destabilizována mRNA a snížena tvorba obou cytokinů. Fosfoproteiny a nukleocytoplazmatické přestupující proteiny mohou působit jinak než na úrovni kontroly transkripce genů. Členové TTP rodiny by mohli být schopni regulovat mRNA s krátkým poločasem života obsahující nestabilní motivy bohaté na adenylát/uridylát. Stabilita některých prozánětlivých genů je určována regulací ARE, na něž se vážou proteiny HuR a TTP [18, 19].
V pokuse na myším modelu se TTP váže na ARE uvnitř mRNA, které kódují TNF-α a GM-CSF. Po vazbě TTP je destabilizována mRNA a snížena tvorba obou cytokinů. Fosfoproteiny a nukleocytoplazmatické přestupující proteiny mohou působit jinak než na úrovni kontroly transkripce genů. Členové TTP rodiny by mohli být schopni regulovat mRNA s krátkým poločasem života obsahující nestabilní motivy bohaté na adenylát/uridylát. Stabilita některých prozánětlivých genů je určována regulací ARE, na něž se vážou proteiny HuR a TTP [18, 19].
Shrnutí
Seznam použité literatury
- [1] Kazuhiro I, Chung KF, Adcock IM. Upadate on glucocorticoid action and resistence. J Allergy Clin Immunol 2006; 117: 522–543.
- [2] Barnes PJ, Adcock IM. How do corticosteroids work in asthma? Ann Intern Med 2003; 139: 359–370.
- [3] Rhen T, Cidlowski JA. Antiinflammatory action of glucocorticoids – new mechanisms for old drugs. N Engl J Med 2005; 353: 1711–1723.
- [4] Adcock IM, Barnes PJ. Molecular mechanisms of corticosteroid resistence. Chest 2008; 134: 394–401.
- [5] Huang ZQ, Li J, Sachs LM, et al. A role for cofactor-cofactor and cofactor-histone interactions in targeting p300, SWI/SNF and mediator for transcription. EMBO J 2003; 22: 2146–2155.
- [6] Kastel O, Herrlich P. Crosstalk between the glucocorticoid receptor and other transcription factors: molecular aspects. Mol Cell Endocrinol 2007; 275: 13–29.
- [7] Hermoso MA, Matsuguchi T, Smrak K, Cidlowski JA. Glucocorticoids and tumor necrosis factor alpha cooperatively regulate toll-like receptor 2 gene expression. Mol Cell Biol 2004; 24: 743–756.
- [8] Mittelstadt PR, Ashwell JD. Inhibition of AP-1 by the glucocorticoid inducible protein GILZ. J Biol Chem 2001; 276: 29603–29610.
- [9] Kastel O, Sancono A, Kratzschmar J, et al. Glucocorticoids inhibic MAPkinase via increased expression and decreased degradation of MKP-1. EMBO J 2001; 20: 7108–7116.
- [10] Cao W, Bao C, Padalko E, Lowenstein CHJ. Acetylation of mitogen-activated protein kinase phosphatase-1 inhibits Toll-like receptor signaling. J Exp Med 2008; 205: 1491–1503.
- [11] Li L, Chen S-F, Liu Y. MAPkinase phosphatase 1, a critical negative regulator of the innate immune response. Int J Clin Exp Med 2009; 2: 48–67.
- [12] Chen L, Fischle W, Verdin E, Greene WC. Duration of nuclear NF-kB action regulated by reversible acetylation. Science 2001; 293: 1653–1657.
- [13] Bannister AJ, Kouzarides T. Reversing histone methylation. Nature 2005; 436: 1103–1106.
- [14] Stellato C. Post-transcriptional and nongenomic effects of glucocorticoids. Proc Am Thorac Soc 2004; 1: 255–263.
- [15] Guhaniyogi J, Brewer G. Regulation of mRNA stability in mammalian cells. Gene 2001; 265: 11–23.
- [16] Shim J, Karin M. The control of mRNA stability in response to extracellular stimuli. Mol Cells 2002; 14: 323–331.
- [17] Ishmael FT, Fang X, Galdiero MR, et al. Role of the RNA-binding protein tristetraprolin in glucocorticoid-mediated gene regulation. J Immunol 2008; 180: 8342–8353.
- [18] Casolaro V, Fang X, Tancowny B, et al. Posttranscriptional regulation of IL-13 in T cells: role of the RNA-binding protein HuR. J Allergy Clin Immunol 2008; 121: 835–839.
- [19] Jalonen U, Lahti A, Korhonen R, et al. Inhibition of tristetraprolin expression by dexamethasone in activated macrophages. Biochem Pharmacol 2005; 69: 733–740.