Současné možnosti antiretrovirové léčby
Souhrn:
Vývoj antiretrovirové léčby představuje jeden z nejdynamičtějších evolučních procesů v historii medicíny. Léčba infekce HIV (human immunodeficiency virus, virus lidského imunodeficitu) vedla k dramatickému snížení morbidity a mortality a transformovala toto onemocnění v typicky chronický, léčbou ovlivnitelný stav. Podle aktuálních doporučení je antiretrovirová léčba indikována u všech jedinců infikovaných HIV, bez ohledu na výchozí počet CD4+ lymfocytů, ke snížení rizika progrese nemoci a k prevenci přenosu infekce HIV. Pro klinickou praxi je v současné době schváleno 25 virostatik ze šesti skupin, které se liší mechanismem účinku. Nové léčebné režimy jsou účinnější, bezpečnější a jsou podstatně lépe tolerovány než režimy starší. Tam, kde je to možné, se obecně doporučuje upřednostňovat fixní kombinační léčbu, což zvýší adherenci a sníží riziko virologického selhání. Za nejdůležitější ukazatel hodnotící odpověď na léčbu a účinnost léčby jsou jednoznačně považovány plazmatická viremie a dosažení konstantní virové suprese. V současné době je infekce HIV díky účinné léčbě považována za chronické onemocnění, při němž je možné udržet vysokou kvalitu života s očekávanou délkou, která se podstatně neliší od obecné populace.
Key words: HIV – antiretroviral therapy – viraemia – simplification.
Summary:
Development of antiretroviral therapy represents one of the most dynamic evolutionary processes in the history of medicine. Treatment of HIV infection has led to a dramatic reduction of morbidity and mortality and transformed the disease into a chronic, treatment manageable disease. According to the current guidelines, antiretroviral therapy is indicated for all HIV infected individuals, regardless of the number of CD4+ lymphocytes, to reduce the risk of disease progression and to prevent HIV transmission. Currently, 25 antiviral agents of six groups which differ in mechanisms of action are approved in clinical practice. New treatment regimens are more effective, safer, and much better tolerated than older regimens. Generally, it is recommended to favour (whenever possible) the co formulations of multiple drugs in a single tablet regimen, thus increasing adherence and reducing the risk of virologic failure. Undetectable viraemia and achieving consistent viral suppression are considered the most important parameters evaluating the response and the effect of the treatment. Currently, HIV infection is viewed as a chronic disease that can be effectively treated, maintaining a high quality of life with life expectancy that does not differ significantly from that in the general population.
Úvod
Vývoj antiretrovirové léčby (antiretroviral therapy, ART) představuje jeden z nejdynamičtějších evolučních procesů v historii medicíny. Na málokterou oblast bylo soustředěno tolik pozornosti, díky které se v krátkém čase podařilo dosáhnout přelomových výsledků a mimořádného pokroku [1]. Antiretrovirová léčba vedla k dramatickému snížení morbidity a mortality v důsledku infekce virem lidského imunodeficitu (human immunodeficiency virus, HIV) a transformovala toto onemocnění na typicky chronický, léčbou ovlivnitelný stav. Nová léčiva nabízejí nové mechanismy účinku, vykazují vysokou aktivitu i proti rezistentním virovým izolátům a mají výhodné dávkování a dobrou toleranci. Kromě toho je léčba jedinců infikovaných HIV velmi účinným prostředkem prevence přenosu HIV [2–5].
Nicméně u vysokého procenta infikovaných osob se stále nedaří dosáhnout náležité virové suprese. Většinou je to zapříčiněno dosud nediagnostikovanou infekcí HIV, nedostatečným dodržováním léčebného režimu, nebo dokonce odmítáním léčby. Navzdory nepochybnému úspěchu, jehož bylo dosaženo v léčbě a prevenci infekce HIV, z celosvětového hlediska vedou ekonomické a sociální bariéry k dalšímu šíření infekce a k pokračující pandemii onemocnění [3,5].
Indikace k zahájení antiretrovirové léčby
Virus lidského imunodeficitu způsobuje pokles imunity, který je charakterizován snížením počtu CD4+ lymfocytů. Závažnost klinických komplikací a jejich četnost, včetně úmrtí, narůstá s klesajícím počtem těchto buněk v periferní krvi. Řadu let bylo obecně akceptovanou praxí odkládání zahájení ART u asymptomatických pacientů až do výskytu prvních klinických příznaků. Kritéria pro zahájení ART byla na základě observačních studií během let posouvána do časnějších stadií. Jednotlivá doporučení se však opírala o studie různé kvality a obecný názor nebyl zcela konzistentní.
Jednoznačnou odpověď poskytla až multicentrická randomizovaná studie Strategic Timing of Antiretroviral Therapy (START), jejíž výsledky byly oficiálně prezento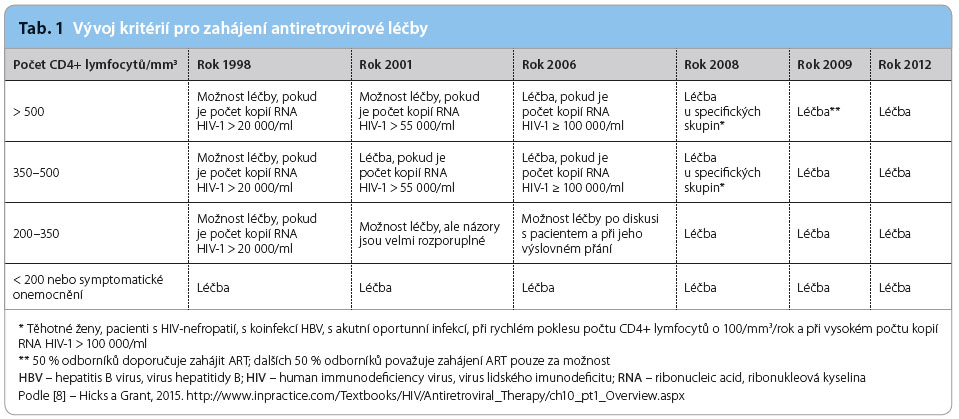 vány v prestižním odborném časopisu New England Journal of Medicine 27. srpna tohoto roku. První zprávy o výsledcích této přelomové studie se odborná veřejnost dověděla na internetových portálech již v květnu a červnu 2015. Po dobu tří let bylo sledováno 4 685 pacientů z 215 pracovišť 35 zemí. Ve studii byl statisticky prokázán jednoznačný přínos časného zahájení ART i u pacientů asymptomatických s vysokým absolutním počtem CD4+ lymfocytů vyšším než 500 buněk/mm3, a to v četnosti výskytu jak onemocnění definujících AIDS (acquired immune deficiency syndrome – syndrom získaného imunodeficitu), tak onemocnění nedefinujících AIDS. Nebyla zaznamenána ani vyšší míra výskytu nežádoucích účinků spojených s ART [6].
vány v prestižním odborném časopisu New England Journal of Medicine 27. srpna tohoto roku. První zprávy o výsledcích této přelomové studie se odborná veřejnost dověděla na internetových portálech již v květnu a červnu 2015. Po dobu tří let bylo sledováno 4 685 pacientů z 215 pracovišť 35 zemí. Ve studii byl statisticky prokázán jednoznačný přínos časného zahájení ART i u pacientů asymptomatických s vysokým absolutním počtem CD4+ lymfocytů vyšším než 500 buněk/mm3, a to v četnosti výskytu jak onemocnění definujících AIDS (acquired immune deficiency syndrome – syndrom získaného imunodeficitu), tak onemocnění nedefinujících AIDS. Nebyla zaznamenána ani vyšší míra výskytu nežádoucích účinků spojených s ART [6].
Vývoj kritérií pro zahájení ART uvádí tab. 1.
Podle aktuálních doporučení americké státní instituce Department of Health and Human Services (DHHS) a společnosti International AIDS Society (IAS) je ART doporučena pro všechny osoby infikované HIV, bez ohledu na výchozí počet CD4+ lymfocytů, ke snížení rizika progrese nemoci a k prevenci přenosu infekce HIV [3,4].
Primárním cílem ART je snížení vysoké morbidity a mortality, které jsou přímým následkem tohoto infekčního onemocnění. Antiretrovirová léčba vedená v intencích nejmodernější farmakoterapie navozuje inhibici replikace HIV, což vede k virové supresi s počtem kopií ribonukleové kyseliny (RNA) HIV‑1 pod úroveň detekovatelnosti v plazmě a k regeneraci imunologických funkcí infikovaného jedince. Klinickým důsledkem je zlepšení kvality života, prodloužení života a signifikantně nižší riziko vzniku tzv. nemocí a stavů definujících, ale také nedefinujících AIDS [3].
Míra regenerace imunitního systému a počtu CD4+ lymfocytů je v přímé korelaci s počtem CD4+ lymfocytů v době zahájení ART. U mnoha infikovaných osob, u kterých je zahájena ART při počtu CD4+ lymfocytů nižším než 350/mm3, není ani po více než šesti letech léčby dosaženo počtu CD4+ lymfocytů vyššího než 500/mm3 [7]. Neléčená infekce HIV s nekontrolovanou viremií má za následek signifikantně vyšší výskyt nemocí nedefinujících AIDS, jako jsou kardiovaskulární komplikace, onemocnění ledvin či jater, neurologické komplikace, vyšší výskyt malignit, a nekompromisně vyúsťuje ve fatální fázi AIDS [3,4].
Přehled skupin antiretrovirových léčiv a mechanismů jejich účinku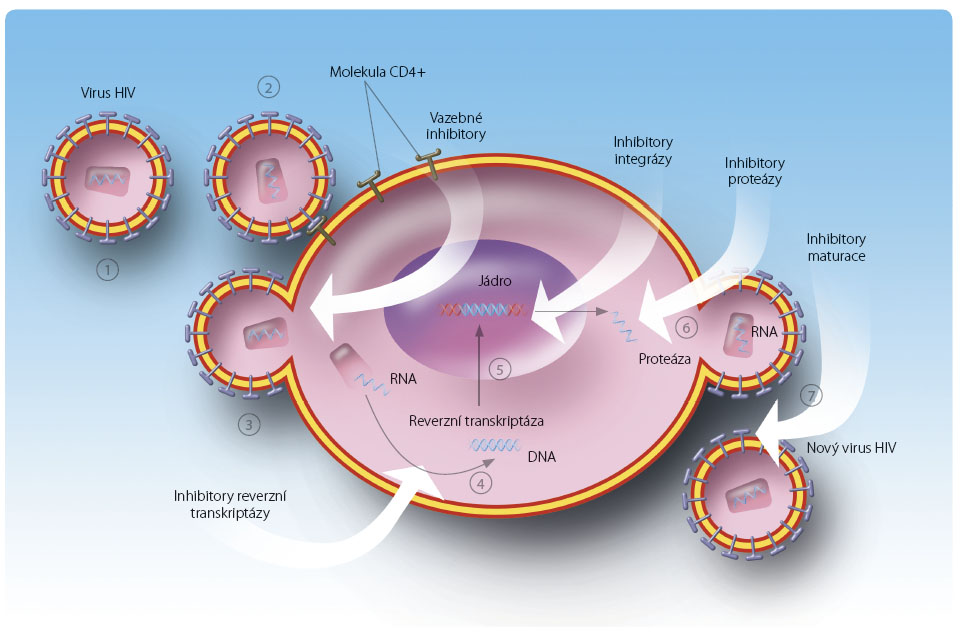
Jednotlivá antiretrovirová léčiva blokují různá místa replikačního cyklu HIV nebo některé receptory hostitelských cílových buněk (obr. 1). Pro klinickou praxi je v současné době schváleno 25 virostatik s antiretrovirovou aktivitou ze šesti skupin, které se liší mechanismem účinku. V tomto kontextu musíme počítat ještě se dvěma látkami, jejichž výhradním úkolem je zlepšení farmakokinetického profilu některých antiretrovirotik [3,8].
Přehled jednotlivých skupin antiretrovirotik uvádí tab. 2.
Nukleosidové/nukleotidové inhibitory reverzní transkriptázy (nucleoside/nucleotide reverse transcriptase inhibitor – NRTI/NtRTI)
Cílovým místem NRTI a NtRTI je první ze tří klíčových enzymů replikačního cyklu HIV – reverzní transkriptáza [8].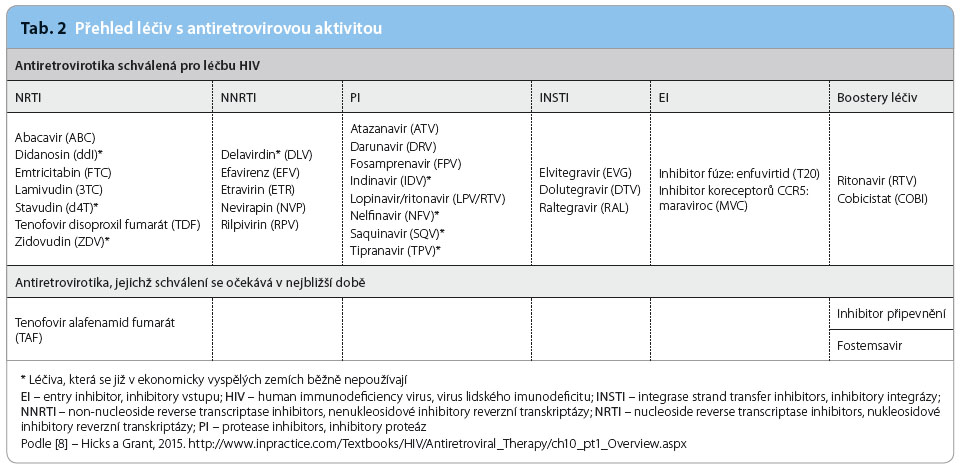
Léčiva této skupiny jako falešné prekursory kompetují s fyziologickými nukleosidy. Místo přirozených nukleosidů – adenosinu, guanosinu, cytidinu a thymidinu – jsou reverzní transkriptáze předloženy báze „falešné“ – látky, které se sice do vznikajícího řetězce deoxyribonukleové kyseliny (DNA) inkorporují, ale zastaví jeho prodlužování, a tím zablokují vznik funkční molekuly DNA [9].
Nukleosidové/nukleotidové inhibitory reverzní transkriptázy jsou silnými inhibitory replikace HIV a tvoří významnou součást většiny léčebných režimů. Zdokonalováním těchto léčiv bylo postupně dosaženo snížení účinné dávky i výskytu nežádoucích účinků (myelotoxicita, hepatotoxicita, laktátová acidóza, polyneuropatie, pankreatitida, gastrointestinální obtíže atd.). Nežádoucím účinkem při dlouhodobém užívání NRTI je však mitochondriální toxicita [1].
Nenukleosidové inhibitory reverzní transkriptázy (non‑nucleoside reverse transcriptase inhibitor – NNRTI)
Cílovým vazebným místem těchto léčiv je rovněž reverzní transkriptáza, ke které se na rozdíl od NRTI váží přímo, nikoli kompetitivně, mimo vazebné místo nukleosid‑reverzní transkriptázy. Nenukleosidové inhibitory reverzní transkriptázy 2. generace jsou diarylpyrimidiny (DAPY) a mají specifický rezistenční a toleranční profil. Diarylpyrimidiny jsou molekuly podobné pyrimidinovým nukleotidům v DNA. Nejsilnější stránkou inhibitorů DAPY je zejména jejich konformační flexibilita a adaptabilita. Inhibitory DAPY se mohou vázat na reverzní transkriptázu v různých prostorových konformacích. Tato jejich schopnost umožňuje změny pozice a změny orientace strategicky důležitých chemických vazeb. Torzní pružnost usnadňuje inhibitorům DAPY provádět různé změny pozice a změny orientace v hydrofobní kapse reverzní transkriptázy [10,11]. Tyto změny následně vedou ke změnám konformace reverzní transkriptázy, čímž ztrácí svoji účinnost, dochází k inhibici katalýzy virové RNA na DNA a rychlost replikace HIV‑1 se sníží [12–14]. Nenukleosidové inhibitory reverzní transkriptázy jsou metabolizovány enzymatickým systémem cytochromu P450, což představuje možnost určitých komplikací, zejména při souběžné medikaci. Jistá úskalí jsou spojena s poměrně snazším vznikem rezistence a s nežádoucími účinky na CNS [1].
Inhibitory proteázy
Nově vzniklé polyproteiny HIV se shromažďují na plazmatické membráně hostitelské buňky, kde vytvářejí novou virovou částici. Při zrání nových virových částic a jejich uvolňování z buňky se uvnitř polyproteinů aktivuje virová proteáza, která je dalším klíčovým enzymem nezbytným pro replikační cyklus HIV. Reverzní transkriptáza štěpí zbytek polyproteinu za vzniku všech strukturních proteinů a replikačních enzymů viru (včetně reverzní transkriptázy, integrázy a samotné proteázy). Teprve po proteolytickém štěpení získává jádro viru svůj charakteristický tvar a virus je plně infekční. Aktivita virové proteázy je naprosto nezbytná pro virulenci viru [9].
První inhibitory proteázy byly schváleny pro léčbu HIV v roce 1996. Již jeden rok po zavedení prvních z nich významně klesla mortalita, výrazně se snížil počet pacientů, u nichž onemocnění postoupilo do nejrozvinutější fáze syndromu AIDS, a významně poklesla incidence smrtelných oportunních infekcí. Kombinovanými režimy s inhibitory proteázy se podařilo snížit virovou replikaci pod detekovatelnou hodnotu, měřenou počtem kopií RNA HIV‑1 na 1 ml periferní krve (plazmatickou viremií, virovou náloží) [15]. Inhibitory proteázy jsou metabolizovány také enzymatickým systémem P450, což vytváří potenciál pro řadu lékových interakcí. Mezi inhibitory proteázy se často objevuje zkřížená rezistence a jsou spojeny se vznikem lipodystrofického syndromu, s metabolickými alteracemi, týkajícími se zejména lipidového spektra, a s nežádoucími gastrointestinálními příznaky [1].
Inhibitory integrázy (integrase strand transfer inhibitor – INSTI)
Třetí enzym – virová integráza – začleňuje virovou RNA již ve formě DNA do hostitelského genomu. Inhibitory integrázy blokují proces integrace virové DNA. Vzhledem k selektivnímu účinku na virovou integrázu, která se nevyskytuje v lidských buňkách, jsou tyto látky výborně tolerovány a nežádoucí účinky vyvolávají výjimečně [1,8]. Inhibitory integrázy navozují velmi rychlou virovou supresi, rychlejší než ostatní skupiny antiretrovirových léčiv. O závažnějších nežádoucích účincích při jejich dlouhodobém podávání zatím chybějí relevantní informace, poznatky a zkušenosti [16].
Inhibitory vstupu (entry inhibitor – EI)
Na rozdíl od předcházejících skupin léčiv s antiretrovirovou aktivitou neinhibují inhibitory vstupu životní cyklus HIV intracelulárně, ale interferují s HIV v nejčasnějších fázích jeho replikace, ještě před jeho vstupem do hostitelské buňky.
Zatím jediným zástupcem této skupiny antiretrovirových chemoterapeutik je enfuvirtid (inhibitor fúze). Enfuvirtid (T20) se extracelulárně kompetitivně váže na část virového glykoproteinu gp41, proces fúze se zastaví a virová RNA nemůže vstoupit do cílové buňky [17].
Léčivo je třeba podávat subkutánně ve dvou denních dávkách. Vzhledem k této nevýhodné formě aplikace platí v současné době obecný konsensus nahrazovat T20 v léčebných režimech jiným léčivem s pohodlnějším způsobem podávání [8].
Inhibitory koreceptorů CCR5
Kromě receptorů CD4 využívá virus při svém vstupu do hostitelské buňky chemokinové koreceptory. Nejvýznamnější z nich jsou koreceptory CCR5 a CXCR4. Maraviroc je od roku 2009 prvním a rovněž zatím jediným léčivem schopným blokovat koreceptor CCR5. Indukuje změnu konformace CCR5, která zablokuje vazbu mezi virovým povrchovým receptorem gp120 a receptorem CD4 na povrchu hostitelské buňky. Je určen k léčbě pacientů infikovaných virem HIV s CCR5‑tropními virovými populacemi [18].
Látky optimalizující farmakokinetické vlastnosti některých antiretrovirotik
Ritonavir je inhibitor proteáz, který byl původně v plné terapeuticky účinné dávce součástí kompletních antiretrovirových režimů. Pro řadu nežádoucích účinků v této indikaci a dávce se již nepoužívá. Dnes se uplatňuje výhradně v malé dávce jako „booster“ k optimalizaci farmakokinetiky dalších inhibitorů proteáz podávaných v doporučených terapeutických dávkách [19].
Cobicistat je specifický silný inhibitor enzymů CYP3A, který zlepšuje farmakokinetické vlastnosti některých léčiv a nevykazuje žádnou aktivitu vůči HIV [20].
Přehled jednotlivých skupin antiretrovirotik uvádí tab. 2.
Volba antiretrovirových režimů
Antiretrovirový režim spočívá v kombinaci nejméně tří virostatik s antiretrovirovou aktivitou alespoň ze dvou různých skupin. Nové antiretrovirové režimy jsou účinnější, bezpečnější a jsou podstatně lépe tolerovány než režimy starší. Tam, kde je to možné, se obecně doporučuje volit přednostně kombinaci několika léčiv v jedné tabletě.
Iniciální režim ART pro dosud neléčeného pacienta je obvykle tvořen dvěma NRTI (abacavir + lamivudin) nebo jedním NRTI + jedním NtRTI (emtricitabin + tenofovir disoproxil fumarát) a třetím aktivním léčivem z jiné volitelné skupiny (INSTI, NNRTI, inhibitor proteáz + farmakokinetický „booster“). Klinické studie i retrospektivní sledování léčených pacientů ukazují, že v naprosté většině případů vede taková strategie iniciálního léčebného režimu k poklesu počtu kopií RNA HIV v plazmě a ke vzestupu počtu CD4+ lymfocytů [21–23]. Prokázaná vysoká účinnost inhibitorů integrázy, jejich vynikající bezpečnostní profil, minimum nežádoucích účinků a velmi dobrá tolerance jednoznačně vedly k tomu, že tato léčiva zaujala prioritní pozici mezi doporučovanými antiretrovirovými režimy. Pro svoji vysokou rezistenční bariéru je v rámci doporučených režimů nejnověji uváděn jediný inhibitor proteáz potencovaný ritonavirem – darunavir; představuje volbu pro pacienty, u nichž primárně hrozí nebezpečí nižší adherence a vyšší riziko virologického selhání [3].
Alternativní a jiné režimy jsou takové, které mají určité potenciální nevýhody, nebo ty, o jejichž účinku v určitých situacích je k dispozici méně dat z klinických studií. Za jistých okolností v závislosti na individuálních charakteristikách pacienta a na potřebě může být alternativní režim pro konkrétního pacienta režimem preferovaným a optimálním. Léčebné kombinace umožňují podávat, vedle již uvedených léčiv, zidovudin, NNRTI a ostatní inhibitory proteázy potencované ritonavirem nebo maravirok [3].
Strategie dvou NRTI nebo jednoho NRTI + jednoho NtRTI a třetího aktivního léčiva z jiné volitelné skupiny nemusí být vhodná a optimální pro všechny pacienty. V některých případech nelze podávat tenofovir disoproxil fumarát ani abacavir. To platí zejména u pacientů s preexistujícím renálním postižením, s pozitivní alelou HLA‑B*5701 nebo u nemocných s vysokým kardiovaskulárním rizikem. Proto jsou některé iniciální (tzv. NRTI‑šetřicí) režimy sestavovány bez tenofovir disoproxil fumarátu a abacaviru nebo obecně bez jakéhokoli antiretrovirotika ze skupiny NRTI či NtRTI [3,24–27].
Vznik rezistence nebo částečné rezistence, toxicita, intolerance či jiné nežádoucí účinky mohou významně zúžit škálu léčiv vhodných pro trojkombinační či vícekombinační režimy. V takových mezních situacích je lékař nucen volit nekonvenční kombinace, které nelze předem definovat. Nežádoucí účinky ART při dlouhodobém (celoživotním) užívání léčiv nejsou dostatečně definovány a zatím není k dispozici náležité množství relevantních údajů exaktně objasňujících tyto fenomény. Nezbytnou podmínkou je velmi pečlivé sledování účinků nejen z hlediska virové suprese, ale také z hlediska možných nežádoucích účinků konkrétní léčebné kombinace [1,3].
Simplifikace léčebných režimů
Antiretrovirová léčba je v současné době jednoznačně chápána a akceptována jako léčba celoživotní [3]. Možnost  uplatnění plného léčebného potenciálu antiretrovirových léčiv souvisí nejen s otázkou jejich účinnosti a bezpečnosti, ale také s otázkou složitosti, či spíše jednoduchosti příslušných antiretrovirových režimů [28]. Výsledky několika retrospektivních analýz ukázaly, že jednodušší léčebný režim vede k lepší adherenci než režimy složitější [29]. Soustavným zjednodušováním antiretrovirových režimů v posledních deseti letech bylo dosaženo menšího počtu tablet a denních dávek, nižšího rizika krátkodobé i dlouhodobé toxicity léčiv a v konečné fázi také zlepšení adherence [30]. Důsledkem tohoto vývoje je zřetelný pokles počtu případů selhání léčebné strategie [31,32].
uplatnění plného léčebného potenciálu antiretrovirových léčiv souvisí nejen s otázkou jejich účinnosti a bezpečnosti, ale také s otázkou složitosti, či spíše jednoduchosti příslušných antiretrovirových režimů [28]. Výsledky několika retrospektivních analýz ukázaly, že jednodušší léčebný režim vede k lepší adherenci než režimy složitější [29]. Soustavným zjednodušováním antiretrovirových režimů v posledních deseti letech bylo dosaženo menšího počtu tablet a denních dávek, nižšího rizika krátkodobé i dlouhodobé toxicity léčiv a v konečné fázi také zlepšení adherence [30]. Důsledkem tohoto vývoje je zřetelný pokles počtu případů selhání léčebné strategie [31,32].
Kombinace s fixními dávkami dvou léčiv byly prvním zjednodušením, které snížilo riziko selhání léčby a vzniku částečné adherence [33]. Nejvyšším stupněm zjednodušení jsou fixní kombinace všech nezbytných složek daného léčebného režimu pro celou denní dávku, které se označují jako jednotabletové režimy (single‑tablet regimen) [34,35]. Aktuálně dostupné přípravky pro fixní kombinační léčbu uvádí tab. 3.
Hodnocení účinnosti antiretrovirové léčby
Počet CD4+ lymfocytů byl déle než 20 let považován za zásadní ukazatel předpovídající progresi onemocnění, pravděpodobnou dobu přežití a nutnost profylaxe oportunních infekcí a sledující odpověď na ART [36]. Řada studií ukazuje, že sledování počtu CD4+ lymfocytů poskytuje poměrně malou přidanou hodnotu v případě, že je dostupný monitoring plazmatické viremie a pacient vykazuje výbornou virovou supresi [37,38].
Plazmatická viremie je přesnějším ukazatelem virologického selhání a obvykle je zjistitelná dříve, než se vyskytnou imunologické a klinické příznaky. Je také signálem pro nutnost větší adherence a provedení testu rezistence.
Optimální virová suprese je definována jako konstantní plazmatická viremie udržující počet kopií RNA HIV pod úrovní detekovatelnosti, tj. počet kopií RNA HIV nižší než 20–75/ml v závislosti na použitém testu [39]; AIDS Clinical Trials Group (ACTG) definuje virologické selhání jako potvrzený počet kopií RNA HIV vyšší než 200 na 1 ml plazmy [40].
Za nejdůležitější ukazatel pro hodnocení odpovědi na ART a účinnost této léčby je v současné době jednoznačně považována plazmatická viremie a dosažení konstantní virové suprese. Cílem účinné ART je dosažení počtu kopií RNA HIV‑1 pod úrovní detekovatelnosti za 12–24 týdnů od zahájení ART. Výchozí plazmatická viremie, při níž je zahájena ART, může ovlivnit dobu potřebnou k navození virologické odpovědi. Některé režimy jsou schopny navodit virovou supresi rychleji než režimy jiné [3].
Informace o počtu CD4+ lymfocytů má zásadní význam v době zahájení pravidelného sledování pacienta k určení naléhavosti ART a profylaxe oportunních infekcí. Po zahájení ART indikuje sledování absolutního počtu CD4+ lymfocytů vhodnou dobu přerušení a ukončení profylaxe oportunních infekcí. U stabilizovaných pacientů ustupuje význam systematického stanovování absolutního počtu CD4+ lymfocytů do pozadí a sledování jiných subpopulací CD lymfocytů (např. CD8 nebo CD19) se již rutinně nedoporučuje [3,36].
Ambiciózní cíle směřují k představě léčebné strategie, která by vedla k eradikaci HIV v lidském organismu. Základní výzkum ukazuje, že tento problém je neobyčejně složitý a komplexní; HIV‑1 například vytváří perzistující rezervoár latentně infikovaných buněk s dlouhým poločasem, který za určitých okolností může aktivovat virovou replikaci a produkovat kompletní infekční viriony. Pool latentně infikovaných CD4+ lymfocytů vzniká již v nejčasnějších fázích akutní infekce HIV, má dlouhý poločas a přetrvává navzdory prolongované supresi plazmatické viremie [41–43]. Předpokládá se, že tento rezervoár je 40–50krát větší, než se původně odhadovalo [44,45]. Kompartment krevních elementů obsahuje přibližně pouze 2 % všech lymfocytů, které jsou v lidském těle a mohou být infikovány HIV [46]. Různé tkáně vykazují různou míru penetrace antiretrovirových léčiv, čímž se tyto anatomické bariéry stávají bariérou účinné léčby. Řada dalších virologických, imunologických i klinických faktorů limituje potenciál současných terapeutických možností, jak zasáhnout větší podíl buněčných populací a kompartmentů [47].
Závěr
Účinnost ART je nezpochybnitelná. Díky účinné léčbě je nyní infekce HIV považována za chronické onemocnění, při němž je možné udržet vysokou kvalitu života s očekávanou délkou, která se podstatně neliší od kvality a délky života u obecné populace [48,49].
Výzkum onemocnění HIV a vývoj nových léčiv je dynamický a rychlý. Odborná doporučení jsou každoročně aktualizována. Přesto je nutné s mimořádnou naléhavostí vždy zdůraznit, že žádné doporučení není univerzálně platným dogmatem, ale že konkrétní antiretrovirový režim pro konkrétního pacienta musí být sestaven pokud možno co nejvíce podle individuálních charakteristik nemocného [1].
Seznam použité literatury
- [1] Hoffmann C. Overview of antiretroviral agents. In: Hoffmann C, Rockstroh JK. HIV 2012/2013. Hamburg: Medizin Fokus Verlag, 2012; 60–110.
- [2] Cohen MS, Chen YQ, McCauley M, et al. Prevention of HIV 1 infection with early antiviral therapy. N Engl J Med 2011; 365: 493–505.
- [3] Guidelines for the Use of Antiretroviral Agents in HIV 1 Infected Adults and Adolescents. April 8, 2015. Developed by the DHHS Panel on Antiretroviral Guidelines for Adults and Adolescents – A Working Group of the Office of AIDS Research Advisory Council (OARAC). Available from: htt-ps://aidsinfo.nih.gov/guidelines/html/1/adult and adolescent treatment guidelines/.
- [4] Günthard HF, Aberg JA, Eron JJ, et al. Antiretroviral treatment of adult HIV infection: 2014 recommendations of the International Antiviral Society USA Panel. JAMA 2014; 312: 410–425.
- [5] Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection. World Health Organization Publication 2013. Available from: http://www.who.int/hiv/pub/guidelines/arv2013/.
- [6] Lundgren JD, Babiker AG, Gordin F, et al. Initiation of Antiretroviral Therapy in Early Asymptomatic HIV Infection. The INSIGHT START Study Group. N Engl J Med 2015; 373: 795–807.
- [7] Moore RD, Keruly JC. CD4+ cell count 6 years after commencement of highly active antiretroviral therapy in persons with sustained virologic suppression. Clin Infect Dis 2007; 44: 441–446.
- [8] Hicks CB, Grant P: Agents used in antiretroviral therapy. In: Eron JJ, Kuritykes DR, Squires KE. InPractice HIV. Last Reviewed: 9/23/2015. Jointly Provided by USF Health and Clinical Care Options, LLC. Available at: http://www.inpractice.com/Textbooks/HIV/Antiretroviral_Therapy/ch10_pt1_Overview.aspx.
- [9] Konvalinka J, Machala L. Terapie AIDS po dvaceti letech. Vesmír 2001; 6: 332–340.
- [10] Miller CD, Crain J, Tran B, et al. Rilpivirine: a new addition to the anti HIV 1 armamentarium. Drugs Today 2011; 47: 5–15.
- [11] Vingerhoets J, Azijn H, Fransen E, et al. TMC125 displays a high genetic barrier to the development of distance: evidence from in vitro selection experiments. J Virol 2005; 79: 12773–1282.
- [12] Ghosn J, Chaix ML, Delaugerre C. HIV 1 resistance to first and second generation non nucleoside reverse transcriptase inhibitors. AIDS Rev 2009; 11: 165–173.
- [13] Chen X, Zhan P, Li D, et al. Recent advances in DAPYs and related analogues as HIV 1 NNRTIs. Curr Med Chem 2011; 18: 359–376.
- [14] Edurant. Summary of Product Characteristics, November 2011. Available at: http://www.medicines.org.uk/EMC/medicine/25490/SPC/Edurant+25+mg/.
- [15] Youle M. Overview of boosted protease inhibitors in treatment experienced HIV infected patients. J Antimicrob Chemother 2007; 60: 1195–1205.
- [16] Eron JJ. Antiretroviral therapy: new drugs, formulations, ideas, and strategies. Top HIV Med 2009; 17: 146–150.
- [17] Machala L. Enfuvirtid. Klin Mikrobiol a inf Lék 2004; 3: 114–117.
- [18] Brumme ZL, Goodrich J, Mayer HB, et al. Molecular and clinical epidemiology of CXCR4 using HIV 1 in a large population of antiretroviral naive individuals. J Infect Dis 2005; 192: 466–474.
- [19] Norvir. Summary of Product Characteristics, September 2015. Available at: http://www.medicines.org.uk/emc/medicine/22952.
- [20] Mathias A, German P, Marray B, et al. Pharmacokinetics and pharmacodynamics of GS 9350: a novel pharmacokinetic enhancer without anti HIV activity. Clin Pharma-col Ther 2010; 87: 322–329.
- [21] Moore RD, Bartlett JG. Dramatic decline in the HIV 1 RNA level over calendar time in a large urban HIV practice. Clin Infect Dis 2011; 53: 600–604.
- [22] Gill VS, Lima VD, Zhang W, et al. Improved virological outcomes in British Columbia concomitant with decreasing incidence of HIV type 1 drug resistance detection. Clin Infect Dis 2010; 50: 98–105.
- [23] Lee FJ, Amin J, Carr A. Efficacy of initial antiretroviral therapy for HIV 1 infection in adults: a systematic review and meta analysis of 114 studies with up to 144 weeks’ follow up. PLOS ONE 2014; 9: e97482. Available at: http://www.ncbi.nlm.nih.gov/pubmed/24830290.
- [24] Cahn P, Andrade Villanueva J, Arribas JR, et al. Dual therapy with lopinavir and ritonavir plus lamivudine versus triple therapy with lopinavir and ritonavir plus two nucleoside reverse transcriptase inhibitors in antiretroviral therapy naive adults with HIV 1 infection: 48 week results of the randomised, open label, non inferiority GARDEL trial. Lancet Infect Dis 2014; 14: 572–580.
- [25] Raffi F, Babiker AG, Richert L, et al. Ritonavir boosted darunavir combined with raltegravir or tenofovir emtricitabine in antiretroviral naive adults infected with HIV 1: 96 week results from the NEAT001/ANRS143 randomised non inferiority trial. Lancet 2014; 384: 1942–1951.
- [26] Taiwo B, Zheng L, Gallien S, et al. Efficacy of a nukleoside sparing regimen of darunavir/ritonavir plus raltegravir in treatment naive HIV 1 infected patients (ACTG A5262). AIDS 2011; 25: 2113–2122.
- [27] Bedimo RJ, Drechsler H, Jain M, et al. The RADAR study: week 48 safety and efficacy of RAltegravir combined with boosted DARunavir compared to tenofo-vir/emtricitabine combined with boosted darunavir in antiretroviral naive patients. Impact on bone health. PLOS ONE 2014; 9: e106221. Available at: http://www.ncbi.nlm.nih.gov/pubmed/25170938.
- [28] Snopková S. Simplifikace – vyšší efektivita antiretrovirové léčby. Klin Mikrobiol a inf Lék 2013; 19: 137–140.
- [29] Gonzalez Garcia J, Cohen D, Johnson M, et al. Short communication: Comparable safety and efficacy with once daily versus twice daily dosing of lopinavir/ritonavir tablets with emtricitabine + tenofovir DF in antiretroviral naive, HIV type 1 infected subjects: 96 week final results of the randomized trial M05 730. AIDS Res Hum Re-troviruses 2010; 26: 841–845.
- [30] Parienti J, Bangsberg D, Verdon R, et al. Better adherence with once daily antiretroviral regimens: a meta analysis. Clin Infect Dis 2009; 48: 484–488.
- [31] Llibre J, Schapiro J, Clotet B. Clinical implications of genotypic resistance to the newer antiretroviral drugs in HIV 1 infected patients with virological failure. Clin Infect Dis 2010; 50: 872–881.
- [32] Cohen CJ, Meyers JL, Davis KL. Association between daily antiretroviral pill burden and treatment adherence, hospitalisation risk, and other healthcare utilisation and cost in a US Medicaid population with HIV. BMJ Open 2013; 3: e003028.
- [33] Llibre J, Arribas J, Domingo P, et al. Clinical implications of fixed dose coformulations of antiretrovirals on the outcome of HIV 1 therapy. AIDS 2011; 25: 1683–1690.
- [34] Llibre J, Clotet B. Once daily single tablet regiments: A long and winding road to excellence in antiretroviral treatment. AIDS Rev 2012; 14: 168–178.
- [35] 15 facts on HIV treatment scale up and new WHO ART guidelines 2013. Available at: http://www.who.int/hiv/pub/guidelines/arv2013/15facts/en/index.html.
- [36] Ford N, Meintjes G, Pozniak A, et al. The future role of CD4 cell count for monitoring antiretroviral therapy. Lancet Infect Dis 2015; 15: 241–247.
- [37] Gale HB, Gitterman SR, Hoffman HJ, et al. Is frequent CD4+ T lymphocyte count monitoring necessary for persons with counts ≥300 cells/μL and HIV 1 suppression? Clin Infect Dis 2013; 56: 1340–1343.
- [38] Girard PM, Nelson M, Mohammed P. Can we stop CD4 testing in patients with HIV 1 RNA suppression on antiretroviral treatment? Analysis of the ARTEMIS trial. AIDS 2013; 27: 2759–2763.
- [39] Havlir DV, Bassett R, Levitan D, et al. Prevalence and predictive value of intermittent vireamia with combination HIV therapy. JAMA 2001; 286: 171–179.
- [40] Ribaudo H, Lennox J, Currier J, et al. Virologic failure endpoint definition in clinical trials: Is using HIV 1 RNA threshold <200 copies/mL better than <50 copies/mL? An analysis of ACTG studies. Paper presented at: 16th Conference on Retroviruses and Opportunistic Infection 2009; Montreal, Canada.
- [41] Dinoso JB, Kim SY, Wiegand AM, et al. Treatment intensification does not reduce residual HIV 1 viremia in patients on highly active antiretroviral therapy. Proc Natl Acad Sci USA 2009; 106: 9403–9408.
- [42] Chun TW, Engel D, Berrey MM, et al. Early establishment of a pool of latently infected, resting CD4+ T cells during primary HIV 1 infection. Proc Natl Acad Sci USA 1998; 95: 8869–8873.
- [43] Siciliano JD, Kajdas J, Finzi D, et al. Long term follow up studies confirm the stability of the latent reservoir for HIV 1 in resting CD4+ T cells. Nat Med 2003; 9: 727–728.
- [44] Brenchley JM, Vinton C, Tabb B, et al. Differential infection patterns of CD4+ T cells and lymphoid tissue viral burden distinguish progressive and nonprogressive lentiviral infections. Blood 2012; 120: 4172–4181.
- [45] Perreau M, Savoye AL, De Crignis E, et al. Follicular helper T cells serve as the major CD4 T cell compartment for HIV 1 infection, replication, and production. J Exp Med 2013; 210: 143–156.
- [46] Cohen J. HIV/AIDS research. Tissue says blood is misleading, confusing HIV cure efforts. Science 2011; 334: 1614.
- [47] Monforte A, Svicher V, Nozza S, et al. Highlights on HIV eradication in 2013. AIDS 2014; 28: 1–7.
- [48] Van Sighem A, Gras L, Reiss P, et al. Life expectancy of recently diagnosed asymptomatic HIV infected patients approaches that of uninfected individuals. AIDS 2010; 24: 1527–1535.
- [49] Nakagawa F, Lodwick RK, Smith CJ, et al. Projected life expectancy of people with HIV according to timing of diagnosis. AIDS 2012; 26: 335–343.