Současné možnosti léčby těžkého astmatu v ČR
Článek pojednává o dostupných možnostech léčby skutečně těžkého astmatu v České republice. Za skutečně těžké je považováno astma, k jehož kontrole nestačí běžně doporučovaná léčba, spočívající dnes především v kombinaci vysokých dávek inhalačních kortikosteroidů a dlouhodobě působících betamimetik. K léčbě těchto nemocných je pak zaváděna dlouhodobá systémová kortikoterapie se všemi nežádoucími důsledky, přičemž u některých astmatiků ani tato léčba nevede ke kontrole jejich nemoci.
Článek systematicky popisuje četné terapeutické možnosti, jak nutnosti systémové kortikoterapie předejít, zabránit nebo ji minimalizovat – s tím, že si konkrétně všímá především reálně dostupných alternativ, jimiž jsou: technicky zdokonalené inhalační systémy, nová generace inhalačních kortikosteroidů, možnosti odstranění steroidní rezistence (nízkodávkový theofylin, nortriptylin, vysokodávkové i.m. steroidy), nová role makrolidů a antileukotrienů, léčebný potenciál léků zaváděných pro terapii CHOPN (tiotropium, indakaterol, roflumilast), anti-IgE léčba, metoda bronchiální termoplastiky, potenciální role imunosupresiv a biologické anti-TNF (tumor necrosis factor) léčby a použití antimykotik.
Úvod
Astma je dnes dobře léčitelným onemocněním. Současný arzenál léčebných možností má potenciál zbavit potíží, resp. dostat pod kontrolu většinu nemocných s astmatem.
Přesto v reálné praxi více než polovina astmatiků nemá svou nemoc pod kontrolou a řada z nich zažívá těžké, někdy až život ohrožující exacerbace [1, 2].
Klíč k řešení tohoto rozporu – tj. rozporu mezi možnostmi a realitou – spočívá v tom, že je třeba zásadně rozlišovat mezi obtížně léčitelným astmatem jako nemocí a obtížně léčitelným astmatikem jako pacientem [3].
Obtížně léčitelné astma (OLA), resp. obtížně léčitelný astmatik v širším smyslu slova totiž zahrnuje dvě skupiny nemocných [1, 4].
Prvou skupinu, v praxi mnohem častější, představují nemocní, kde rozhodujícím důvodem, proč se jejich astma nedaří dostat pod kontrolu, není vlastní tíže nemoci, ale řada rozmanitých příčin spojených s jinými medicínskými i nemedicínskými okolnostmi. Patří sem především nedostatečné dodržování a/nebo nesprávná technika aplikace doporučené preventivní léčby, trvající expozice nepoznaným zevním, často profesním příčinám nemoci, neléčené komorbidity, psychosociální aspekty a řada dalších. Tito pacienti v praxi představují významnou část nemocných s OLA, jedná se o obtížně léčitelné astmatiky v užším slova smyslu. Strategie péče o tyto nemocné spočívá především v důsledném diagnostickém a diferenciálně diagnostickém procesu, v edukaci a ovlivňování komorbidit [1, 3, 4] a není předmětem tohoto článku.
Druhou skupinu představují nemocní se skutečně těžkými formami astmatu, nereagujícími na běžnou léčbu. Tento typ obtížně léčitelného astmatu je dnes v zahraniční literatuře označován jako severe refractory asthma [4] – český ekvivalent těžké refrakterní astma bývá nahrazován pojmem těžké vzdorující astma. Léčba těchto těžkých astmat sui generis vyžaduje dlouhodobé systémové podávání kortikosteroidů a někdy ani touto terapií není dosaženo uspokojivé kontroly. Následující text poukazuje na konkrétní nové možnosti, jak nutnosti systémové kortikoterapie u nemocných s astmatem předejít, zabránit nebo ji minimalizovat.
Současně je vhodné předeslat, že mnohé z uvedených léčebných možností vyžadují bližší fenotypizaci astmatu, nejlépe ve specializovaných centrech pro těžké astma (www.tezke-astma.cz).
Přínos technických zdokonalení inhalačních systémů
Inovace inhalačních systémů směřují k tomu, aby se inhalovaný lék, který opouští inhalační systém, dostal v co největším množství pouze na žádoucí místo určení, tedy do průdušek všeho kalibru. Zvyšuje se tak účinnost inhalovaných léků a snižují se jejich lokální a systémové nežádoucí účinky související s tzv. biologickou dostupností (viz dále u inhalačních kortikosteroidů).
K tomu, aby inhalovaný lék rovnoměrně pronikl do průdušek každého, tedy i drobného kalibru, je potřeba ideální velikosti částic (tzv. respirabilní částice), která se pohybuje v rozmezí 2–5 µm [5, 6]. Nověji se zohledňují ještě ideální aerodynamické parametry, tzv. MMAD (mass median aerodynamic diameter), pohybující se v rozmezí 1,1–4,7 µm [2]. Větší částice, zvláště ty, jejichž velikost přesahuje 10 µm, se deponují již v horních cestách dýchacích a jsou zdrojem lokálních a/nebo systémových nežádoucích účinků. Drobnější částice jsou naopak zpětně vydechnuty. Starší inhalační systémy často produkují velikostně heterogenní aerosoly a zastoupení respirabilních částic (tzv. respirabilní frakce) se u nich pohybuje v průměru kolem pouhých 25 % [2].
U mnoha pacientů s těžkým astmatem je přítomno významné, někdy až dominující postižení malých dýchacích cest (tzv. SAD, small-airway disease) [7–9]. A právě u této skupiny nemocných lze očekávat při použití nových inhalačních systémů s vysokou respirabilní frakcí (> 50 %) [2] největší přínos.
U novějších vlhkých systémů dávkovacích aerosolů vede k většímu zastoupení ideálně malých částic skutečnost, že nově zavedené propelenty – hydrofluoroalkany (HFA) – umožňují, na rozdíl od předchozích freonů, převést léky do roztoku (nejčastěji etanolového). Stabilita velikosti částic je pak zvyšována dalšími technologickými úpravami, např. přidáním netěkavé komponenty (glycerolu) u systému Modulite (JET-Modulite a MDI-Modulite) [2]. Významná u některých nemocných může být rovněž rychlost, s jakou mlžina opouští trysku a jak dlouho se udrží v prostoru. V tomto ohledu dosahuje v současnosti nejlepších parametrů systém Respimat, používající jemnou silikonovou komponentu (v tzv. SMI, soft mist inhaler), která zajišťuje malou rychlost a dlouhou dobu trvání jemné mlžiny, kladoucí menší nároky na koordinaci [9–11].
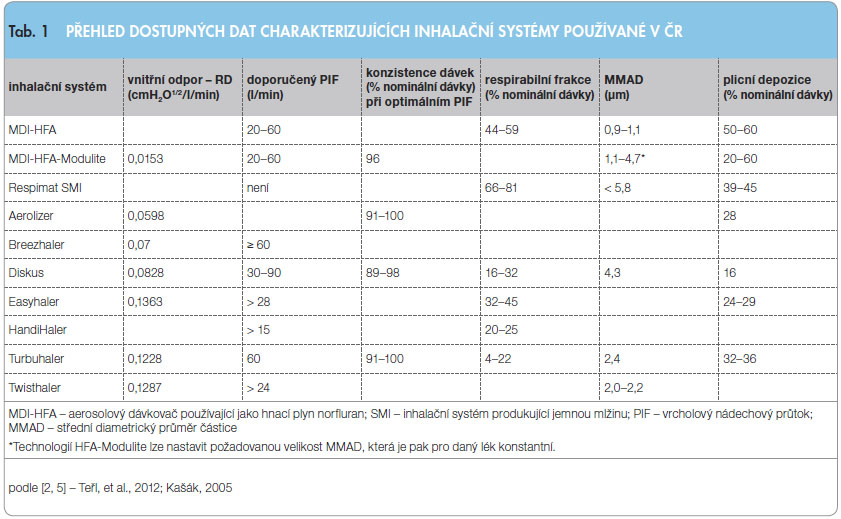 U suchých práškových systémů je vysokého a homogenního zastoupení malých částic dosahováno rovněž především sofistikovanými technickými inovacemi vlastních inhalátorů. Limitujícím u těchto systémů může být u některých nemocných s těžkými formami astmatu vnitřní odpor inhalátorů a s ním související nutná intenzita nádechového úsilí (tzv. PIF, vrcholový nádechový průtok), které musí k řádné inhalaci vyvinout [2, 5]. Přehled dostupných dat charakterizujících inhalační systémy používané v ČR je uveden v tab. 1.
U suchých práškových systémů je vysokého a homogenního zastoupení malých částic dosahováno rovněž především sofistikovanými technickými inovacemi vlastních inhalátorů. Limitujícím u těchto systémů může být u některých nemocných s těžkými formami astmatu vnitřní odpor inhalátorů a s ním související nutná intenzita nádechového úsilí (tzv. PIF, vrcholový nádechový průtok), které musí k řádné inhalaci vyvinout [2, 5]. Přehled dostupných dat charakterizujících inhalační systémy používané v ČR je uveden v tab. 1.
Prostor pro nové inhalační kortikosteroidy
Inhalační kortikosteroidy (IKS) představují základní kámen preventivní léčby většiny nemocných s astmatem. Kortikosteroidy svými efekty potlačují širokou paletu zánětlivých dějů, jsou proto alespoň částečně účinné u téměř všech nemocných [6]. U lehčích forem astmatu, kde jsou užívány nízké a středně vysoké dávky, jsou jednotlivé IKS ve většině klinických situací vzájemně zaměnitelné, pokud jsou respektovány ekvivalentní dávky [2].
Teprve u pacientů s těžkými formami astmatu, kde jsou užívány vysoké dávky IKS, nabývají na významu jejich farmakodynamické/kinetické vlastnosti a dále inhalační systémy a techniky ovlivňující účinnost a zároveň lokální a především systémové nežádoucí účinky. Systémové účinky významně souvisejí s tzv. biologickou dostupností (procentuální část z podané dávky inhalačních kortikosteroidů, která se v aktivní formě může dostat do systémového oběhu) [6]. Z farmakokinetického/dynamického hlediska závisí biologická dostupnost významně na lipofilii, na metabolizaci in situ a při prvém průchodu játry. Zvýšení lipofilie je dosahováno vazbou kortikosteroidní molekuly na estery, z nichž nejlepší lipofilii vykazují propionát a furoát [6]. Systémová dostupnost činí při nazálním (!) podání u starších IKS (beklometason dipropionátu a budesonidu) cca 45 % resp. 35 %, u novějšího flutikason propionátu je to kolem 2 %, nejnovější mometason furoát a ciklesonid mají systémovou dostupnost při nazálním podání pouhých 0,1 % [12]. U ciklesonidu přispívá k nízké systémové dostupnosti rovněž skutečnost, že lék se podává ve formě proléčiva, tj. v málo účinné formě, která je teprve v dolních dýchacích cestách účinkem přítomných esteráz [13] (podobně jako beklometason dipropionát) aktivována na podstatně více účinný des-ciklesonid. Vzhledem k tomu, že v oblasti orofaryngu je aktivita esteráz nízká, nevyvolává ciklesonid lokální nežádoucí účinky (chrapot, kandidózu) ani při vysokých dávkách.
Výskyt lokálních nežádoucích účinků u ostatních IKS významně závisí na konkrétním inhalačním systému a technice [9]. Na tomto místě je vhodné zdůraznit, že u vlhkých aerosolových dávkovačů má v tomto smyslu zásadní přínos důsledné užívání nástavců/spacerů – dnes existují nástavce s pružnou gumovou manžetou, které lze použít pro různé typy náustků (AeroChamber, OptiChamber), existují rovněž inhalační nástavce pro pacienty s tracheostomií (např. AeroTrach). U obou inhalačních systémů, tj. vlhkých i práškových, hraje významnou roli velikost inhalovaných částic. Ta ovlivňuje nejen eventuální výskyt (lokálních) nežádoucích účinků, ale i účinnost IKS – především u těch nemocných, kde dominuje postižení malých dýchacích cest – viz výše.
Nízké dávky perorálního theofylinu a nortriptylin mohou zmírnit kortikorezistenci
Je doloženo, že kortikorezistence není založena na jednom uniformním mechanismu, ale že může být způsobena více molekulárními mechanismy, z nichž pravděpodobně jen některé jsou nám známy [6]. Poznanými mechanismy kortikorezistence jsou: zvýšená exprese odchylných variant glukokortikoidního receptoru, zvýšení aktivity řady prozánětlivých kináz (MAPK, JNK, IKK2, PI3K aj.), zvýšená produkce migračního faktoru z makrofágů a oproti předchozím naopak snížená aktivita (resp. redukovaná exprese) histon-deacetylázy (HDAC2) [13].
O enzymu HDAC2 je již déle známo, že snížení jeho aktivity u pacientů s chronickou obstrukční plicní nemocí (CHOPN) je vyvoláno oxidačním stresem, způsobeným mj. zplodinami kouření. Nověji je prokázáno, že i u řady pacientů s těžkým astmatem je přítomen oxidační stres navozený zde endogenně tvořenými oxidanty [13]. A samozřejmě existují i kouřící (těžcí) astmatici.
Vzniklý oxidační stres snižuje aktivitu a expresi deacetylázy, což vede ke zvýšení acetylace glukokortikoidního receptoru a histonů, které „obalují“ DNA a brání její transkripci. Acetylace (účinkem acetyltransferázy) vede ke změně kortikoidního receptoru do méně aktivní acetylované formy, acetylace histonů vede k rozvinutí chromatinu a k „obnažení“ DNA, z níž se následně mohou přepisovat zánětlivé geny do RNA a následně do aktivních prozánětlivě působících bílkovin [5, 6, 13].
Restaurace aktivity histon-deacetylázy může takto přispět k odstranění a/nebo zmírnění kortikorezistence. Je známo více látek, které dokáží obnovit aktivitu a expresi HDAC2. Z těch, které jsou k praktické dispozici, se jedná o theofylin a nortriptylin [13].
Theofylin ve vyšších dávkách, potřebných k dosažení plazmatické koncentrace 10–20 mg/l, vede k bronchodilataci blokádou fosfodiesterázy (PDE), čímž zvyšuje koncentraci cyklického adenosin-monofosfátu (c-AMP). (Theofylin je neselektivním blokátorem všech typů PDE [6], na rozdíl od roflumilastu, viz dále.) Dávky theofylinu potřebné pro bronchodilataci však u řady pacientů vyvolávají četné nežádoucí účinky a limitují jeho užívání jako bronchodilatátoru [2]. Oproti tomu nízké dávky theofylinu (potřebné k dosažení plazmatické koncentrace 5 mg/l) mají protizánětlivý efekt, který je nezávislý na mechanismu bronchodilatace. Bylo prokázáno, že theofylin selektivně zvyšuje aktivitu HDAC2. Mechanismus tohoto působení je odlišný od bronchodilatačního a je nejspíše způsoben blokací jedné z prozánětlivých kináz (PI3K?) [14].
V klinické praxi tak může být přidání nízkých dávek perorálního theofylinu (200–300 mg/den) ke středně vysokým až vysokým dávkám IKS u pacientů s těžkým astmatem efektivnější než navyšování dávky IKS do maximálních tolerovaných dávek, a to nejen u kuřáků [5].
Nortriptylin (tricyklické antidepresivum) odstraňuje kortikorezistenci zřejmě podobným mechanismem jako theofylin. Ačkoliv v této indikaci nejsou pro nortriptylin u astmatiků (na rozdíl od theofylinu) k dispozici klinické studie, autority doporučují zvážit jeho použití v případě těžkého astmatu jako přídatnou léčbu k IKS [13]. Je zřejmé, že nejsnazší rozhodování pro aditivní léčbu nortriptylinem bude u těžkých astmatiků s klinickými příznaky deprese – nejoptimálněji ve spoluprácí s ošetřujícím psychiatrem.
V souvislosti s výše uvedenými léky, které jsou schopny zvýšit senzitivitu ke kortikosteroidům, je namístě ještě uvést možnost terapeutického pokusu s vysokou jednorázovou dávkou i.m. aplikovaného dlouhodobě působícího triamcinolonu (120 mg triamcinolon-acetátu) [16] nebo analogické dávky jiného depotního kortikosteroidu (R. Niven, Manchester, osobní sdělení). U řady těžkých astmatiků s eozinofilií sputa, která do té doby navzdory p.o. léčbě kortikosteroidy neustoupila, je touto jednorázovou injekcí dosaženo nejen normalizace nálezu ve sputu a bezprostředního zlepšení funkce plic, ale i návratu citlivosti vůči (I)KS. Vysvětlení tohoto efektu zahrnuje vedle možné non-adherence pacientů k p.o. léčbě kortikosteroidy řadu dalších účinků (jednorázový průnik extrémně vysokých dávek KS do malých dýchacích cest, kostní dřeně a vedlejších nosních dutin spojený s restaurací protizánětlivých mechanismů, synergický efekt kortikosteroidů s betamimetiky aj.) [6, 16].
Terapeutický pokus s makrolidy u vybrané podskupiny těžkých astmatiků
Makrolidy vykazují obecně protizánětlivý efekt, který je nezávislý na jejich antimikrobiálním mechanismu účinku [17]. U pacientů s těžkým astmatem lze využít obou účinků.
U některých pacientů s těžkým astmatem je prokazována chronická infekce dolních dýchacích cest (DDC) atypickými bakteriemi Mycoplasma pneumoniae a Chlamydia pneumoniae [13]. (K exaktnímu průkazu jejich přítomnosti v DDC ovšem nestačí nepřímé sérologické metody u nás často prováděné a zároveň často zavádějící – ale je nutné opřít se o přímý průkaz z materiálů dolních dýchacích cest, získaný pomocí PCR či kultivace.)
Vedle antimikrobiálního účinku mají ovšem makrolidy i jistý obecně protizánětlivý efekt, který je nejspíše založen na inhibici některých kináz (analogicky jako protizánětlivý účinek theofylinu a nortriptylinu) [6, 13, 17].
Dosavadní studie s dlouhodobým podáváním makrolidů u pacientů s (těžkým) astmatem zahrnovaly podávání těchto léčiv po dobu 6–16 týdnů, nejčastěji byl používán roxithromycin (150 mg 2krát denně), klarithromycin (200–500 mg 2krát denně), vzácně azithromycin (600 mg po tři dny prvý týden, dále 600 mg 1krát týdně) [17]. Ačkoliv výsledky těchto studií nejsou jednoznačné, mimo jiné proto, že studované populace byly velmi heterogenní, u nemocných s těžkým astmatem je doporučováno provést terapeutický test s makrolidy [13]. Příznivý efekt lze očekávat především u pacientů s neutrofilním typem zánětu a/nebo u těch, kde je skutečně přítomna infekce DDC těmito patogeny.
Neopomenout terapeutický test s antileukotrieny
Antileukotrieny (montelukast a zafirlukast) představují skupinu perorálně podávaných preventivních antiastmatik, která ve srovnání s kortikosteroidy potlačují užší a zároveň částečně odlišnou paletu zánětlivých dějů [6]. Proto dříve než eventuálně přistoupíme k dlouhodobé systémové kortikoterapii, je vhodné provést 2–3měsíční terapeutický test s antileukotrienem. Přestože efekt lze očekávat pouze u malé části nemocných (zvl. u pacientů s aspirin-senzitivní a ponámahovou složkou) [2, 6], v praxi by tento test neměl být u žádného z těžkých astmatiků opomenut.
Tiotropium a potenciál nových léků zavedených pro léčbu CHOPN
Je zřejmě jen otázkou času, kdy mnohé léky, které byly vyvinuty původně pro nemocné s CHOPN, najdou své uplatnění i u astmatických pacientů. Týká se to jak již „staršího“ tiotropia, tak indakaterolu a roflumilastu, nově zavedených do klinické praxe v ČR minulý rok.
Tiotropium. Tiotropium je dlouho působící anticholinergikum (konkrétně long-acting muscarinic antagonist, LAMA).
Úvodem je vhodné uvést k roli anticholinergik u astmatu několik prokázaných skutečností.
Acetylcholin, vnímaný jako klasická bronchokonstrikční substance, je v dýchacích cestách uvolňován nejen z parasympatických vagových nervových zakončení, která navíc nezasahují až do periferních (tj. malých) dýchacích cest. Za patologických okolností může být acetylcholin uvolňován rovněž extraneuronálně, především z aktivovaných epiteliálních buněk [6]. A u řady těžkých astmatiků dominuje zánětlivé postižení právě malých dýchacích cest (tzv. SAD, small airway disease) [7, 8].
Výsledky mnoha zvířecích studií in vivo prokazují, že anticholinergika mají – vedle svého bronchodilatačního účinku – řadu protizánětlivých efektů významných jak u alergického, tak u nealergického astmatu eozinofilního i neutrofilního typu [13].
V případě alergického astmatu byla prokázána důležitá role cholinergních mechanismů v pozdní (= kumulace především eozinofilů) alergické reakci po inhalaci alergenů. Tiotropium tuto pozdní zánětlivou reakci tlumí, a to dokonce i u vagotomovaných zvířat, což dosvědčuje skutečnost, že blokuje i acetylcholin uvolňovaný i z jiných buněk, jako jsou např. buňky epiteliální. V dalších zvířecích experimentech tiotropium inhibovalo i non-alergický eozinofilní a dokonce i neutrofilní zánět.
Klíčovým mechanismem v těchto situacích je tlumivý vliv anticholinergika/tiotropia na zánětlivé děje u astmatu tím, že blokuje efekt acetylcholinu na muskarinových M3 receptorech zánětlivých buněk [6, 13].
Receptory M3 jsou známy především jako „klasické“ cholinergní receptory lokalizované na buňkách hladké svaloviny, kde zprostředkovávají bronchokonstrikci navozenou acetylcholinem. Aktivace receptorů M3 na zánětlivých buňkách (eozinofilech, neutrofilech i dalších) vede k sekreci prozánětlivých mediátorů.
Z hlediska bronchodilatačního efektu vykazuje tiotropium vůči krátkodobě působícím anticholinergikům i jiné přednosti než jen dlouhodobost svého efektu. Je to dáno jeho částečnou selektivitou vůči muskarinovým receptorům M1 a M3, zatímco ipratropium (a atropin) působí stejnou měrou i na receptory M2, které zpětnou vazbou tlumí sekreci acetylcholinu. Proto tiotropium vykazuje silnější bronchodilatační efekt a neobjevuje se u něj paradoxní bronchokonstrikce, jak je tomu někdy u ipratropia [6].
Ze všech těchto důvodů je až s podivem, proč existuje relativně málo studií a doporučení týkajících se role tiotropia u (těžkého) astmatu v klinické praxi.
Teprve v poslední době se objevují studie potvrzující příznivý efekt na plicní funkce a/nebo symptomy po přidání LAMA k léčbě těžkých astmatiků, jejichž nemoc se nedařilo dostat pod kontrolu vysokými dávkami IKS a LABA [18, 19].
I když eventuální vzájemný synergický efekt LAMA s IKS vedoucí k tomu, že přidání LAMA by potencovalo efekt (I)KS a umožnilo tak snížení jejich dávek, není popisován, ze skutečností uvedených v úvodu lze z dlouhodobého hlediska předpokládat i protizánětlivý efekt LAMA, zvláště u astmatiků s postižením malých dýchacích cest (viz SAD).
Nejlepší efekt tiotropia lze očekávat u starších nemocných s přítomností fixované obstrukce, jejichž onemocnění vykazuje některé podobnosti s CHOPN [13],a/nebo u astmatiků s dominujícím postižením malých dýchacích cest [7].
Indakaterol. Tento selektivní, velmi dlouho působící ß2-agonista (ultra-LABA s 24hodinovým působením, podáván 1krát denně) je od minulého roku u nás zaveden pro léčbu CHOPN. Stejně jako LABA (formoterol a salmeterol) by měl být v případě astmatu podáván pouze s IKS, nejlépe ve fixní kombinaci v jednom inhalátoru. V kombinaci s IKS vykazují U-LABA synergický efekt podobně jako LABA a nehrozí zde rizika exacerbací a mortality přítomná při monoterapii LABA. K dávkování 1krát denně je vyvinuta např. kombinace mometason/indakaterol. I když se tyto kombinace nehodí ke SMART strategii [13] (z důvodů rizika kumulativních nežádoucích účinků U-LABA), z pohledu reálné klinické praxe lze tyto jednou denně podávané kombinované léky uvítat – zřetelně totiž zvyšují adherenci k léčbě.
Roflumilast. Tento perorální, protizánětlivě působící lék, blokátor fosfodiesterázy 4 (PDE4), je v ČR rovněž od minulého roku zaveden pro léčbu CHOPN.
Stejně jako kortikosteroidy potlačuje roflumilast široké spektrum zánětlivých dějů. Jejich výsledné efekty se částečně překrývají – avšak zatímco kortikosteroidy vykazují účinek především u eozinofilního typu zánětu, roflumilast blokuje více neutrofilní typ [13]. To je také důvodem jeho primární indikace pro nemocné s CHOPN.
U lehkých forem astmatu, včetně alergického, byl efekt roflumilastu shledán rovnocenným s nízkými dávkami IKS.
U těžkého astmatu lze roli roflumilastu spatřovat především v léčbě podskupiny nemocných s významnou či dominující neutrofilní složkou zánětu [13, 20].
Omezení pro užívání roflumilastu u těžkých astmatiků mohou představovat jeho vedlejší účinky závislé na dávce (bolesti hlavy, nauzea, zvracení, průjmy). Ve vývoji jsou proto selektivní, tzv. PDE4B varianty, eventuálně inhalační formy blokátorů PDE.
Komu z těžkých astmatiků je určena anti-IgE léčba
Biologická léčba monoklonální anti-IgE protilátkou (omalizumab) je indikována u těch těžkých astmatiků, u nichž v aktuálním obraze onemocnění hraje imunoglobulinem E zprostředkovaná alergie na některý celoroční a neodstranitelný alergen významnou či rozhodující roli [2, 13, 20–22]. Prokázaná příznivá účinnost na dlouhodobý průběh nemoci je u pacientů s rozpětím celkové hladiny IgE od 30 do 1500 IU/ml, nejlepších efektů je dosahováno při rozmezí hladin 70–300 IU/ml [13]. Z toho je zřejmé, že z léčby má přínos velká část astmatiků, jejichž hladina celkového IgE se pohybuje v rozmezí normálních hodnot! Horní hranice normálních hodnot dosahují, v závislosti na použité metodě a věku nemocného, 100 až 200 IU/ml. Již proto je žádoucí uskutečňovat konkrétní výběr nemocných na specializovaných pracovištích národních center pro těžké astma (NCTA, viz www.tezke-astma.cz) [21]. U většiny nemocných je dosahováno redukce exacerbací navzdory eventuálnímu snížení až ukončení systémové kortikoterapie, u některých nemocných se zcela zásadně mění do té doby nepříznivý obraz nemoci. V ČR je metoda limitována rozpětím hladiny celkového IgE 30–700 IU/ml a minimálním věkem 12 let, v současné době je léčeno cca 170 nemocných.
Nefarmakologická možnost léčby bronchiální termoplastikou
Bronchiální termoplastika představuje nefarmakologický způsob léčby těžkého astmatu. Během tří bronchoskopických výkonů v intervalech přibližně 3 týdnů jsou pomocí tenké sondy aplikovány pulzy radiofrekvenční energie, jimiž jsou postupně krátkodobě zahřáty téměř všechny průdušky až do kalibru 3 mm na teplotu kolem 60 °C. V důsledku toho dochází k selektivní a dlouhotrvající redukci hladké svaloviny bronchů. Dlouhodobé příznivé efekty na další průběh nemoci, především ústup bronchiální hyperreaktivity a počty exacerbací [23–25], jsou dokladovány po dobu 2–3 let [26] až 5 let (R. Niven, osobní sdělení). V ČR je metoda zavedena od počátku tohoto roku. K léčbě mohou být indikováni i těžcí astmatici nealergického typu, konkrétní výběr nemocných je, podobně jako při anti-IgE léčbě, žádoucí provádět na specializovaných pracovištích NCTA [2].
Omezená role imunosupresiv a anticytokinové biologické léčby
Někteří těžcí astmatici dospějí v průběhu času do obrazu systémových autoimunitních onemocnění, kde astma je součástí širších klinických projevů těchto nemocí. Jejich nejtypičtějším představitelem, spojeným často s výskytem p-ANCA autoprotilátek, je vaskulitida typu syndromu Churga-Straussové, jejíž léčba se vymyká obsahu tohoto sdělení [6].
U jiných těžkých astmatiků se v průběhu času objevují některé laboratorní markery jiných autoimunitních onemocnění (antinukleární protilátky, revmatoidní faktor aj.), aniž by se u nich taková onemocnění klinicky zřetelně manifestovala. A nakonec existují pacienti s těžkým astmatem, u nichž se paralelně rozvinulo – dříve či většinou později než astma – systémové autoimunitní onemocnění (revmatoidní artritida, sklerodermie aj.), u něhož není vztah k astmatu prokázán a jedná se o koincidenci těchto nemocí.
Především poslední dvě uvedené skupiny těžkých astmatiků představují cílovou skupinu ke zvážení indikace některého z palety dostupných léků používaných k léčbě systémových autoimunitních
onemocnění.
S cílem snížit dávku perorálních kortikosteroidů byla u těžkých astmatiků zkoušena řada cytostatik podávaných v imunosupresivních dávkách (methotrexát, cyklosporin aj.) a zlato [2, 27].
Jediným imunosupresivem, které je v současnosti více autoritami – byť s výhradami – doporučováno, je methotrexát (MTX). Jako alternativa či doplnění léčby systémovými kortikosteroidy je doporučován zejména tam, kde léčba systémovými kortikosteroidy, ač účinná u astmatu, způsobuje závažné nežádoucí účinky (osteoporóza u postmenopauzálních žen, závažné krvácivé projevy, změny chování atp.). Používány jsou relativně malé dávky MTX (15 mg 1krát týdně) [6, 28], jeho podání je třeba vždy doplnit následující den podáním kyseliny listové
Je prokázáno, že tumor necrosis factor a (TNF-a) je důležitým amplifikujícím mediátorem zánětu nejen u revmatických onemocnění, ale i u některých pacientů s astmatem, zvláště těžkým [6, 13]. Dnes jsou již k dispozici studie prokazující efekt anti-TNF léčby (zkoušeny byly především solubilní receptor etanercept a blokující protilátka infliximab) u pacientů s těžkým astmatem [29–31]. V současnosti ovšem nelze, vzhledem k nedostatku robustních studií posuzujících přínos a rizika nežádoucích účinků této léčby, indikovat anti-TNF léčbu u nemocných s těžkým astmatem bez revmatického onemocnění. Použití etanerceptu nebo infliximabu lze zatím připustit jenom tam, kde jsou primárně indikovány k léčbě revmatického onemocnění
V této souvislosti je vhodné doplnit, že jiné anticytokinové preparáty, které jsou primárně vyvíjeny pro léčbu astmatu
(pitrakinra blokující efekty IL-4 a IL-13, úzce spojených s produkcí IgE, mepolizumab a reslizumab blokující efekty IL-5, úzce spojeného s aktivací eozinofilů), nenašly zatím klinické uplatnění.
Terapeutický pokus s itrakonazolem u nemocných s mykotickou senzibilizací
Významná část alergických astmatiků (cca 20 %) vykazuje senzibilizaci vůči plísním, nejčastěji rodu Aspergillus, Alternaria a Cladosporium. U některých z těchto nemocných dochází časem ke zvláštní situaci, kdy zdroj alergenů, tedy plíseň – nejčastěji konkrétně A. fumigatus – víceméně trvale kolonizuje sliznici průdušek. V takovém případě hovoříme o alergické bronchopulmonální aspergilóze (ABPA), v případě jiných plísní o alergické bronchopulmonální mykóze (ABPM), eventuálně o tzv. těžkém astmatu s mykotickou senzibilizací, SAFS (severe asthma with fungal senzitization) [32–34].
Vzhledem k trvalé extrémní alergické expozici tak dochází k vysoké tvorbě specifických IgE, vysoké bývají i hladiny celkového IgE. Permanentní alergická zánětlivá reakce ve stěně průdušek navozuje těžké obrazy onemocnění. V celé astmatické populaci se ABPA a SAFS nachází maximálně u 1 % nemocných, avšak v populaci těžkých, kortikodependentních astmatiků to bývá cca 10 % [33–34].
Je logické, že v terapii těchto závažných obrazů astmatu je namístě antimykotická léčba. Doposud není přesně známo, proč tomu tak je, ale nejlepších efektů je dosahováno pomocí itrakonazolu. Je pravděpodobné, že tento lék působí nejen redukci až eliminaci mykotické populace a tím i zdroje alergenů, ale že vykazuje i jiné než antimikrobiální účinky – zvyšuje účinnost některých steroidů (zvláště methylprednisolonu kompeticí v hepatálním metabolismu CYP3A4) a vykazuje i imunomodulační efekt [35].
Doporučené dávky se pohybují v rozmezí 100–400 mg/den, léčba trvá minimálně 2–3 měsíce.
Touto léčbou lze v řadě případů dosáhnout velmi výrazných, často až pozoruhodných klinických efektů [36, 37].
Seznam použité literatury
- [1] GINA Workshop Report – updated 2011, www.ginasthma.org
- [2] Teřl M, Pohunek P, et al. (eds). Strategie diagnostiky, prevence a léčby astmatu. Praha: ČIPA, Jalna, 2012.
- [3] Teřl M. Těžké astma. Interní Med 2006; 3: 123–127.
- [4] Bel EH, Sousa A, Fleming L, et al; Unbiased Biomarkers for the Prediction of Respiratory Disease Outcome (U-BIOPRED) Consortium, Consensus Generation. Diagnosis and definition of severe refractory asthma: an international consensus statement from the Innovative Medicine Initiative (IMI). Thorax 2011; 66: 910–917.
- [5] Kašák V. Asthma bronchiale. Praha: Jessenius/Maxdorf, 2005.
- [6] Mason RJ, Murray JF, Broaddus VC, Nadel JA. Murray and and Nadels´ Textbook of Respiratory Medicine. 4th Ed., USA, Elsevier Saunders.
- [7] Buhl R. Treatment of small airway diseases-today and tomorrow. Pneumologie 2009; 63 Suppl 2: S95.
- [8] Contoli M, Bousquet J, Fabbri LM, et al. The small airways and distal lung compartment in asthma and COPD: a time for reappraisal. Allergy 2010; 65: 141–151.
- [9] Dolovich MB, Ahrens RC, Hess DR, et al. Device selection and outcomes of aerosol therapy: Evidence-based guidelines: American College of Chest Physicians/American College of Asthma, Allergy, and Immunology. Chest 2005; 127: 335–371.
- [10] Chapman KR, Voshaar TH, Virchow JC. Inhaler choice in primary care. Eur Respir Rev 2005; 14: 117–122.
- [11] Kašák V, Feketeová E. Vliv nesprávné inhalační techniky na úroveň kontroly nad astmatem. Alergie 2010; 12: 244–257.
- [12] Derendorf H, Meltzer EO. Molecular and clinical pharmacology of intranasal corticosteroids: clinical and therapeutic implications. Allergy 2008; 63: 1292–1300.
- [13] Barnes PJ. Severe asthma: advances in current management and future therapy. J Allergy Clin Immunol 2012; 129: 48–59.
- [14] Barnes PJ. Theophylline for COPD. Thorax 2006; 61: 742–744.
- [15] Kuzel RJ. Treating comorbid depression and anxiety. J Fam Pract 1996; 43 (6 Suppl): S45–S53.
- [16] ten Brinke A, Zwinderman AH, Sterk PJ, et al. „Refractory“ eosinophilic airway inflammation in severe asthma: effect of parenteral corticosteroids. Am J Respir Crit Care Med 2004; 170: 601–605.
- [17] Friedlander AL, Albert RK. Chronic macrolide therapy in inflammatory airways diseases. Chest 2010; 138: 1202–1212.
- [18] Peters SP, Kunselman SJ, Iciovic N, et al. Tiotropium bromide step-up therapy for adults with uncontrolled asthma. NEJM 2010; 363: 1715–1726.
- [19] Thomas A, Lemanske RF Jr, Jackson DJ. Approaches to stepping up and stepping down care in asthmatic patients. J Allegy Clin Immunol 2011; 128: 915–924.
- [20] Colice GL. Emerging therapeutic options for asthma. Am J Manag Care 2011; 17 Suppl 3: S82–S89.
- [21] Sedlák V, Chlumský J, Teřl M, Novotná B, Král B. Doporučený postup diagnostiky a léčby obtížně léčitelného astmatu. Standardní léčebný plán pro ambulantní specialisty. Stud Pneumol Phthiseol 2011; 71: 66–75.
- [22] Teřl M. Pohled na astma prizmatem eozinofilie a alergie: návrh diagnostické klasifikace. Alergie 2009; 4: 247–255.
- [23] Boulet LP, Laviolette M. Is there a role for bronchial thermoplasty in the treatment of asthma? Can Respir J 2012; 19: 191–192.
- [24] Castro M, Rubin AS, Laviolette M, et al; AIR2 Trial Study Group. Effectiveness and safety of bronchial thermoplasty in the treatment of severe asthma: a multicenter, randomized, double-blind, shamcontrolled clinical trial. Am J Respir Crit Care Med 2010; 181: 116–124.
- [25] Thomson NC, Rubin AS, Niven RM, et al; AIR Trial Study Group. Long-term (5 year) safety of bronchial thermoplasty: Asthma Intervention Research (AIR) trial. BMC Pulm Med 2011; 11: 8.
- [26] Castro M, Rubin A, Laviolette M; AIR2 Trial Study Group. Persistence of effectiveness of bronchial thermoplasty in patients with severe astma. Ann Allergy Asthma Immunol 2011; 107: 65–70.
- [27] Shiner RJ, Nunn AJ, Chung KF, Geddes DM. Randomised, double-blind, placebo-controlled trial of methotrexate in steroid-dependent asthma. Lancet 1990; 336: 137–140.
- [28] Domingo C, Moreno A, Mirapeix R. Rationale for the use of immunomodulatory therapies in the Global Initiative for Asthma (GINA) step V asthma other than oral glucocorticosteroids. Intern Med J 2011; 41: 525–536.
- [29] Holgate ST, Noonan M, Chanez P, et al. Efficacy and safety of etanercept in moderate-to-severe asthma: a randomised, controlled trial. Eur Respir J 2011; 37: 1352–1359.
- [30] Gjurow D, Grzelewski T, Sobocińska A, Stelmach I. Tumor necrosis factor inhibitors in pediatric asthma. Recent Pat Inflamm Allergy Drug Discov 2009; 3: 143–148.
- [31] Stoll ML, Solomon DH, Batra KL, et al. TNFalpha inhibitors may improve asthma symptoms: a case series of 12 patients with rheumatoid arthritis and asthma. J Clin Rheumatol 2009; 15: 198–200.
- [32] Agarwal R, Aggarwal AN, Gupta D, Jindal SK. Aspergillus hypersensitivity and allergic bronchopulmonary aspergillosis in patients with bronchial asthma: systematic review and meta-analysis. Int J Tuberc Lung Dis 2009; 13: 936–944.
- [33] Agarwal R. Allergic bronchopulmonary aspergillosis. Chest 2009; 135: 805–826.
- [34] Agarwal R. Severe asthma with fungal sensitization. Curr Allergy Asthma Rep 2011; 11: 403–413.
- [35] Pasqualotto AC, Powell G, Niven R, Denning DW. The effects of antifungal therapy on severe asthma with fungal sensitization and allergic bronchopulmonary aspergillosis. Respirology 2009; 14: 1121–1127.
- [36] Teřl M. Alergická bronchopulmonální aspergilóza. Kazuistiky v alergologii, pneumologii a ORL 2009; 6: 4–10.
- [37] Růžičková Kirchnerová O, Teřl M, Mírka H, et al. Alergická bronchopulmonální aspergilóza (ABPA) a možnosti její léčby. Stud Pneumol Phthiseol 2010; 70: 149–154.