Současné trendy, novinky a vývoj v oblasti hypolipidemické léčby z hlediska jednotlivých skupin léčiv, jejich kombinací a nových technologi
Klinické studie posledních let prokázaly, že léčba hypolipidemiky představuje etablovaný a efektivní způsob intervence aterosklerózy a jejích komplikací, vede ke snížení kardiovaskulární (KV) morbidity a mortality a ke zlepšení prognózy nemocných. Proto se problematika hypolipidemické léčby dostává stále více do popředí zájmu odborné i laické veřejnosti. Statiny všeobecně a shodně považujeme za léky první linie pro většinu poruch metabolismu lipidů. Víme ale také, že nepokrývají všechny atributy rizika KV onemocnění. Nejméně část tzv. reziduálního rizika je způsobena dyslipidemií a vyžaduje léčbu dalšími hypolipidemiky (fibráty, niacin/kyselina nikotinová). Nedílnou součástí problémů, které přináší léčba hypolipidemiky, je vedle compliance také výskyt nežádoucích účinků. Přerušení léčby je nutné přibližně u 5 % pacientů léčených statiny nebo fibráty a 30 % léčených sekvestranty žlučových kyselin. Význam hyperlipidemií podtrhuje aktivní výzkum a vývoj nových hypolipidemik. Řada potenciálních farmak, která jsou vyvíjena již řadu let, nedosáhla prozatím využití v klinice, ale objevily se i zcela nové možnosti – byl např. objeven preprotein subtilisin kexin 9 (PCSK9) jako řídící systém LDL receptoru a je rozvíjena technologie antisense oligonukleotidů (ASO).
Úvod
Progrese aterosklerózy, která vede ke vzniku kardiovaskulárních onemocnění (KVO), je podmíněna multifaktoriálně. Hyperlipoproteinemie (HLP) a dyslipidemie představují jedny z nejvýznamnějších rizikových faktorů aterosklerózy [1–3]; tato souvislost byla opakovaně doložena mnoha epidemiologickými studiemi. HLP a dyslipidemie představují heterogenní skupinu metabolických chorob charakterizovaných zvýšenou koncentrací lipoproteinů v krvi. HLP jsou skupinou chorob masového výskytu; jejich prevalence v dospělé populaci se pohybuje kolem 20 %. Epidemiologické s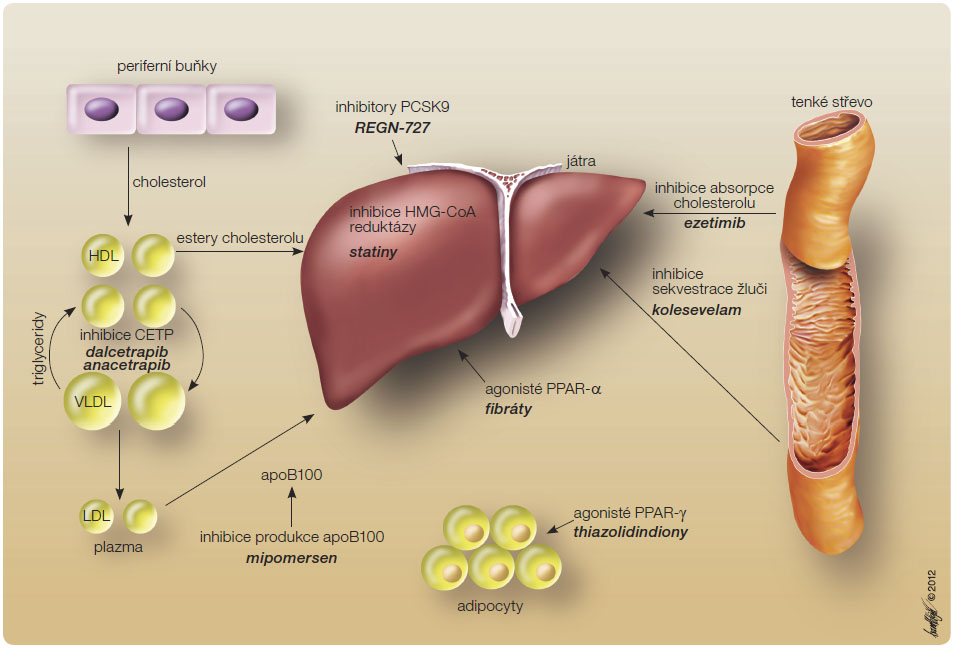 tudie ukázaly, že 1% snížení koncentrace LDL cholesterolu (low-density lipoprotein cholesterol, LDL-C) vede k 1% snížení výskytu KV příhod, zvýšení hladiny HDL cholesterolu (high-density lipoprotein cholesterol, HDL-C) o 1 % vede k 3% redukci výskytu KV příhod [4]. Údaje o vlivu triglyceridů, remnant bohatých na triglyceridy, malých denzních subfrakcí lipoproteinů a lipoproteinu (a) nejsou zcela jednoznačné, ale všechny vyjmenované partikule jsou spojeny se zvýšeným KV rizikem [5–7]. Problematice farmakoterapie aterosklerotických KVO a hypolipidemické léčby je věnována v domácí i zahraniční literatuře značná pozornost [8, 9] a klasická či nově vyvíjená hypolipidemika, ať již v monoterapii, či v synergicky působících kombinacích, představují jednu z rychle se vyvíjejících oblastí farmakoterapie aterosklerózy (obr. 1).
tudie ukázaly, že 1% snížení koncentrace LDL cholesterolu (low-density lipoprotein cholesterol, LDL-C) vede k 1% snížení výskytu KV příhod, zvýšení hladiny HDL cholesterolu (high-density lipoprotein cholesterol, HDL-C) o 1 % vede k 3% redukci výskytu KV příhod [4]. Údaje o vlivu triglyceridů, remnant bohatých na triglyceridy, malých denzních subfrakcí lipoproteinů a lipoproteinu (a) nejsou zcela jednoznačné, ale všechny vyjmenované partikule jsou spojeny se zvýšeným KV rizikem [5–7]. Problematice farmakoterapie aterosklerotických KVO a hypolipidemické léčby je věnována v domácí i zahraniční literatuře značná pozornost [8, 9] a klasická či nově vyvíjená hypolipidemika, ať již v monoterapii, či v synergicky působících kombinacích, představují jednu z rychle se vyvíjejících oblastí farmakoterapie aterosklerózy (obr. 1).
Klasická hypolipidemika
Statiny
Léčba statiny vede ke snížení koncentrace cholesterolu a snížením zánětlivé aktivity má nepochybný význam v ovlivnění KV morbidity a mortality; je proto nedílným základem současných doporučení v primární i sekundární prevenci aterosklerotických KVO. Statiny považujeme za efektivní a bezpečné léky, jejichž podávání může vést k maximálnímu snížení koncentrace LDL-C až o 60 %, společně s paralelním snížením koncentrace triglyceridů a mírným zvýšením koncentrace HDL-C nezávislými mechanismy [10]. Jejich hlavní relativní nevýhodou je známý fakt, že každé zdvojnásobení dávky vede k potenciaci jejich efektu na snížení koncentrace LDL-C pouze o 5–7 %, ale mnohem více zvyšuje riziko vedlejších účinků, zejména vzniku myalgie–myositidy.
Atorvastatin a rosuvastatin jsou již zcela etablovanými hypolipidemiky a zdá se, že v účincích se liší jen minimálně, dokonce i při podávání nejvyšších dávek, jak ukázala studie SATURN (Study of Coronary Atheroma by Intravascular Ultrasound: Effect of Rosuvastatin vs. Atorvastatin) za využití intravaskulárního ultrazvukového vyšetření (IVUS) na souboru 1385 pacientů [10]. Pitavastatin je dostupný zatím v omezeném počtu zemí.
Mezi nové statiny, dosud ve fázi vývoje, patří NCX-6560 – statin s vlastnostmi aditivního vazodilatátoru (nitric oxide donor) a schopností snížit koncentraci LDL-C o 57 % – a PPD-10558, statin účinkující převážně v játrech a vyskytující se v plazmě v redukovaných koncentracích. Tento statin je momentálně testován u pacientů, kteří netolerují ostatní statiny z důvodu myalgie (statin-associated myalgia, SAM).
Co se týče dalších aspektů možných nežádoucích účinků statinů, v únoru 2012 vydal orgán US Food and Drug Administration (FDA) oznámení o důležitých změnách týkajících se bezpečnosti statinů. Oznámení se v podstatě týkalo tří oblastí: za prvé konstatování, že rutinní monitorování jaterních enzymů není třeba (jen před léčbou a poté při klinické indikaci). Podkladem je analýza, dle které je ireverzibilní poškození jater statiny výjimečně vzácné a je nejspíše idiosynkratické, a žádná data neprokázala, že rutinní periodické monitorování jaterních testů je schopno odhalit jednotlivce s rizikem signifikantního poškození jater. Několik postmarketingových sledování, která FDA uveřejnila v databázi Adverse Event Reporting System (AERS) mezi roky 2000 a 2009, upozornilo na fakt, že se hlášení o poškození jater vlivem statinů vyskytovala zcela vzácně (počet hlášení ? 2/1 milion pacientoroků). Mezi nahlášenými 75 případy závažného poškození jater – tj. stupně 4 (závažné poškození jater) nebo 5 (úmrtí nebo transplantace jater) podle škály míry poškození jater Drug Induced Liver Injury Network nebylo žádné s nejvyšší pravděpodobností asociované s léčbou statiny. Na základě této analýzy učinila FDA závěr, že přes enormní rozšíření léčby statiny od konce 90. let 20. století nedošlo k zaznamenatelnému zvýšení výskytu fatálního nebo závažného poškození jater vlivem léčby statiny.
Za druhé FDA hodnotila vliv statinů na kognitivní funkce analýzou databáze AERS, publikací v odborné literatuře a v randomizovaných klinických studiích. Analyzovala postmarketingová hlášení nežádoucích účinků u osob starších 50 let, které měly významné nejasně definované ztráty nebo zhoršení paměti, jež po ukončení léčby statiny odezněly. Stavy nesouvisely s výskytem Alzheimerovy choroby nebo jiné fixované či progredující demence a nebyla nalezena ani souvislost s takovými nežádoucími účinky a specifickým statinem, věkem pacienta, dávkou statinu nebo konkomitantní medikací. Jednalo se o kazuistiky s mírným reverzibilním zhoršením kognitivních funkcí u osob starších 50 let (ztráta paměti, zapomínání, amnézie, zhoršení paměti, zmatenost); symptomy se vyskytují za jeden den až léta po zahájení léčby, po vysazení mizí s mediánem 3 týdnů.
![Graf 1 Riziko vzniku diabetu při léčbě statiny; podle [11] – Preiss, et al., 2011. CI – konfidenční interval, OR – odds ratio, poměr šancí](https://www.remedia.cz/photo-a-29043---.jpg) Třetí oblastí hodnocenou FDA byl vliv léčby statiny na elevace glykemie a HbA1c. Metaanalýzy prokazují, že léčba statiny je spojena se zvýšením rizika vzniku diabetu o 9–13 % [11] (graf 1). Efekt je závislý na dávce. Intenzivní léčba statiny vede ke zvýšení rizika nově vzniklého diabetu o 12 % ve srovnání s nižšími dávkami. Tato léčba ale zároveň snižuje výskyt hlavních KV příhod o 16 % (graf 2). V absolutních hodnotách to znamená, že léčba 498 pacientů vyššími dávkami statinů po dobu jednoho roku (number needed to treat, NNT) vyvolá vznik jednoho případu diabetu, zatímco léčení 155 pacientů po dobu jednoho roku zabrání u jednoho nemocného vzniku KV příhody, tedy poměr rizika a přínosu léčby je přibližně 1 : 3. Co se týče individuálního výskytu KV příhod, bylo roční NNT 1087 pro KV úmrtí, 578 pro nefatální infarkt myokardu, 1538 pro nefatální cévní příhodu mozkovou a 171 pro koronární revaskularizace. Metaanalýza 5 studií hodnotila pouze dva statiny – tj. atorvastatin v dávce 80 mg a simvastatin 80 mg. Riziko diabetu bylo obdobné
Třetí oblastí hodnocenou FDA byl vliv léčby statiny na elevace glykemie a HbA1c. Metaanalýzy prokazují, že léčba statiny je spojena se zvýšením rizika vzniku diabetu o 9–13 % [11] (graf 1). Efekt je závislý na dávce. Intenzivní léčba statiny vede ke zvýšení rizika nově vzniklého diabetu o 12 % ve srovnání s nižšími dávkami. Tato léčba ale zároveň snižuje výskyt hlavních KV příhod o 16 % (graf 2). V absolutních hodnotách to znamená, že léčba 498 pacientů vyššími dávkami statinů po dobu jednoho roku (number needed to treat, NNT) vyvolá vznik jednoho případu diabetu, zatímco léčení 155 pacientů po dobu jednoho roku zabrání u jednoho nemocného vzniku KV příhody, tedy poměr rizika a přínosu léčby je přibližně 1 : 3. Co se týče individuálního výskytu KV příhod, bylo roční NNT 1087 pro KV úmrtí, 578 pro nefatální infarkt myokardu, 1538 pro nefatální cévní příhodu mozkovou a 171 pro koronární revaskularizace. Metaanalýza 5 studií hodnotila pouze dva statiny – tj. atorvastatin v dávce 80 mg a simvastatin 80 mg. Riziko diabetu bylo obdobné ![Graf 2 Výskyt diabetu (a), resp. výskyt první KV příhody (b) při léčbě statiny; podle [11] – Preiss, et al., 2011. CI – konfidenční interval, OR – odds ratio, poměr šancí](https://www.remedia.cz/photo-a-29044---.jpg) u obou (15 %, resp. 13 %), ale atorvastatin podávaný ve vyšších dávkách byl ve srovnání s léčbou nižšími dávkami účinnější ve snížení výskytu hlavních KV příhod (22 %, resp. 5 %; p < 0,001 pro interakci). Jestliže potom zhodnotíme také zvýšené riziko rabdomyolýzy při léčbě simvastatinem v dávce 80 mg, lze shrnout, že při nutnosti léčby vysokými dávkami statinů poskytuje lepší léčebný přínos atorvastatin 80 mg.
u obou (15 %, resp. 13 %), ale atorvastatin podávaný ve vyšších dávkách byl ve srovnání s léčbou nižšími dávkami účinnější ve snížení výskytu hlavních KV příhod (22 %, resp. 5 %; p < 0,001 pro interakci). Jestliže potom zhodnotíme také zvýšené riziko rabdomyolýzy při léčbě simvastatinem v dávce 80 mg, lze shrnout, že při nutnosti léčby vysokými dávkami statinů poskytuje lepší léčebný přínos atorvastatin 80 mg.
Fibráty
Fibráty jsou etablovaným typem hypolipidemika. Fungují jako agonisté jaderných receptorů PPAR-α (peroxisome proliferator-activated receptor alpha) tím, že regulují expresi apolipoproteinu A-1 (apoA1) a A-2 (základních složek HDL), lipoproteinové lipázy, apolipoproteinu C-3 (je spojený s remnantními částicemi bohatými na triglyceridy), proteiny akutní fáze včetně fibrinogenu a C-reaktivního proteinu (CRP) a hemokoagulačních faktorů (plasminogen activator inhibitor 1), ale ovlivňují i řadu dalších genů. Jejich hlavním účinkem je snížení hladiny triglyceridů a mírné zvýšení koncentrace HDL-C. Fibráty mírně snižují výskyt KVO (o 10–13 %) v monoterapii [12] a u pacientů s nízkým HDL a zvýšenou hladinou triglyceridů mohou potencovat účinek statinů, i když k formálnímu důkazu čekáme stále na potvrzení z velké randomizované studie [13]. Fibráty mají rozdílnou specificitu pro tkáňové PPAR, působí hlavně na PPAR-α. Mají dále mikrovaskulární a makrovaskulární účinky, u kterých dosud nebylo přesně stanoveno, zda souvisí s jejich hypolipidemickými efekty [14].
Vývoj přinesl i některé novější, specifičtější agonisty PPAR-α (např. FF-200). Z důvodu svalové toxicity se však neuplatnily a současný trend je zaměřen na další typy PPAR (viz níže).
Vedle vývoje nových typů fibrátů se ke slovu hlásí také nanotechnologie. Převedení léčiv do nanokrystalů mění jejich fyzikální vlastnosti a není již pouhou vizí, nýbrž skutečností. K jejich výrobě se využívají různé postupy, jako je rozmělnění (pearl milling) nebo homogenizace pod vysokým tlakem. Zmenšení velikosti částic vede ke zvětšení jejich povrchu a podle Noyesovy-Whitneyho rovnice zvyšuje rychlost jejich rozpouštění. Mikronizace je proto ideální metodou ke zvýšení biologické dostupnosti léků, u kterých je limitujícím faktorem rychlost rozpouštění. Posunutím mikronizace dále k nanonizaci se ještě více zvětší povrch částice a dále se urychlí rozpouštění.
Nanonizace má za následek ovšem také další změny ve fyzikálních vlastnostech léků, protože zvyšuje saturační solubilitu (cs). To je konstanta, která za normálních okolností platí pro částice větší než jeden mikrometr a závisí na sloučenině, disolučním médiu a teplotě. U částic s velikostí menší než 1–2 mikrometry je saturační solubilita také funkcí velikosti částice a zvyšuje se se zmenšováním částice pod 1000 nm. Proto mají léčiva ve formě nanokrystalů větší saturační solubilitu a díky zvýšení saturační solubility se zvyšuje koncentrační gradient mezi lumen střeva a krví a s tím i absorpce pasivní difuzí.
Obecně řečeno, vstřebávání z lumen střeva a tím biologická dostupnost fenofibrátu závisí na tom, zda je pacient nalačno, nebo po jídle. Fenofibrát je lipofilní molekula, a proto je prakticky nerozpustný ve vodě. Jeho vstřebávání je vyšší v přítomnosti lipidů a dalších surfaktantů (tj. cholesterolu). Absorpce fenofibrátu po jídle je o 35 % vyšší než nalačno. Nanotechnologie vede k tomu, že vstřebávání fenofibrátu na jídle nezávisí a nalačno i po jídle je zcela bioekvivalentní [15].
Niacin/kyselina nikotinová
Niacin patří mezi nejstarší hypolipidemika. Mechanismus jeho účinku není zcela objasněn, ale zahrnuje snížení syntézy lipoproteinů s velmi nízkou hustotou (very low-density lipoprotein, VLDL) v játrech ovlivněním diacylglycerol acyl transferázy-2 (DGAT-2) a vlivem na periferní lipolýzu prostřednictvím receptoru FM-70. Zvyšuje koncentraci HDL-C o 20–25 % tak, že navodí zvýšení tvorby apoA1 a snížuje katabolismus HDL cestou zpomalení odbourávání apoA1 (inhibicí exprese ß-řetězce ATP-syntázy). Je to jedno z mála hypolipidemik, které je schopno snížit koncentrace lipoproteinu (a) – Lp(a). Studie jako Coronary Drug Project prokázaly 20% redukci výskytu KVO při monoterapii niacinem [16], ale recentní studie AIM-HIGH u pacientů s aterosklerotickým KVO a koncentrací LDL-C nižší než 1,81 mmol/l neprokázala během 36měsíční léčby, navzdory signifikantnímu zlepšení hladin HDL-C a triglyceridů, žádný klinický přínos, a proto byla předčasně ukončena [17]. Využití omezuje také vznik záchvatovitého zarudnutí a proteplení kůže, zejména v oblasti obličeje a horní části hrudníku (flush), které je způsobeno aktivací syntézy prostaglandinu E, a hepatotoxicita. Přidání molekuly laropiprantu (antagonista receptorů typu 1 pro prostaglandin D2) snižuje výskyt flushe o 70–80 %. Účinky kombinační léčby niacinem a laropiprantem na riziko vzniku KVO zkoumá studie HPS-3/THRIVE (Heart Protection-3/Treatment of HDL to Reduce the Incidence of Vascular Events), jejíž výsledky jsou očekávány nejdříve v roce 2013.
Sekvestranty žlučových kyselin
Sekvestranty žlučových kyselin snižují absorpci cholesterolu tím, že navozují sekvestraci žluči – tak brání ve střevě opsonizaci částic bohatých na lipidy pomocí žluči, čímž vyvolávají sekundárně up-regulaci jaterních LDL receptorů (LDL-R). Kromě snížení hladiny cholesterolu také ovšem zvyšují hodnoty triglyceridů působením na jaterní receptor X (liver-X-receptor, LXR), mají jen malý vliv na HDL a působením na receptor farnesoid X snižují glykemii. Jejich hlavní omezení ve využití představuje vysoký výskyt nežádoucích účinků způsobený přítomností žluči v tlustém střevě, což vyvolává plynatost, nauzeu a průjem. Poslední verzi představuje kolesevelam, který vedle redukce lipidů zlepšuje také glykemii.
Inhibitory absorpce cholesterolu
Ezetimib je inhibitor absorpce cholesterolu, který blokuje v duodenu Niemannův-Pickův protein (Niemann-Pick C1-like protein 1, NPC1L1). Ezetimib je obvykle velmi dobře tolerován, ale totožně jako řada podobně působících hypolipidemik vyvolává nauzeu a nadýmání – nejspíše proto, že přechodně narušuje metabolismus žlučových kyselin. Některé menší studie dokládají schopnost ezetimibu snížit jaterní steatózu, je lékem volby pro sitosterolemii. V ostatních případech dosud nemáme důkazy dokumentující vztah ke KV riziku, a to ani v monoterapii, ani v kombinaci se statinem (Ezetimibe and Simvastatin in Hypercholesterolemia Enhances Atherosclerosis Regression, ENHANCE; Simvastatin and Ezetimibe in Aortic Stenosis, SEAS) [18, 19]. V subpopulaci pacientů s renálním postižením vedla kombinační léčba statinem a ezetimibem ke snížení výskytu KVO o 27 % (Study of Heart and Renal Protection, SHARP) [20]. V průběhu června roku 2013 bychom měli znát výsledky očekávané studie IMPROVE-IT (IMProved Reduction of Outcomes: Vytorin Efficacy International Trial) u nemocných s akutním koronárním syndromem, která by měla přinést prospektivní údaje o účinku ezetimibu na KV riziko.
Nové třídy hypolipidemik
První skupinou novějších nebo zcela nových a vyvíjených hypolipidemik jsou molekuly snižující koncentraci LDL-C.
Inhibitory konvertázy PCSK9
Konvertáza PCSK9 (preprotein konvertáza subtilisin kexin 9) je nově objevený protein, který se účastní intracelulární a extracelulární regulace exprese LDL-R. Autozomálně dominantní mutace PCSK9 vede k familiární hypercholesterolemii (FH), zatímco inaktivní mutace snižují koncentrace LDL-C o 0,3–0,5 mmol/l a také snižují KV riziko o 70–80 %, i když s určitými výjimkami. Aktivita PCSK9 je ovlivněna lačněním, postprandiálním metabolismem lipidů a vlivem hormonů – estrogenů, androgenů a růstového hormonu.
![Obr. 2 Možnosti ovlivnění PCSK9 v léčbě dyslipidemie; podle [21] – Zhang, et al., 2012. LDL-R – receptor pro lipoprotein s nízkou hustotou, PCSK9 – preprotein konvertáza subtilisin kexin 9](https://www.remedia.cz/photo-a-29045---.jpg) Kaskádu LDL-R/PCSK9 lze ovlivnit na několika stupních (obr. 2). Protilátky proti PCSK9 zvyšují expresi LDL-R a snižují plazmatické koncentrace LDL-C o 20 %. Ve fázi klinického výzkumu se nachází řada imunopreparátů proti PCSK9, jako je lidský monoklonální přípravek REGN-727/SAR-236553, AMG-145 a další protilátky, např. NVP-LGT-209. Nadějný je zejména REGN-727, který snižuje u pacientů s FH koncentraci jejich LDL-C o 36–58 % v monoterapii nebo v kombinaci se statinem [22]. Podobné výsledky prokazuje u zdravých dobrovolníků AMG-145.
Kaskádu LDL-R/PCSK9 lze ovlivnit na několika stupních (obr. 2). Protilátky proti PCSK9 zvyšují expresi LDL-R a snižují plazmatické koncentrace LDL-C o 20 %. Ve fázi klinického výzkumu se nachází řada imunopreparátů proti PCSK9, jako je lidský monoklonální přípravek REGN-727/SAR-236553, AMG-145 a další protilátky, např. NVP-LGT-209. Nadějný je zejména REGN-727, který snižuje u pacientů s FH koncentraci jejich LDL-C o 36–58 % v monoterapii nebo v kombinaci se statinem [22]. Podobné výsledky prokazuje u zdravých dobrovolníků AMG-145.
Antisense oligonukleotidy
![Obr. 3 Místo zásahu antisense oligonukleotidů; podle [23] – Toth, 2011. ASO – antisense oligonukleotid, DNA – deoxyribonukleová kyselina, mRNA – mediátorová ribonukleová kyselina (messenger ribonucleic acid)](https://www.remedia.cz/photo-a-29046---.jpg) Expresi genů lze specificky oslabit infuzí krátkých antisense oligonukleotidových (ASO) sekvencí vlákna nukleové kyseliny. Možnost vytváření dvouvláknové RNA je všeobecně známá a představuje jeden z řídících mechanismů exprese genů (obr. 3, obr. 4). Zásahy do struktury RNA jsou nestabilní; lze ovšem vytvořit stabilní oligonukleotidové deriváty, které jsou před hydrolýzou chráněny aditivními blokujícími látkami nebo fixací vláknovité konformace.
Expresi genů lze specificky oslabit infuzí krátkých antisense oligonukleotidových (ASO) sekvencí vlákna nukleové kyseliny. Možnost vytváření dvouvláknové RNA je všeobecně známá a představuje jeden z řídících mechanismů exprese genů (obr. 3, obr. 4). Zásahy do struktury RNA jsou nestabilní; lze ovšem vytvořit stabilní oligonukleotidové deriváty, které jsou před hydrolýzou chráněny aditivními blokujícími látkami nebo fixací vláknovité konformace.
![Obr. 4 Mechanismus účinku antisense oligonukleotidů; podle [24] – Ricotta, et al., 2012. Mipomersen je ASO inhibitor mRNA pro apolipoprotein B-100. ASO jako jednovláknová molekula DNA hybridizuje s cílovou mRNA a vytváří duplex. Poté dojde k aktivaci RNázy H, která uvolňuje fosfodiesterázové vazby mRNA a štěpí ji. ASO je k degradačnímu účinku RNázy H odolný, recykluje a váže se na další mRNA. ASO – antisense oligonukleotid, mRNA – mediátorová ribonukleová kyselina (messenger ribonucleic acid)](https://www.remedia.cz/photo-a-29047---.jpg) Prvním humánním přípravkem, který využívá antisense technologii, je mipomersen (ISIS 301012). Snižuje u lidí koncentrace apoB a LDL-C v závislosti na podané dávce o 20–65 % [25], je účinný u homozygotů i heterozygotů FH, jako aditivní lék ke standardní léčbě snižuje koncentraci LDL-C o dalších 25 % a jeho použití se zdá být relativně bezpečné. Studie s mipomersenem probíhají také v České republice a tyto zkušenosti potvrzují. Mipomersen také snižuje koncentraci Lp(a) – o 25 %, pravděpodobně snížením jeho syntézy. Jeho hlavním nežádoucím účinkem jsou floridní lokální příznaky v místě vpichu na kůži a steatóza jater. Také u pacientů s hypobetalipoproteinemií je steatóza jater častým nálezem, nevede pravděpodobně k progresi do non-alkoholové steatohepatitidy ani cirhózy jater. Mipomersen je v současné době sledován v několika studiích, uvažuje se o jeho schválení do běžného použití a bude pravděpodobně indikován k léčbě zejména u pacientů s těžkou formou FH, kteří vyžadují léčbu LDL aferézou – zde by se mohl stát potenciálně doplňkem a při dobré toleranci a účinnosti také alternativou takové léčby. Druhou skupinou novějších hypolipidemik jsou molekuly zaměřené na léčbu dyslipidemie, tj. snížení hypertriglyceridemie a/nebo zvýšení HDL cholesterolemie.
Prvním humánním přípravkem, který využívá antisense technologii, je mipomersen (ISIS 301012). Snižuje u lidí koncentrace apoB a LDL-C v závislosti na podané dávce o 20–65 % [25], je účinný u homozygotů i heterozygotů FH, jako aditivní lék ke standardní léčbě snižuje koncentraci LDL-C o dalších 25 % a jeho použití se zdá být relativně bezpečné. Studie s mipomersenem probíhají také v České republice a tyto zkušenosti potvrzují. Mipomersen také snižuje koncentraci Lp(a) – o 25 %, pravděpodobně snížením jeho syntézy. Jeho hlavním nežádoucím účinkem jsou floridní lokální příznaky v místě vpichu na kůži a steatóza jater. Také u pacientů s hypobetalipoproteinemií je steatóza jater častým nálezem, nevede pravděpodobně k progresi do non-alkoholové steatohepatitidy ani cirhózy jater. Mipomersen je v současné době sledován v několika studiích, uvažuje se o jeho schválení do běžného použití a bude pravděpodobně indikován k léčbě zejména u pacientů s těžkou formou FH, kteří vyžadují léčbu LDL aferézou – zde by se mohl stát potenciálně doplňkem a při dobré toleranci a účinnosti také alternativou takové léčby. Druhou skupinou novějších hypolipidemik jsou molekuly zaměřené na léčbu dyslipidemie, tj. snížení hypertriglyceridemie a/nebo zvýšení HDL cholesterolemie.
Inhibitory CETP
Jedním z prvních inhibitorů CETP (cholesterylester transfer protein) je torcetrapib. Ve studii ILLUMINATE (Investigation of Lipid Level Management to Understand its Impact in Atherosclerotic Events) vedla léčba torcetrapibem ke zvýšení výskytu KVO o 30 %, což vedlo k předčasnému ukončení veškerého vývoje [26]. Příčinou negativního účinku torcetrapibu bylo zvýšení krevního tlaku o 5/2 mm Hg částečně v důsledku zvýšení tvorby aldosteronu, kortikosteronu a endotelinu-1. Další typy inhibitorů CETP proto podléhají přísnému sledování nežádoucích účinků.
Dalcetrapib zvyšuje koncentraci HDL-C o 25–33 % a má jen malý vliv na koncentraci LDL-C. Nepůsobí zvýšení krevního tlaku ani neovlivňuje hormonální profil. Ve studii zaměřené na funkci endotelu a recentně ve větší studii s 476 pacienty dal-VESSEL nebyl prokázán žádný přínos z léčby dalcetrapibem. Podobně také ve studii dal-PLAQUE, která pomocí kombinace pozitronové emisní tomografie a magnetické rezonance hodnotila aterosklerózu karotických tepen, nebyly prokázány žádné pozitivní změny ve složení plátů a přítomného zánětu [27].
V rámci kongresu American Heart Association 2012 Scientific Sessions a současně v časopise New England Journal of Medicine [28] byly nyní prezentovány výsledky studie dal-OUTCOMES. Ty prokázaly, že u pacientů s recentním akutním koronárním syndromem léčba dalcetrapibem zvyšuje HDL cholesterolemii, ale nevede ke snížení rizika rekurence KV příhody. HDL cholesterolemie se zvýšila o 30 %, u 10 % pacientů dosáhla koncentrace HDL-C dokonce 70 mg/dl. Navíc byla léčba spojena s malým, ale klinicky významným zvýšením krevního tlaku o 0,6 mm Hg. Dr. Gregory Schwartz, hlavní investigátor studie dal-OUTCOMES, uvedl, že léčba u celkem 15 871 pacientů neměla žádný vliv na KV riziko, a domnívá se, že u řádně léčených pacientů s dobře kontrolovanými rizikovými faktory (včetně léčby statiny, duální protidestičkové léčby, léčby betablokátory aj.) nemá změna HDL-C větší klinický význam. Je také možné, že inhibicí CETP dochází k produkci dysfunkčních HDL částic s omezenou schopností reverzního transportu cholesterolu.
V klinickém hodnocení zůstávají dva další inhibitory CETP – evacetrapib a anacetrapib. Ovlivnění morbidity a mortality je testováno v rámci velkých studií fáze III, jejichž výsledky budou k dispozici během několika dalších let.
Dle zatím dostupných výsledků anacetrapib zvyšuje koncentraci HDL-C o 90–130 % a snižuje koncentraci LDL-C
o 30–40 %. Podobně jako dalcetrapib neovlivňuje krevní tlak či jiné bezpečnostní parametry u 1623 pacientů, kteří jsou v rámci studie DEFINE sledováni již více než dva roky. Dále probíhá studie HPS-3/TIMI 55-REVEAL (Randomized EValuation of the Effects of Anacetrapib Through Lipid-modification), zaměřená na KVO u 20 000 pacientů s KVO léčených hypolipidemiky v kombinaci s anacetrapibem [29].
Agonisté PPAR-gamma
Agonisté PPAR-gamma (thiazolidindiony; glitazony) patří mezi léčiva indikovaná primárně k terapii diabetu mellitu, kde snižují koncentraci HbA1c o 0,5–1 %. Kromě toho mají i další účinky – snižují koncentraci triglyceridů o 5–15 % a zvyšují koncentraci HDL-C o 0–4 % [30].
Agonisté PPAR-gamma mají ovšem také významné nežádoucí účinky. Mohou vyvolávat aldosteronem zprostředkovanou retenci tekutin, vedou ke zvýšenému výskytu zlomenin a rosiglitazon zvyšuje výskyt infarktu myokardu. Pioglitazon naproti tomu snižuje výskyt KVO o 12 % (studie ProACTIVE, PROspective PioglitAzone Clinical Trial In MacroVascular Event) [31], ale mírně zvyšuje riziko vzniku karcinomu močového měchýře. Vzhledem ke klinicky malému hypolipidemickému efektu a možným nežádoucím účinkům (viz výše) nelze očekávat větší využití skupiny glitazonů jako hypolipidemik.
Agonisté PPAR-α/gamma
Jiná skupina látek funguje jako současní koagonisté PPAR-α/gamma. Patří mezi ně muraglitazar, tesaglitazar a ragaglitazar. Tyto molekuly dosáhly fáze klinických zkoušek, ale jejich vývoj byl přerušen – z důvodu zvýšení výskytu karcinomu močového měchýře při podávání ragaglitazaru a naveglitazaru v experimentu na zvířatech a léčba muraglitazarem zvyšovala výskyt KVO. Pronádorový účinek je zřejmě zprostředkován agonisty PPAR-α a podobný problém známe i v případě podávání pioglitazonu u lidí.
Takže ve vývoji nakonec pokračuje pouze aleglitazar (R1439). Ve studii SYNCHRONY, která zkoumala 332 diabetiků 2. typu, snižoval aleglitazar v dávce 50–300 µg koncentraci HbA1c o 0,36–1,35 %, triglyceridů o 12–38 %, LDL-C o 3–22 % a zvyšoval koncentraci HDL-C o 12–27 %; léčba nižšími dávkami přitom nevedla k vyššímu výskytu srdečního selhání v důsledku vzestupu hmotnosti a retence tekutin [32]. Probíhá studie ALECARDIO (Aleglitazar Cardiac Outcomes) zahrnující 6000 diabetiků 2. typu s akutním koronárním syndromem léčených aleglitazarem.
Ve fázi I klinického zkoušení je také agonista PPAR-gamma/Δ DB-959. Dokud nebudeme mít k dispozici více údajů z klinických studií, je obtížné určit, zda bude léčba agonisty PPAR-α/gamma možná a úspěšná.
Závěr
Úspěchy v léčbě a prevenci aterosklerotických KVO jsou dány zejména léčbou statiny. Léčbu statiny pokládáme za bezpečnou a dostupnou. Nově vyvíjená hypolipidemika budou muset prokázat podobnou tolerabilitu, bezpečnost a účinnost, ať už v monoterapii, nebo v kombinační léčbě s dosud používanými léčivy. V současné době je kombinace statinů s dalšími hypolipidemiky, jako jsou fibráty, kyselina nikotinová a sekvestranty žlučových kyselin, případně kombinace s ezetimibem, schopna významně a pozitivně ovlivnit dyslipidemii u různých typů pacientů, a má proto největší předpoklady k úspěchu. K ověření bezpečnosti a účinnosti nových molekul bude třeba dalších studií. Ve fázi vývoje se nachází řada molekul založených na klasické inhibici enzymů a receptorů. Jedná se zejména o posílení reverzního transportu cholesterolu (nejenom dosažení zvýšené koncentrace HDL-C v plazmě) a zvýšení clearance LDL-C (paradoxní inhibice PCSK9).
Je třeba poznamenat, že některé molekuly neovlivní koncentrace lipidů v plazmě, a proto se bude muset průkaz jejich účinnosti opírat o nové metody, samozřejmě vedle velkých studií hodnotících KV mortalitu.
Práce byla podpořena projekty IGA MZ ČR NT/12287-5 a PRVOUK P37/12.
Seznam použité literatury
- [1] Expert Panel on Detection Evaluation and Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP). JAMA 2001; 285: 2486–2497.
- [2] British Cardiac Society, British Hypertension Society, Diabetes UK, HEART UK, Primary Care Cardiovascular Society, The Stroke Association. JBS 2: the Joint British Societies’ guidelines for prevention of cardiovascular disease in clinical practice. Heart 2005; 91 (Suppl. V): v1–52.
- [3] Graham I, Atar D, Borch-Johnsen K, et al. European guidelines on cardiovascular disease prevention in clinical practice: executive summary. Atherosclerosis 2007; 194: 1–45.
- [4] Sacks FM. The role of high-density lipoprotein (HDL) cholesterol in the prevention and treatment of coronary heart disease: expert group recommendations. Am J Cardiol 2002; 90: 139–143.
- [5] Danesh J, Erqou S, Walker M, et al. The Emerging Risk Factors Collaboration: analysis of individual data on lipid, inflammatory and other markers in over 1.1 million participants in 104 prospective studies of cardiovascular diseases. Eur J Epidemiol 2007; 22: 839–869.
- [6] Sarwar N, Danesh J, Eiriksdottir G, et al. Triglycerides and the risk of coronary heart disease: 10,158 incident cases among 262,525 participants in 29 Western prospective studies. Circulation 2007; 115: 450–458.
- [7] Chapman MJ, Ginsberg HN, Amarenco P, et al. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J 2011; 32: 1345–1361.
- [8] Bultas, J. Perspektivy hypolipidemické léčby aneb Co umíme a co se nám moc nedaří. Remedia 2011; 21: 100–107.
- [9] Wierzbicki AS, Hardman TC, Viljoen A. New lipid-lowering drugs: an update. Int J Clin Pract 2012; 66: 270–280.
- [10] Wierzbicki AS, Poston R, Ferro A. The lipid and non-lipid effects of statins. Pharmacol Ther 2003; 99: 95–112.
- [11] Preiss D, Sattar N. Statins and the risk of new-onset diabetes: a review of recent evidence. Curr Opin Lipidol 2011; 22: 460–466.
- [12] Jun M, Foote C, Lv J, et al. Effects of fibrates on cardiovascular outcomes: a systematic review and meta-analysis. Lancet 2010; 375: 1875–1884.
- [13] Ginsberg HN, Elam MB, Lovato LC, et al. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 362: 1563–1574.
- [14] Keech AC, Mitchell P, Summanen PA, et al. Effect of fenofibrate on the need for laser treat-ment for diabetic retinopathy (FIELD study): a randomised controlled trial. Lancet 2007; 370 (9600): 1687–1697.
- [15] Junghanns J, Müller RH. Nanocrystal technology, drug delivery and clinical applications. Int J Nanomed 2008; 3: 295–309.
- [16] The Coronary Drug Project Research Group. Clofibrate and niacin in coronary heart disease. JAMA 1975; 231: 360–381.
- [17] AIM-HIGH investigators. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med 2011; 365: 2255–2267.
- [18] Kastelein JJP, Akdim F, Stroes ESG, et al. Simvastatin with or without Ezetimibe in Familial Hypercholesterolemia. N Engl J Med 2008; 358: 1431–1443.
- [19] Rossebo AB, Pederson TR, Boman K, et al. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. SEAS Investigators. N Engl J Med 2008, 359: 1343–1356.
- [20] Wierzbicki AS. The ezetimibe Jonah: the trials and tribulations of an unlucky drug. Int J Clin Pract 2011; 65: 1207–1208.
- [21] Zhang L, McCabe T, Condra JH, et al. An Anti-PCSK9 Antibody Reduces LDL-Cholesterol On Top Of A Statin And Suppresses Hepatocyte SREBP-Regulated Genes. Int J Biol Sci 2012; 8: 310–327.
- [22] Swergold G, Smith W, Mellis S, et al. Inhibition of proprotein convertase subtilisin/kexin type 9 with a monoclonal antibody REGN727/SAR236553, effectively reduces low-density-lipoprotein cholesterol, as mono or add-on therapy in heterozygous familial and non familial hypercholesterolemia. Circulation 2011; 124 (21 Suppl.): A16265 [abstract].
- [23] Toth PP. Antisense concept. Antisense therapy and emerging applications for the management of dyslipidemia. J Clin Lipidol 2011; 5: 441–449.
- [24] Ricotta DN, Frishman W. Mipomersen: A Safe and Effective Antisense Therapy Adjunct to Statins in Patients With Hypercholesterolemia. Cardiol Rev 2012; 20: 90–95.
- [25] Kastelein JJ, Wedel MK, Baker BF, et al. Potent reduction of apolipoprotein B and low-density lipoprotein cholesterol by short-term administration of an antisense inhibitor of apolipoprotein B. Circulation 2006; 114: 1729–1735.
- [26] Barter PJ, Caulfield M, Eriksson M, et al. Effects of torcetrapib in patients at high risk for coronary events. N Engl J Med 2007; 357: 2109–2122.
- [27] Fayad ZA, Mani V, Woodward M, et al. Safety and efficacy of dalcetrapib on atherosclerotic disease using novel non-invasive multimodality imaging (dal-PLAQUE): a randomised clinical trial. Lancet 2011; 378: 1547–1559.
- [28] Schwartz GG, Olsson AG, Abt A, et al. Effects of Dalcetrapib in Patients with a Recent Acute Coronary Syndrome. N Engl J Med 2012. DOI: 10.1056/NEJMoa1206797.
- [29] CTSU University of Oxford. REVEAL: Randomized EValuation of the Effects of Anacetrapib Through Lipid-modification. Clinical Trials Gov. 1 December 2010. http://clinicaltrials.gov/ct2/show/NCT01252953 (accessed February 2011).
- [30] Stumvoll M, Haring HU. Glitazones: clinical effects and molecular mechanisms. Ann Med 2002; 34: 217–224.
- [31] Dormandy JA, Charbonnel B, Eckland DJ, et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366: 1279–1289.
- [32] Henry RR, Lincoff AM, Mudaliar S, et al. Effect of the dual peroxisome proliferator-activated receptor-alpha /gamma agonist aleglitazar on risk of cardiovascular disease in patients with type 2 diabetes (SYNCHRONY): a phase II, randomised, dose-ranging study. Lancet 2009; 374: 126–135.