Strategie podávání inzulinu u nemocných s diabetem 2. typu
Diabetes mellitus 2. typu je onemocnění, které je provázeno prohlubující se poruchou v sekreci inzulinu. U většiny nemocných je nutné ve fázi, která obvykle odpovídá poklesu sekreční kapacity B buněk pod 20 % normy, přistoupit k léčbě inzulinem. Léčbu inzulinem zahajujeme zpravidla v období, kdy nejsme schopni dosáhnout uspokojivé kompenzace perorálními antidiabetiky (PAD), a inzulin zůstává v současné době lékem druhé volby. Hlavním důvodem tohoto pragmatického přístupu není jen nutnost parenterální aplikace inzulinu, vyšší riziko hypoglykemií a přírůstků hmotnosti, ale zejména skutečnost, že v současné době chybějí přesvědčivé doklady o výhodách časné léčby inzulinem oproti léčbě PAD z hlediska snížení rizika kardiovaskulárních komplikací, mikrovaskulárních komplikací, nádorové mortality a prevence progresivního selhání B buněk. V léčbě můžeme použít veškeré dostupné inzulinové přípravky včetně inzulinových analog. U nemocných s diabetem 2. typu není potvrzeno, jaký inzulinový režim je nejvýhodnější z hlediska dlouhodobé prognózy nemocných, proto léčbu zahajujeme obvykle jednodušším schématem. Prakticky volíme některý z konvenčních nebo intenzifikovaných režimů. Při volbě léčebné strategie vycházíme z klinického obrazu choroby. Pro klinický odhad potřeby inzulinoterapie a substituce bazální a prandiální sekrece inzulinu postačuje hladina HbA1c, výše glykemie nalačno a postprandiálně. Pokud nejsou přítomny kontraindikace, inzulin podávaný v jakémkoli režimu vždy kombinujeme s podáváním metforminu.
Diabetes mellitus 2. typu (DM2) je jedním z projevů metabolického syndromu. Onemocnění je provázeno rozvojem dlouhodobých makrovaskulárních a mikrovaskulárních komplikací a je spojeno s vyšším rizikem nádorů. Základní patogenetickou odchylkou při rozvoji diabetu 2. typu je inzulinová rezistence, ale rozhodujícím faktorem, který podmiňuje progresi glukózové intolerance od normálního stavu až k manifestaci diabetu a stojí v pozadí typického „zhoršování“ klinického obrazu diabetu 2. typu, je progresivní selhání B buněk. V současné době neexistuje způsob, jak postupující selhání zastavit. V určité fázi, která obvykle odpovídá poklesu sekreční schopnosti B buněk pod 20 % normy, je léčba inzulinem nezastupitelná a jediná schopná udržet hladinu glykemie v požadovaném rozmezí.
Postavení inzulinu v léčbě nemocného s DM 2. typu
V současné době zůstává inzulin u nemocných s diabetem mellitem 2. typu stále lékem druhé volby. Léčbu inzulinem zahajujeme obvykle v období, kdy nejsme schopni dosáhnout uspokojivé kompenzace perorálními antidiabetiky (PAD). Hlavním důvodem tohoto pragmatického přístupu není jen nutnost parenterální aplikace inzulinu, vyšší riziko hypoglykemií a přírůstků hmotnosti, ale zejména skutečnost, že v současné době chybějí přesvědčivé doklady o výhodách časné léčby inzulinem oproti léčbě perorálními antidiabetiky z hlediska snížení rizika kardiovaskulárních (KV) komplikací, mikrovaskulárních komplikací, nádorové mortality a prevence progresivního selhání B buněk [1].
Inzulin a kardiovaskulární mortalita a morbidita
KV komplikace jsou nejčastější příčinou úmrtí nemocných s diabetem. O významu normoglykemie v redukci rizika KV onemocnění diabetiků se stále diskutuje. O rizikovosti hyperglykemie svědčí celá řada epidemiologických sledování, v nichž je, kromě lačné glykemie a HbA1c, s nejvyšším rizikem spojována postprandiální hyperglykemie (PPG). Každý pokles HbA1c, byť v oblasti vysoce patologických hodnot, je sledován snížením KV rizika. Výsledky intervenčních studií sledujících efekt léčby zaměřené na snížení glykemií však nejsou ve srovnání s hypolipidemickou a antihypertenzní léčbou přesvědčivé. Upozorňují však na poměrně dlouhou dobu latence, po které se může příznivý efekt normoglykemie projevit, a na nutnost diferencovaného přístupu k nemocným. Významně příznivý efekt na redukci KV rizika má těsná kompenzace diabetu zejména u osob časně po záchytu cukrovky v primární KV prevenci. Uplatňuje se tzv. metabolická paměť. Naopak příliš agresivní léčba hyperglykemie u diabetiků s pokročilými komplikacemi a již manifestním KV onemocněním může kardiovaskulární riziko úmrtí dokonce zvýšit, pravděpodobně v souvislosti s výskytem hypoglykemií.
V současné době není jasné, zda jsou některá farmaka používaná v léčbě hyperglykemie specificky výhodná z hlediska KV mortality, abychom byli oprávněni použít jich jako léků první volby. Z dosavadních intervenčních studií sledujících KV mortalitu vyplývá, že léčba inzulinem je relativně bezpečná, nicméně nepřináší nemocným významné výhody z hlediska rizika KV onemocnění (UKPDS, DIGAMI 2) [2, 3]. Rozhodujícím faktorem je dosažená kompenzace, nikoli prostředek, kterým jí bylo dosaženo. Obdobně bezpečná je léčba metforminem (UKPDS) [2], pioglitazonem (PROACTIVE) [4], rosiglitazonem (RECORD, BARI2D) [5, 6], akarbózou (STOP-NIDDM) [7], ale také deriváty sulfonylurey (UKPDS, ADVANCE) [2, 8]. Doklady pro KV bezpečnost zatím logicky chybějí u novějších látek s inkretinovým účinkem. Hlavní překážkou v dosažení těsné kompenzace jsou hypoglykemie, o nichž je také známo, že zvyšují KV mortalitu (VADT) [9]. Je proto logické, že přednost by měla mít farmaka, jejichž podávání je spojeno s nízkým rizikem hypoglykemií, což je fakt, který teoreticky svědčí proti použití inzulinu jako léku první volby.
Inzulin a nádorová onemocnění
Diabetes mellitus zvyšuje v epidemiologických sledováních riziko nádorových onemocnění – například riziko karcinomu (ca) prsu 1,2krát, ca pankreatu 1,8krát, ca endometria 2krát, riziko kolorektálního ca 1,3krát, ca močového měchýře 1,2krát. V intervenčních studiích však léčba hyperglykemie nevede k významné redukci rizika nádorových onemocnění. Inzulin má prokazatelný mitogenní a proliferační efekt in vitro. Výsledky epidemiologických observačních studií a metaanalýz dostupných intervenčních studií ukazují, že léčba inzulinem (bez ohledu na typ) zvyšuje riziko vzniku karcinomů [10]. Toto riziko se zvyšuje úměrně s celkovou dávkou inzulinu (dobou expozice). Při izolované léčbě inzulinem v trvání delším než 15 let se riziko vzniku karcinomu zvyšuje až pětkrát. Zatím dostupná klinická data, byť operující s malými čísly, nesignalizují vyšší riziko vzniku karcinomu u inzulinových analog (ultrakrátce působící analoga, detemir ani glargin) proti humánnímu inzulinu.
Pro strategii podávání kombinace inzulinu s metforminem, kterou v současné době u nemocných s DM2 doporučujeme, svědčí epidemiologická sledování, v nichž metformin jednoznačně snižuje riziko vývoje ca (RR 0,8) a při současném podávání s inzulinem snižuje inzulinem zvýšené riziko karcinogeneze na polovinu [10]. Existují také doklady, že léčba metforminem zlepšuje odpověď ca prsu na chemoterapii, blokuje růst tumoru a prodlužuje remisi [11]. Podobně nadějné jsou glitazony – metaanalýzy zatím ukončených studií ukazují na jejich bezpečnost. Naopak deriváty sulfonylurey pravděpodobně zvyšují riziko karcinogeneze asi 1,3krát. Farmaka ze skupiny inkretinů zatím nejsou k dispozici dostatečně dlouhou dobu, aby bylo možné jejich případné dopady na riziko nádorového bujení definitivně shrnout.
Inzulin a mikrovaskulární komplikace diabetu (retinopatie, nefropatie, neuropatie)
Normoglykemie redukuje riziko mikrovaskulárních komplikací u DM2 bez ohledu na způsob farmakoterapie.
Inzulin a progrese selhání B buněk
V průběhu DM2 dochází k progresivnímu úbytku v sekreci inzulinu. Určitý ochranný vliv na B buňky má normoglykemie. Z dlouhodobého hlediska však v současné době nemáme k dispozici žádné léčebné prostředky, kterými bychom mohli postupující úbytek sekrece inzulinu zastavit. Určitý ochranný vliv, který se však pohybuje řádově v měsících, byl popsán u glitazonů a zatím v experimentálních podmínkách při inkretinové léčbě. Dosud nejsou k dispozici jasné doklady, které by prokazovaly případný ochranný vliv časné léčby inzulinem, naopak v UKPDS progreduje selhání při všech způsobech léčby, včetně inzulinoterapie [2]. S netrpělivostí jsou očekávány výsledky studie ORIGIN [12], která testuje vliv časného podání glarginu u osob s poruchou glukózové homeostázy či s nově zjištěným DM2 na progresi selhání B buněk a KV mortalitu a která možná přinese změny v zavedené léčebné strategii.
Inzulin a nárůst hmotnosti
![Graf 1 Vývoj hmotnosti v průběhu léčby diabetu 2. typu ve studii UKPDS a ADOPT; podle [2, 13] – Holman, et al., 2008; Kahn, et al., 2006.](https://www.remedia.cz/photo-a-27911---.jpg) Manifestace DM 2. typu a jeho léčba je provázena kontinuálním nárůstem hmotnosti, který je nejvíce patrný v prvních třech letech po manifestaci onemocnění. Nárůst hmotnosti v průběhu léčby je jedním z nejčastějších nežádoucích důsledků léčby diabetu, které mohou negativně ovlivňovat původně příznivé účinky režimových opatření a použitých hypolipidemik, antihypertenziv i hypoglykemizujících prostředků. Nárůst hmotnosti v průběhu léčby diabetu ve studii UKPDS [2] a ADOPT [13] dokumentuje graf 1. Obdobně bylo v recentních intervenčních studiích, které testovaly vliv těsné kompenzace na KV mortalitu, dokumentováno, že intenzivní léčba vedoucí k nižším hodnotám HbA1c je provázena většími hmotnostními přírůstky než konvenční léčba diabetu [4, 5, 8, 14]. Inzulin je z hlediska hmotnosti nejobávanějším ze všech hypoglykemizujících farmak. Kromě poklesu ztrát glukózy močí hraje při léčbě inzulinem roli i skutečné zvýšení energetického příjmu v dietě. Jeho příčinou bývá strach z hypoglykemií, které nemocný preventivně zajídá, nebo je to zajídání skutečných či domnělých hypoglykemií, které mohou nepřiměřenou léčbu inzulinem provázet.
Manifestace DM 2. typu a jeho léčba je provázena kontinuálním nárůstem hmotnosti, který je nejvíce patrný v prvních třech letech po manifestaci onemocnění. Nárůst hmotnosti v průběhu léčby je jedním z nejčastějších nežádoucích důsledků léčby diabetu, které mohou negativně ovlivňovat původně příznivé účinky režimových opatření a použitých hypolipidemik, antihypertenziv i hypoglykemizujících prostředků. Nárůst hmotnosti v průběhu léčby diabetu ve studii UKPDS [2] a ADOPT [13] dokumentuje graf 1. Obdobně bylo v recentních intervenčních studiích, které testovaly vliv těsné kompenzace na KV mortalitu, dokumentováno, že intenzivní léčba vedoucí k nižším hodnotám HbA1c je provázena většími hmotnostními přírůstky než konvenční léčba diabetu [4, 5, 8, 14]. Inzulin je z hlediska hmotnosti nejobávanějším ze všech hypoglykemizujících farmak. Kromě poklesu ztrát glukózy močí hraje při léčbě inzulinem roli i skutečné zvýšení energetického příjmu v dietě. Jeho příčinou bývá strach z hypoglykemií, které nemocný preventivně zajídá, nebo je to zajídání skutečných či domnělých hypoglykemií, které mohou nepřiměřenou léčbu inzulinem provázet.
Rovněž se může uplatnit i přímý anabolický efekt inzulinu. Inzulin stimuluje lipogenezi a tlumí lipolýzu v tukové tkáni; navíc ovlivňuje centrum sytosti a hladu v CNS.
Indikace léčby inzulinem u DM 2. typu
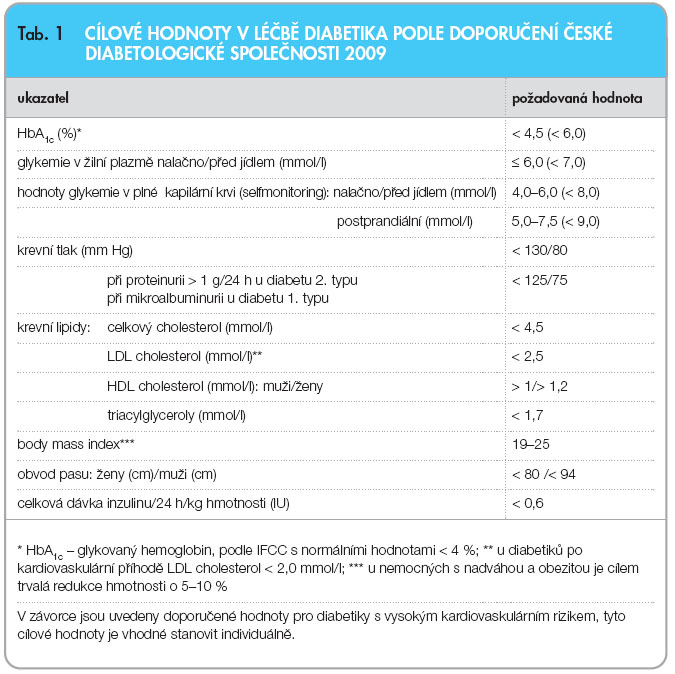 Důvodem převodu nemocného s DM 2. typu na inzulinoterapii je obvykle selhání léčby PAD, může jím být také alergie na PAD, gravidita, těžší nedostatečnost ledvin a jater a stavy spojené s přechodnou dekompenzací cukrovky. Přítomnost dlouhodobých cévních komplikací cukrovky není sama o sobě indikací k převodu na léčbu inzulinem, pokud jsou nemocní těsně kompenzováni dietou či PAD. Tolerovanou hodnotou u nemocných s diabetem je HbA1c do 5,3 %. Je logické, že této kompenzace naprostá většina nemocných s chronickými komplikacemi nedosahuje a v klinické praxi by prakticky všichni nemocní například se syndromem diabetické nohy či s diabetickou neuropatií měli být léčeni inzulinem. Převod na inzulin indikujeme u nemocného s DM 2. typu na základě klinických projevů a laboratorních ukazatelů stavu kompenzace (HbA1c, glykemie preprandiální a postprandiální). Stanovení hodnoty C-peptidu není při rozhodování o převedení na léčbu inzulinem rozhodující. Cílové hodnoty v léčbě diabetika, které vycházejí z doporučení České diabetologické společnosti (tab. 1 [15].
Důvodem převodu nemocného s DM 2. typu na inzulinoterapii je obvykle selhání léčby PAD, může jím být také alergie na PAD, gravidita, těžší nedostatečnost ledvin a jater a stavy spojené s přechodnou dekompenzací cukrovky. Přítomnost dlouhodobých cévních komplikací cukrovky není sama o sobě indikací k převodu na léčbu inzulinem, pokud jsou nemocní těsně kompenzováni dietou či PAD. Tolerovanou hodnotou u nemocných s diabetem je HbA1c do 5,3 %. Je logické, že této kompenzace naprostá většina nemocných s chronickými komplikacemi nedosahuje a v klinické praxi by prakticky všichni nemocní například se syndromem diabetické nohy či s diabetickou neuropatií měli být léčeni inzulinem. Převod na inzulin indikujeme u nemocného s DM 2. typu na základě klinických projevů a laboratorních ukazatelů stavu kompenzace (HbA1c, glykemie preprandiální a postprandiální). Stanovení hodnoty C-peptidu není při rozhodování o převedení na léčbu inzulinem rozhodující. Cílové hodnoty v léčbě diabetika, které vycházejí z doporučení České diabetologické společnosti (tab. 1 [15].
Inzulinové přípravky
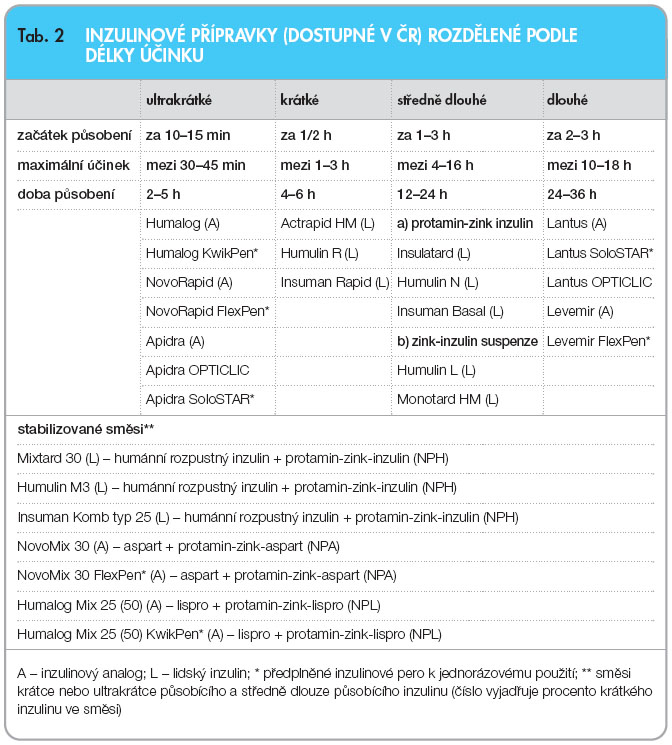 V současné době jsou v léčbě cukrovky užívány inzuliny lidské (humánní) a inzulinová analoga. Koncentrace inzulinu v přípravcích dostupných u nás je 100 IU/ml. Inzulin je distribuován v lahvičkách po 10 ml nebo v bombičkách (cartridge, penfilly, patrony) po 3,0 ml pro inzulinová pera. V letošním roce se objevila také jednorázová inzulinová pera s předplněným inzulinem. Podle rychlosti nástupu biologického účinku, vrcholu působení a trvání účinku po s.c. podání dělíme inzuliny na ultrakrátce působící, krátce působící, středně dlouze a dlouze působící. Inzulinové přípravky dostupné u nás a rozdělené podle délky účinku znázorňuje tab. 2. Udávané časy popisující účinek inzulinu jsou pouze orientační vzhledem k intraindividuální a interindividuální variabilitě v absorpci inzulinu [16].
V současné době jsou v léčbě cukrovky užívány inzuliny lidské (humánní) a inzulinová analoga. Koncentrace inzulinu v přípravcích dostupných u nás je 100 IU/ml. Inzulin je distribuován v lahvičkách po 10 ml nebo v bombičkách (cartridge, penfilly, patrony) po 3,0 ml pro inzulinová pera. V letošním roce se objevila také jednorázová inzulinová pera s předplněným inzulinem. Podle rychlosti nástupu biologického účinku, vrcholu působení a trvání účinku po s.c. podání dělíme inzuliny na ultrakrátce působící, krátce působící, středně dlouze a dlouze působící. Inzulinové přípravky dostupné u nás a rozdělené podle délky účinku znázorňuje tab. 2. Udávané časy popisující účinek inzulinu jsou pouze orientační vzhledem k intraindividuální a interindividuální variabilitě v absorpci inzulinu [16].
Krátce působící humánní inzuliny a ultrakrátce působící inzulinová analoga (lispro, aspart, glulisin) používáme v intenzifikovaných inzulinových režimech k náhradě prandiální potřeby inzulinu, případně ke korekci hyperglykemie. Ultrakrátká inzulinová analoga se ve srovnání s krátce působícími lidskými inzuliny rychleji a pravidelněji vstřebávají z podkoží a zatím nejlépe z dostupných inzulinů napodobují prandiální sekreci. Je možné je aplikovat těsně před jídlem či po jídle, ačkoli nejfyziologičtější farmakokinetický profil, provázený poklesem postprandiálních glykemií a HbA1c, je při aplikaci 10–15 minut před jídlem. Brání hyperglykemii v časné fázi po příjmu potravy, a protože mají kratší biologický poločas, jsou spojena s nižším rizikem hypoglykemií za 3–4 hodiny po jídle. To jsou vlastnosti, které by mohly být teoreticky výhodné u obézních jedinců. Mezi jednotlivými analogy existují drobné rozdíly ve farmakokinetice. Výhodou glulisinu proti ostatním ultrakrátkým inzulinovým analogům by mohlo být pravidelnější vstřebávání z podkoží u obézních nemocných [17]. Rozdíl je připisován odlišné chemické struktuře glulisinu a nepřítomnosti zinku v přípravku. U obézních diabetiků 2. typu byly po podání glulisinu dokumentovány nižší postprandiální výkyvy glykemií než po aplikaci inzulinu lispro [18].
V klinických podmínkách však nejsou rozdíly mezi ultrakrátce působícími inzulinovými analogy pravděpodobně významné. Zcela přesvědčivé nejsou ani výsledky posledních metaanalýz z hlediska klinického přínosu inzulinu působícího ultrakrátce proti humánnímu krátce působícímu inzulinu [19, 20].
Středně dlouze působící (NPH) humánní inzuliny a dlouze působící inzulinová analoga (detemir a glargin) užíváme k náhradě bazální sekrece inzulinu. Podávají se obvykle 1krát denně. U glarginu není rozdíl mezi podáváním ráno, večer, nebo ve 22 hodin. U nemocných s diabetem 1. typu je třeba při kombinaci s ultrakrátkými analogy rozdělit detemir do dvou denních dávek, méně často je třeba použít dvou denních dávek i u glarginu [21]. U nemocných s diabetem 2. typu podáváme glargin i detemir jedenkrát denně, zpravidla ve večerních hodinách.
-
menší hmotnostní přírůstky,
-
nižší riziko hypoglykemií zejména v nočních hodinách,
-
snížení glykemie nalačno,
-
nižší fluktuace glykemií,
-
klinicky významné je, že dlouze působící inzulinová analoga zvyšují šance dosáhnout bezpečných hodnot HbA1c < 6 % bez rizika nočních hypoglykemií [23, 24].
Rozdíly mezi glarginem a detemirem nejsou pravděpodobně u nemocných s DM 2. typu klinicky významné. Nižší hmotnostní přírůstky a potenciální výhody podávání u obézních osob jsou uváděny zejména u inzulinu detemiru. Ve srovnání s NPH jsou hmotnostní přírůstky při podávání detemiru asi o polovinu nižší než při léčbě inzulinem NPH, a to jak u diabetiků 1. typu, tak u nemocných s DM 2. typu [25, 26]. Tento příznivý efekt se dává do souvislosti s přítomností kyseliny myristové v molekule detemiru a s možným přímým účinkem v CNS. V poslední době se však zprávy o nižších hmotnostních přírůstcích ve srovnání s NPH inzulinem objevují také u inzulinu glarginu, a to zejména pokud se výsledky vztahují k celkové dávce inzulinu a dosažené kompenzaci cukrovky [27, 28].
Přímé srovnání glarginu a detemiru bylo testováno v randomizované studii s uspořádáním head to head, která trvala 52 týdnů [29]; do studie bylo zařazeno 319 osob, kterým byl přidán k léčbě PAD glargin, nebo detemir. Účinnost obou režimů byla zcela srovnatelná, pouze denní dávka detemiru byla o jednu třetinu vyšší než denní dávka glarginu. Dávka inzulinu se však zcela vyrovnala, pokud byl detemir dávkován pouze 1krát denně. Další přímé srovnání bylo zveřejněno v letošním roce: do studie trvající 24 týdnů bylo zařazeno 973 pacientů s DM 2. typu léčených metforminem, kterým byl přidán detemir, nebo glargin [30]. Oba inzuliny vedly k poklesu HbA1c, k dosažení srovnatelné kompenzace byla potřebná vyšší denní dávka detemiru (76,5 j/d) než glarginu (43,5 j/d), podávání detemiru však bylo provázeno zhruba o polovinu nižším hmotnostním přírůstkem (+0,6 kg vs. +1,4 kg). Obdobné výsledky, tj. vyšší dávku k dosažení poklesu HbA1c o 1 % nutnou ke kompenzaci u detemiru ve srovnání s glarginem (36 IU/d vs. 26,7 IU/d) a nižší, byť ne významně, vzestupy hmotnosti (+1,7 kg vs. +2,3 kg), přinesla i metaanalýza randomizovaných kontrolovaných studií u pacientů s DM 2. typu (Dailey et al, EASD 2009), do níž bylo zařazeno 4295 osob léčených glarginem a 1086 osob léčených detemirem.
Stabilizované směsi inzulinu (kombinované inzuliny)
Jde o neutrální suspenze protamin-zink-inzulinu (humánní, aspart či lispro) v roztoku rozpustného krátce nebo ultrakrátce působícího inzulinu (humánní, aspart či lispro) v určitém poměru s bifázickým účinkem (číslo značí podíl krátce působícího humánního inzulinu v procentech, tj. například Humulin M3 (obsahuje 30 % rozpustného humánního inzulinu a 70 % NPH inzulinu). Indikace těchto inzulinů je vhodná u inzulinových režimů, kde používáme v jedné dávce kombinace krátce působícího a středně dlouze působícího inzulinu.
Volba inzulinového režimu
U nemocných s diabetem 2. typu není potvrzeno, jaký inzulinový režim je nejvýhodnější z hlediska KV mortality a dlouhodobé prognózy, ani z hlediska ovlivnění přirozeného průběhu choroby (progrese sekrečního defektu). Zatím ani jedna mortalitní studie srovnávající iniciaci konvenčním a intenzifikovaným režimem neprokázala významné rozdíly v KV mortalitě po pěti letech léčby [31].
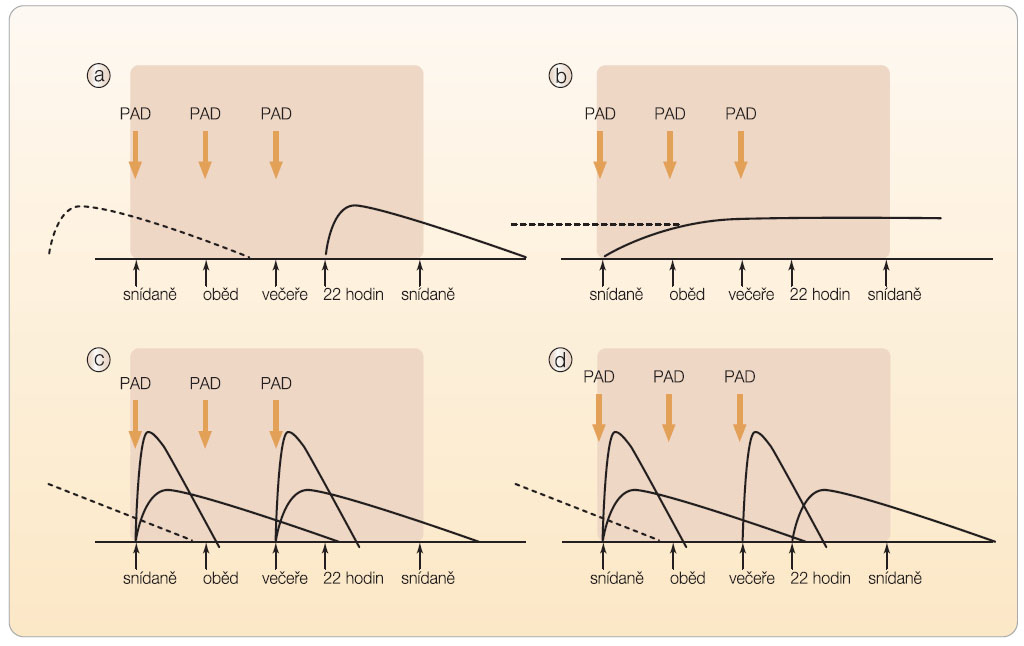 Stejně tak není u DM 2. typu zcela jasné, který režim je výhodnější z hlediska dosažené kompenzace, hmotnosti, dávek inzulinu. Prakticky volíme některý z konvenčních (obr. 1) nebo intenzifikovaných režimů (obr. 2). Při volbě léčebné strategie vycházíme z klinického obrazu choroby. Pro klinický odhad potřeby inzulinoterapie a substituce bazální a prandiální sekrece inzulinu postačuje hladina HbA1c, výše glykemie nalačno a postprandiálně. Pokud nejsou přítomny kontraindikace, inzulin vždy kombinujeme s metforminem.
Stejně tak není u DM 2. typu zcela jasné, který režim je výhodnější z hlediska dosažené kompenzace, hmotnosti, dávek inzulinu. Prakticky volíme některý z konvenčních (obr. 1) nebo intenzifikovaných režimů (obr. 2). Při volbě léčebné strategie vycházíme z klinického obrazu choroby. Pro klinický odhad potřeby inzulinoterapie a substituce bazální a prandiální sekrece inzulinu postačuje hladina HbA1c, výše glykemie nalačno a postprandiálně. Pokud nejsou přítomny kontraindikace, inzulin vždy kombinujeme s metforminem.
Jedna dávka bazálního inzulinu a postupné přidávání dávek
 Přednost dáváme zahájení léčby podle jednoduššího inzulinového schématu. Obvykle zahajujeme jednou dávkou inzulinu denně a počet dávek postupně zvyšujeme. Pro tuto strategii svědčí závěry prakticky zaměřené studie 4T (Treating-To-Target in Type 2 Diabetes) [32], která srovnávala efektivitu 3 různých iniciačních inzulinových režimů: a) premixovaný inzulin 2krát denně, b) prandiální inzulin 3krát denně a c) bazální inzulin 1–2krát denně u nemocných s DM 2. typu, kteří nebyli dostatečně kompenzováni při léčbě metforminem a deriváty sulfonylurey. U tří čtvrtin nemocných bylo nutné po roce léčby přidat další typ inzulinu a použít komplexní inzulinový režim. Nicméně nemocní zahajující léčbu bazálním inzulinem měli méně hypoglykemií a méně přibírali na hmotnosti (po 3 letech přibrali v průměru 5,7 kg, 6,4 kg a 3,6 kg), přitom dosáhli častěji cílových hodnot HbA1c a SMBG (selfmonitoring glykemií) než pacienti léčení mixovaným inzulinem.
Přednost dáváme zahájení léčby podle jednoduššího inzulinového schématu. Obvykle zahajujeme jednou dávkou inzulinu denně a počet dávek postupně zvyšujeme. Pro tuto strategii svědčí závěry prakticky zaměřené studie 4T (Treating-To-Target in Type 2 Diabetes) [32], která srovnávala efektivitu 3 různých iniciačních inzulinových režimů: a) premixovaný inzulin 2krát denně, b) prandiální inzulin 3krát denně a c) bazální inzulin 1–2krát denně u nemocných s DM 2. typu, kteří nebyli dostatečně kompenzováni při léčbě metforminem a deriváty sulfonylurey. U tří čtvrtin nemocných bylo nutné po roce léčby přidat další typ inzulinu a použít komplexní inzulinový režim. Nicméně nemocní zahajující léčbu bazálním inzulinem měli méně hypoglykemií a méně přibírali na hmotnosti (po 3 letech přibrali v průměru 5,7 kg, 6,4 kg a 3,6 kg), přitom dosáhli častěji cílových hodnot HbA1c a SMBG (selfmonitoring glykemií) než pacienti léčení mixovaným inzulinem.
Prakticky postupujeme tak, že aplikujeme malou dávku středně dlouze působícího inzulinu ve 22 hodin (obr. 1a). Potlačíme tak noční glukoneogenezi a snížíme ranní glykemii. K úhradě bazální potřeby je možné použít také dlouze působící inzulinová analoga glargin nebo detemir v jedné večerní dávce (obr. 1b). Otázkou je maximální dávka bazálního inzulinu za den. U NPH inzulinu na noc začínáme dávkami kolem 12 jednotek a postupně zvyšujeme dávky při kontrole nočního profilu. Podle našich zkušeností by dávka NPH neměla překročit 28 jednotek. Dávka glarginu/detemiru by neměla překročit 50 IU. Při nutnosti vyššího dávkování již hraje roli i postprandiální hyperglykemie. Rozumnějším doporučením je pravděpodobně nezvyšovat dávky glarginu/detemiru nad 40 IU a dříve přidat prandiální inzulin. Stejně tak není u DM 2. typu vhodné rozdělovat podání dlouze působícího inzulinu do dvou dávek, ale spíše včas přidat prandiální dávky inzulinu. Substitucí bazální dávky inzulinu můžeme být úspěšní asi u poloviny nemocných s diabetem 2. typu. Zbylých 50 % vyžaduje léčbu postprandiálního stavu [33, 34]. Vždy kombinujeme s metforminem. V trojkombinaci můžeme ponechat deriváty sulfonylurey s kratším biologickým poločasem (glipizid, gliklazid) či prandiální sekretagoga typu repaglinidu. Velmi nadějná je trojkombinace jedné dávky inzulinu s metforminem a inkretinovými mimetiky nebo gliptiny. Sitagliptin má pro tuto kombinaci již oficiální schválení, povolení pro ostatní inkretinová mimetika a gliptiny je pouze otázkou času.
Prandiální potřebu inzulinu a nutnost přidání dávek inzulinu signalizuje postprandiální hyperglykemie, kterou měříme za 1–2 hodiny po jídle, a hladiny HbA1c, které nedosahují cílových hodnot. Porucha prandiální sekrece inzulinu se objevuje jako první a má při rozvoji DM 2. typu a jeho progresi největší význam. Hladina HbA1c je více ovlivněna právě postprandiální hyperglykemií a lépe s ní koreluje než hyperglykemie nalačno, a to zejména při nižších hodnotách (HbA1c ≤ 7,5 %). Teprve se zhoršováním kompenzace nabývá na významu bazální hyperglykemie.
Prandiální sekreci nahrazujeme krátce působícím nebo ultrakrátce působícím inzulinem v režimech se dvěma a více dávkami inzulinu, často s použitím stabilizovaných směsí. Další možností je výše uvedená kombinace s inkretinovými mimetiky nebo gliptiny.
K režimu dvou dávek přistupujeme, pokud není uspokojivá kompenzace při jedné dávce, nebo jej použijeme jako úvodní inzulinový režim při zahajování inzulinoterapie.
Jednotlivá dávka je kombinací krátce a středně působícího NPH inzulinu nejčastěji v poměru 1 : 3. Při režimu dvou dávek denně se obvykle udává, že poměr velikosti ranní a večerní dávky je 2 : 1, většina neobézních nemocných s diabetem 2. typu však potřebuje stejnou, nebo dokonce vyšší dávku inzulinu večer. Nepřekračujeme celkovou denní dávku 60 IU. Výhodné je použít mixované humánní inzuliny či stabilizované směsi inzulinu aspart/lispro (obr. 1c).
Důležité je pokračovat v léčbě PAD, zejména metforminem, jinak se rozdělení inzulinu na dvě dávky míjí účinkem. Studie LAPTOP [35] a další ukázaly, že glargin v jedné denní dávce v kombinaci s metforminem a glimepiridem je účinnější než mixovaný humánní inzulin 30/70 ve dvou dávkách denně, a navíc znamená menší riziko hypoglykemií.
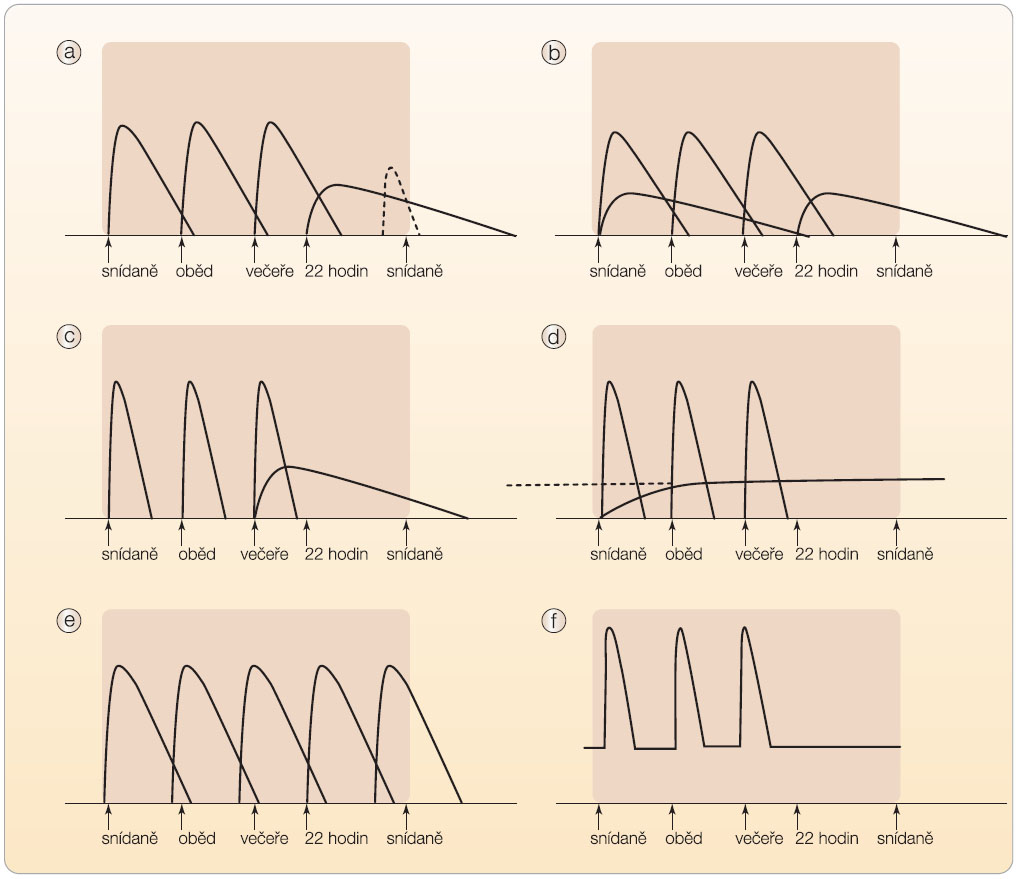
Jaký přínos lze očekávat od stabilizovaných směsí ultrakrátce působících analog, které ve srovnání s humánními mixovanými inzuliny významně redukují postprandiální hyperglykemie? Srovnávací studie s glarginem a humánními mixovanými inzuliny ukazují na vyšší schopnost mixovaných analog snížit HbA1c (cca o 0,5 %), a to zejména u nemocných hůře kompenzovaných při zahájení léčby. Ve studii INITIATE [36], do níž bylo zařazeno 233 nemocných neuspokojivě kompenzovaných při léčbě PAD, bylo podávání stabilizované směsi inzulinu aspart (NovoMix 30) ve dvou dávkách denně provázeno vyšším poklesem HbA1c než podávání glarginu (-3,13 6 1,63 % vs. -2,60 6 1,5 %; p < 0,003) u skupiny s HbA1c > 8,5 %. Rozdíl mezi režimy nebyl významný u nemocných s počátečním HbA1c < 8,5 % (pokles HbA1c -1,4 6 0,55 % vs. -1,42 6 0,59 %; ns). Obdobné výhody proti glarginu u špatně kompenzovaných nemocných byly dokumentovány také u stabilizované směsi inzulinu lispro [37]. Pokud přetrvává neuspokojivá kompenzace, přistupujeme k rozdělení inzulinu do tří dávek denně (obr. 1d), nebo k intenzifikovanému inzulinovému režimu (obr. 2), který má stejná pravidla jako u nemocných s diabetem typu 1. Postupné přidávání dávky je spojeno s dalším zlepšením kompenzace.
Použít můžeme různá schémata. Kromě schémat uvedených na obr. 1 a 2 je možné postupovat nestandardně, například titrováním mixovaného inzulinu (30/70) postupně přidávaného k PAD nejprve večer, pak ráno a nakonec v polední dávce.
Časné podávání prandiálních dávek inzulinu
Drtivá většina obézních nemocných s DM 2. typu má poruchu stimulované sekrece inzulinu a postprandiální hyperglykemii, glykemie nalačno může být řadu měsíců a let normální. Redukce hmotnosti spolu s podáváním malých dávek krátce nebo ultrakrátce působícího inzulinu vždy před jídlem (4–12 j) v kombinaci s metforminem může být proto velmi účinná. Tento režim však vyžaduje intenzivní edukaci a spolupráci nemocného. Pokud je zároveň přítomna hyperglykemie nalačno, využíváme některý z intenzifikovaných inzulinových režimů. S výhodou zahajujeme redukční režim spolu s intenzifikovanou inzulinovou léčbou během hospitalizace v lůžkovém zařízení, které zajistí možnost průběžného monitorování a pružných úprav dávek inzulinu. Tento režim můžeme ponechat i dlouhodobě. Nejčastější chybou je podávání vysokých dávek inzulinu v jedné nebo ve dvou denních dávkách bez snahy o redukci hmotnosti. Přestože práce Yki-Jarvinena a kol. [38] v 90. letech minulého století ukazovaly, že intenzifikovaná léčba nepřináší proti jedné dávce NPH inzulinu na noc v kombinaci s PAD při zahajování inzulinoterapie žádné výhody, naše vlastní zkušenosti s léčbou obézních diabetiků 2. typu dokládají opak [16, 39]. Stejně tak příznivě pro prandiální substituci vyznívá i práce německých autorů [40], která ukazuje lepší kompenzaci a menší hmotnostní přírůstky u nemocných se selháním léčby PAD, u nichž byl použit ultrakrátce působící inzulin ve třech dávkách denně (s bazální substitucí nebo bez ní) ve srovnání s jednou dávkou glarginu. Lepší kompenzace, nižší postprandiální glykemie a zlepšení markerů oxidačního stresu bylo doloženo také pro intenzifikovaný režim (ultrakrátký analog + NPH na noc) ve srovnání se dvěma dávkami NPH inzulinu [41].
Edukace
Edukace je součástí léčby diabetu 2. typu. Opakovaná výuka techniky aplikace inzulinu, selfmonitoringu a úprav inzulinového režimu je podmínkou úspěšné inzulinové léčby. Stejně důležitá je edukace zaměřená na změnu stravovacích zvyklostí a životního stylu, včetně zákazu kouření, a též edukace týkající se prevence komplikací, se zvláštním zřetelem na diabetickou nohu a prevenci aterosklerózy. Podrobné návody jsou předmětem řady publikací [42].
-
Nejčastější chyby v inzulinoterapii nemocných s DM 2. typu:
-
nedostatečná edukace,
-
oddalování inzulinové léčby,
-
podávání inzulinu bez průběžné snahy o redukci hmotnosti,
-
zvyšování celkové dávky inzulinu nad 40–60 IU/den v jedné nebo ve dvou injekcích a otálení s převodem na intenzifikovaný režim.
Práce byla podpořena grantem MZO 00023001.
Seznam použité literatury
- [1] Chiasson JL. Early insulin use in type 2 diabetes: what are the cons? Diabetes Care 2009; 32 (Suppl. 2): S270–274.
- [2] Holman RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359: 1577–1589.
- [3] Malmberg K, Ryden L, Wedel H, et al. Intense metabolic control by means of insulin in patients with diabetes mellitus and acute myocardial infarction (DIGAMI 2): effects on mortality and morbidity. Eur Heart J 2005; 26: 650–661.
- [4] Dormandy JA, Charbonnel B, Eckland DJ, et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366: 1279–1289.
- [5] Home PD, Pocock SJ, Beck-Nielsen H, et al. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open-label trial. Lancet 2009; 373: 2125–2135.
- [6] Frye RL, August P, Brooks MM, et al. 2009. A randomized trial of therapies for type 2 diabetes and coronary artery disease. N Engl J Med 2009; 360: 2503–2515.
- [7] Chiasson JL, Josse RG, Gomis R, et al. Acarbose treatment and the risk of cardiovascular disease and hypertension in patients with impaired glucose tolerance: the STOP-NIDDM trial. JAMA 2003; 290: 486–494.
- [8] Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008; 358: 2560–2572.
- [9] Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009; 360: 129–139.
- [10] Currie CJ, Poole CD, Gale EA. The influence of glucose-lowering therapies on cancer risk in type 2 diabetes. Diabetologia 2009; 52: 1766–1777.
- [11] Hirsch HA, Iliopoulos D, Tsichlis PN, Struhl K. Metformin selectively targets cancer stem cells, and acts together with chemotherapy to block tumor growth and prolong remission. Cancer Res 2009; 69: 7507–7511.
- [12] Origin Trial Investigators, Gerstein H, Yusuf S, Riddle MC, et al. Rationale, design, and baseline characteristics for a large international trial of cardiovascular disease prevention in people with dysglycemia: the ORIGIN Trial (Outcome Reduction with an Initial Glargine Intervention). Am Heart J 2008; 155: 26–32, 32.e21–26.
- [13] Kahn SE, Haffner SM, Heise MA, et al. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N Engl J Med 2006; 355: 2427–2443.
- [14] Gerstein HC, Miller ME, Byington RP, et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008; 358: 2545–2559.
- [15] ČDS. Standardy péče o diabetes mellitus 2. typu. Standardy České diabetologické společnosti. Diabetologie, metabolismus, endokrinologie, výživa 2009.
- [16] Pelikánová T. Léčba inzulinem v éře inzulinových analog. In Trendy soudobé diabetologie XI. T. Pelikánová, editor. Praha; Galén, 2007: 181–245.
- [17] Heise T, Nosek L, Spitzer H, et al. Insulin glulisine: a faster onset of action compared with insulin lispro. Diabetes Obes Metab 2007; 9: 746–753.
- [18] Luzio S, Peter R, Dunseath GJ, et al. A comparison of preprandial insulin glulisine versus insulin lispro in people with Type 2 diabetes over a 12-h period. Diabetes Res Clin Pract 2008;79: 269–275.
- [19] Mannucci E, Monami M, Marchionni N. Short-acting insulin analogues vs. regular human insulin in type 2 diabetes: a meta-analysis. Diabetes Obes Metab 2009; 11: 53–59.
- [20] Singh C, Jovanovic L. Insulin analogues in the treatment of diabetes in pregnancy. Obstet Gynecol Clin North Am 2007; 34: 275–291, ix.
- [21] Ashwell SG, Gebbie J, Home PD. Twice-daily compared with once-daily insulin glargine in people with Type 1 diabetes using meal-time insulin aspart. Diabet Med 2006; 23: 879–886.
- [22] Hirsch IB. Insulin analogues. N Engl J Med 2005; 352: 174–183.
- [23] Rosenstock J, Dailey G, Massi-Benedetti, et al. Reduced hypoglycemia risk with insulin glargine: a meta-analysis comparing insulin glargine with human NPH insulin in type 2 diabetes. Diabetes Care 2005; 28: 950–955.
- [24] Dornhorst A, Luddeke HJ, Sreenan S, et al., and Group, o.b.o.t.P.S. Safety and efficacy of insulin detemir in clinical practice: 14-week follow-up data from type 1 and type 2 diabetes patients in the PREDICTIVE European cohort. Int J Clin Pract 2007; 61: 523–528.
- [25] Hermansen K, Davies M, Derezinski T, wt al.06. A 26-week, randomized, parallel, treat-to-target trial comparing insulin detemir with NPH insulin as add-on therapy to oral glucose-lowering drugs in insulin-naive people with type 2 diabetes. Diabetes Care 2006; 29: 1269–1274.
- [26] Raslova K, Bogoev M, Raz I, et al. Insulin detemir and insulin aspart: a promising basal-bolus regimen for type 2 diabetes. Diabetes Res Clin Pract 2004; 66: 193–201.
- [27] Yki-Jarvinen H, Kauppinen-Makelin R, Tiikkainen M, et al. Insulin glargine or NPH combined with metformin in type 2 diabetes: the LANMET study. Diabetologia 2006; 49: 442–451.
- [28] Goykhman S, Drincic A, Desmangles JC, Rendell M. Insulin Glargine: a review 8 years after its introduction. Expert Opin Pharmacother 2009; 10: 705–718.
- [29] Hollander P, Cooper J, Bregnhoj J, Pedersen CB. A 52-week, multinational, open-label, parallel-group, noninferiority, treat-to-target trial comparing insulin detemir with insulin glargine in a basal-bolus regimen with mealtime insulin aspart in patients with type 2 diabetes. Clin Ther 2008; 30: 1976–1987.
- [30] Swinnen SG, Dain MP, Aronson R, et al. A 24-week, randomized, treat-to-target trial comparing initiation of insulin glargine once-daily with insulin detemir twice-daily in patients with type 2 diabetes inadequately controlled on oral glucose-lowering drugs. Diabetes Care. 2010 Mar 3. [Epub ahead of print].
- [31] Raz I, Wilson PW, Strojek K, et al. Effects of prandial versus fasting glycemia on cardiovascular outcomes in type 2 diabetes: the HEART2D trial. Diabetes Care 2009; 32: 381–386.
- [32] Holman RR, Farmer AJ, Davies MJ, et al. Three-year efficacy of complex insulin regimens in type 2 diabetes. N Engl J Med 2009; 361: 1736–1747.
- [33] Strowig SM, Raskin P. Combination therapy using metformin or thiazolidinediones and insulin in the treatment of diabetes mellitus. Diabetes Obes Metab 2005; 7: 633–641.
- [34] Riddle MC. Glycemic management of type 2 diabetes: an emerging strategy with oral agents, insulins, and combinations. Endocrinol Metab Clin North Am 2005; 34: 77–98.
- [35] Janka HU, Plewe G, Riddle MC, et al. Comparison of basal insulin added to oral agents versus twice-daily premixed insulin as initial insulin therapy for type 2 diabetes. Diabetes Care 2005; 28: 254–259.
- [36] Raskin P, Allen E, Hollander P, et al. Initiating insulin therapy in type 2 Diabetes: a comparison of biphasic and basal insulin analogs. Diabetes Care 2005; 28: 260–265.
- [37] Malone JK, Bai S, Campaigne BN, et al. Twice-daily pre-mixed insulin rather than basal insulin therapy alone results in better overall glycaemic control in patients with Type 2 diabetes. Diabet Med 2005; 22: 374–381.
- [38] Yki-Jarvinen H, Kauppila M, Kujansuu E, et al. Comparison of insulin regimens in patients with non-insulin-dependent diabetes mellitus. N Engl J Med 1992; 327: 1426–1433.
- [39] Bartoš V, Pelikánová T. Praktická diabetologie. Praha; Maxdorf 2003: 479 s.
- [40] Kazda C, Hulstrunk H, Helsberg K, et al. Prandial insulin substitution with insulin lispro or insulin lispro mid mixture vs. basal therapy with insulin glargine: a randomized controlled trial in patients with type 2 diabetes beginning insulin therapy. J Diabetes Complications 2006; 20: 145–152.
- [41] Ceriello A, Del Prato S, Bue-Valleskey J, et al. Premeal insulin lispro plus bedtime NPH or twice-daily NPH in patients with type 2 diabetes: acute postprandial and chronic effects on glycemic control and cardiovascular risk factors. J Diabetes Complications 2007; 21: 20–27.
- [42] Jirkovská A, et al. Jak (si) léčit a kontrolovat diabetes. Manuál pro edukaci diabetiků. Svaz diabetiků ČR; 2003: 242.