Systémová enzymoterapie. Účinné látky, vstřebávání a mechanismus účinku
Souhrn:
Systémová enzymoterapie je definována jako léčebná metoda, která zahrnuje perorální aplikaci kombinovaných enzymových směsí ve formě acidorezistentních tablet. Hlavní účinné látky těchto přípravků tvoří proteolytické enzymy původu živočišného (trypsin a chymotrypsin) a rostlinného (bromelain a papain). Základní podmínkou systémového účinku takto aplikovaných proteáz je jejich podávání nalačno a následné vstřebávání střevní sliznicí, při kterém zůstává zachována jejich enzymatická aktivita. Léčivé přípravky určené pro systémovou enzymoterapii jsou známy svými účinky protizánětlivými, protiotokovými, analgetickými a působí též imunomodulačně. Díky svému fibrinolytickému a antiagregačnímu účinku příznivě ovlivňují reologické vlastnosti krve. Současné podávání přípravků určených pro systémovou enzymoterapii společně s antibiotiky (ale i s dalšími léčivy) zlepšuje jejich tkáňovou dostupnost (efekt vehikula). Léčivé přípravky pro systémovou enzymoterapii Wobenzym® a Phlogenzym® jsou v České republice registrovány jako volně prodejné léky. Oborem, kde má využití systémové enzymoterapie v ČR nejdelší tradici, je patrně sportovní medicína.
Key words: systemic enzyme therapy, trypsin, chymotrypsin, bromelain, papain, proteases.
Summary:
Systemic enzyme therapy is defined as a therapeutic method using oral application of combined enzyme mixtures in the form of acid resistant tablets. The key active substances in these tablets are proteolytic enzymes of both animal (trypsin and chymotrypsin) and plant (bromelain and papain) origin. The systemic effect of thus applied proteases fully depends on their administration before meals and on their absorption through the intestinal mucosa, after which their enzymatic activity is preserved. Therapeutic agents for systemic enzyme therapy are known for their anti inflammatory, anti edematous, analgesic, and immunomodulatory properties. Thanks to their fibrinolytic and anti aggregation effects, they also improve the rheologic properties of the blood. Parallel application of systemic enzyme therapy and antibiotics (but also other drugs) improves their tissue availability (effect of the vehiculum). Therapeutic agents for systemic enzyme therapy Wobenzym® and Phlogenzym® are registered in the Czech Republic as over the counter drugs. The longest tradition of systemic enzyme therapy use in the Czech Republic can probably be seen in the sport medicine.
Úvod
Protizánětlivá účinnost jednotlivých proteolytických enzymů obsažených v přípravcích určených pro systémovou enzymoterapii byla známa a terapeuticky využívána od počátku padesátých let 20. století. Historie multienzymového přípravku nazvaného Wobenzym® začíná v této době ve výzkumné laboratoři Kolumbijské univerzity. Dr. Max Wolf tam ve spolupráci s biochemičkou Helenou Benitez začal zkoušet a vyrábět několik enzymových směsí obsahujících především kombinaci živočišných a rostlinných proteáz trypsinu, chymotrypsinu a bromelainu s papainem. Přidával k nim buď rutin k zesílení protizánětlivého účinku, nebo extrakt z telecího brzlíku k zesílení účinku imunostimulačního. Tyto směsi podával Dr. Wolf svým pacientům rektálně při nádorových, kardiovaskulárních nebo zánětlivých chorobách [1].
Výroba enterosolventních forem těchto směsí vhodných k perorální aplikaci (enterosolventní granulát nebo tablety), které se od počátku nazývaly WO‑BE podle počátečních písmen ve jménech WOlf a BEnitez, byla zahájena v šedesátých letech ve firmě MUCOS Pharma GmbH se sídlem v Geretsriedu u Mnichova. U jejího vzniku stála spolupráce Dr. Maxe Wolfa s německým inženýrem ekonomie Dr. Karlem Ransbergerem, kteří také zavedli termín systémová enzymoterapie. V roce 1963 založili v tehdejší Německé spolkové republice Lékařskou společnost pro výzkum enzymů a zahájili tím výzkumnou činnost jak experimentální, tak klinickou.
Účinné látky
Základními účinnými látkami léčivých přípravků určených pro systémovou enzymoterapii jsou proteolytické enzymy živočišného nebo rostlinného původu – trypsin, chymotrypsin, bromelain a papain [2,3]. Tyto enzymy doplňuje v přípravku Wobenzym® pankreatin (enzymový koncentrát směsi amylázy, proteázy a lipázy získávaný z tkáně pankreatu) a malé m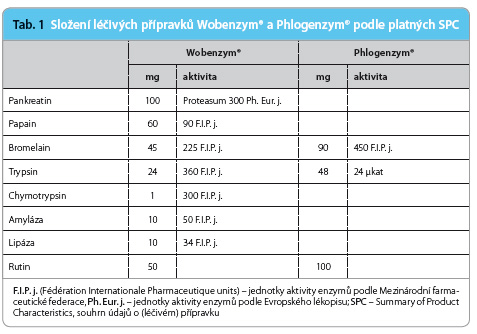 nožství amylázy a lipázy bakteriálního původu. Enzymové složky jsou v přípravcích Wobenzym® i Phlogenzym® doplněny flavonoidem rutinem, tab. 1.
nožství amylázy a lipázy bakteriálního původu. Enzymové složky jsou v přípravcích Wobenzym® i Phlogenzym® doplněny flavonoidem rutinem, tab. 1.
Proteázy (nověji proteinázy) obsažené v přípravcích systémové enzymoterapie štěpí peptidové vazby na určitých místech uvnitř peptidových řetězců (endopeptidázy) hydrolytickou reakcí, proto jsou řazeny do skupiny hydroláz. Jednotlivé enzymy mají specifickou afinitu k vazbám určitých aminokyselin v peptidové sekvenci.
Živočišný trypsin (molekulová hmotnost 23–24 kDa) a chymotrypsin (molekulová hmotnost 23–24 kDa) patří ke skupině serinových proteáz. Optimum jejich proteolytické účinnosti nastává při mírně alkalickém pH – okolo 8–9, se kterým se tyto proteázy setkávají např. v tenkém střevě. Obě tyto proteázy jsou vyráběny z příslušných proenzymů izolovaných z pankreatů jatečných vepřů a jsou obsaženy také v pankreatinu, který je získáván ze stejného zdroje.
Bromelain a papain se řadí ke skupině cysteinových proteáz. Bromelain (molekulová hmotnost 23–27 kDa), izolovaný ze stonku ananasu, dosahuje optimální hydrolytické účinnosti při pH v rozmezí 2–7. Zdrojem papainu (molekulová hmotnost 21–23 kDa) je šťáva z nezralých plodů tropického stromu Carica papaya. Optimálního účinku této látky je docíleno při pH 6–7. Optimum účinnosti rostlinných proteáz v kyselém prostředí umožňuje jejich působení ve tkáni postižené akutním zánětem, kde se hodnota pH pohybuje v rozmezí 6–7.
Myšlenka vyššího výsledného účinku při kombinaci proteáz s rozdílnou substrátovou specifitou a rozdílným pH optimální účinnosti vedla Dr. Maxe Wolfa od počátku vývoje enzymových směsí k úvahám o možnosti jejich využití k léčebným účelům. Tento předpoklad byl později potvrzen především experimentálně i klinicky průkazem vyšší protizánětlivé účinnosti vzájemné kombinace proteáz ve srovnání s účinkem jednotlivých proteáz [4–6].
Terapeutická účinnost enzymových složek závisí na jejich enzymatické aktivitě, nikoli na pouhé gramáži. Je podmíněna kvalitou výchozích surovin a precizním technologickým postupem výroby, který vylučuje možné poškození aktivity enzymů nevhodnými fyzikálně‑chemickými faktory (teplota, vlhkost, přítomnost inhibitorů). Při léčebné perorální aplikaci chrání aktivitu enzymů vhodná léková forma – tableta potahovaná acidorezistentním obalem, který odolává kyselému prostředí žaludku a rozpouští se až v mírně alkalickém prostředí tenkého střeva.
Vstřebávání
Pomineme‑li možnost působení perorálně podaných proteolytických enzymů přímo na receptory imunitního systému bezprostředně v tenkém střevě, pak je pro jejich systémový účinek základní podmínkou absorpce v enzymaticky aktivní formě a distribuce tělesnými tekutinami.
Ucelený přehled současného stavu poznání absorpce serinových a cysteinových proteáz v gastrointestinálním traktu podal v roce 2012 Lorkowski [7].
Navzdory stále probíhající diskusi a pochybnostem jsou k dispozici velmi solidní důkazy o absorpci řady makromolekul v nenarušeném stavu střevní sliznicí a o jejich následném transportu do krevního řečiště [8]. To se týká jak rostlinných, tak živočišných proteinů, které zdraví lidé zkonzumují jako součást stravy. V malých množstvích je absorbován například humánní β‑laktoglobulin, hovězí sérový albumin, ovalbumin nebo křenová peroxidáza [9,10].
Pro stanovení přítomnosti absorbovaných enzymů v plazmě jsou považovány za nejprůkaznější metody imunologické (s užitím monoklonálních protilátek k detekci vstřebaného enzymu) kombinované s metodami enzymatickými (pro průkaz aktivity vstřebaných enzymů).
Průkaz vstřebávání u zdravých dobrovolníků
Ve dvou klinických farmakokinetických studiích byla kombinací těchto metod ověřena absorpce jak samotného bromelainu, tak kombinovaného přípravku Phlogenzym®.
Castell [11] prokázal intestinální absorpci nedegradovaného bromelainu po perorální aplikaci acidorezistentních tablet. K detekci vstřebaného bromelainu byla použita kombinace vysoce specifických imunologických metod, která v séru zachytila nanogramová množství (2–10 ng/ml). Byla potvrzena shodná molekulová hmotnost podaného a detekovaného bromelainu, a navíc byla ověřena jeho enzymatická aktivita se specifickým syntetickým substrátem, který je schopen proniknout k aktivnímu centru enzymu, i když je vázán s plazmatickými antiproteázami. Dále autor prokázal, že hlavní antiproteázou, která váže bromelain, je α2‑makroglobulin.
Roots a Donath [12,13] ověřili vstřebávání přípravku Phlogenzym®. Při čtyřdenním podávání v dávce 4 × 4 tablety nebo 4 × 8 tablet denně bylo prokázáno vstřebávání bromelainu a trypsinu v množství závislém na podané dávce a byla také potvrzena jejich specifická hydrolytická aktivita po vstřebání. Maximálních koncentrací bylo dosaženo druhý až třetí den podávání. Biologický poločas eliminace enzymů po jejich absorpci je relativně dlouhý (6 hodin pro bromelain a 12–20 hodin pro trypsin).
Na podkladě těchto studií lze konstatovat, že bromelain a trypsin jsou absorbovány ze střeva v závislosti na podané dávce jako aktivní enzymové molekuly.
Mechanismy přestupu makromolekul střevní stěnou
Přestup makromolekul přes střevní stěnu je zprostředkován několika mechanismy. V horní části tenkého střeva je za hlavní mechanismus považována persorpce. Souvisí s nepřetržitou deskvamací zanikajících enterocytů, která podmiňuje krátkodobé zvýšení propustnosti střevní bariéry. V úseku![Obr. 1 Schéma mechanismů střevní absorpce aminokyselin, peptidů a proteinů; podle [7] – Lorkowski, 2012.](https://www.remedia.cz/photo-a-30216---.jpg) ilea navíc přistupuje absorpce M‑buňkami (microfold cells) akumulovanými ve střevní sliznici nad Payerskými plaky. Dalším mechanismem je receptorem zprostředkovaná endocytóza spojená s internalizací a recyklací receptoru. Kromě transcelulárních cest se jako další možnost jeví i přestup paracelulární přes tzv. těsné spoje (tight junctions), obr. 1.
ilea navíc přistupuje absorpce M‑buňkami (microfold cells) akumulovanými ve střevní sliznici nad Payerskými plaky. Dalším mechanismem je receptorem zprostředkovaná endocytóza spojená s internalizací a recyklací receptoru. Kromě transcelulárních cest se jako další možnost jeví i přestup paracelulární přes tzv. těsné spoje (tight junctions), obr. 1.
Paracelulární přestup v experimentu
Jako model střevní stěny byla použita jednovrstevná kultura lidských buněk karcinomu tlustého střeva (Caco‑2 buňky) zachovávající morfologickou polaritu buněk, které vytvářejí mikroklky a tight junctions. Přidání proteáz (trypsinu, chymotrypsinu, bromelainu, papainu) do apikálního kompartmentu zvýšilo permeabilitu buněčné kultury, což se projevilo jako snížení transepiteliálního elektrického odporu. Zároveň se zvýšila propustnost, která byla detekována pomocí fluoresceinu, jemuž velikost molekuly jinak nedovoluje projít přes vrstvu Caco‑2 buněk. Měření proteolytické aktivity a hmotnostní identifikace prokázaly přestup zhruba 10 % biologicky aktivních nedegradovaných enzymů aplikovaných na apikální stranu kultury. Lze tedy uvažovat o rozvolnění těsných spojů vlivem proteáz, které si tak samy umožňují paracelulární průchod střevní stěnou. Změny parametrů prostupnosti kultury Caco‑2 buněk byly reverzibilní a aplikace proteáz do média neporušila vitalitu buněk [14]. (Výzkumy z poslední doby ukazují možný podíl receptoru PAR‑2 aktivovaného trypsinem na regulaci paracelulární prostupnosti střevní stěny – viz dále [35].)
Mechanismy působení perorálně podávaných proteáz
Empiricky zřejmé a nepochybné léčebné účinky perorálně podávaných proteáz byly zpočátku vysvětlovány pouze proteolytickým účinkem vstřebaných enzymů. Tato teorie byla s přibývajícími poznatky postupně korigována.
Přímé proteolytické působení
Proteázy, které se ve střevě z léčivých přípravků uvolní a přestoupí do krve a lymfy, setrvávají ve volném stavu jen krátkou dobu. Velmi rychle se vážou na antiproteázy, zejména na α2‑makroglobulin a α1‑antitrypsin. Za fyziologických podmínek je v plazmě ustavena rovnováha mezi proteázami volnými a vázanými na antiproteázy.
Proteázy si v komplexu s α2‑makroglobulinem zachovávají část své proteolytické aktivity (pro nízkomolekulární substráty) a mohou spolu s přechodně volnými proteázami potencovat významný regulační mechanismus organismu – proteolytickou aktivitu krve; ta v průběhu dne kolísá (nejnižší hodnoty lze prokázat ráno). K jejímu poklesu ale dochází také v důsledku stárnutí a u řady chronických onemocnění. V průběhu léčby proteolytickými enzymy se hodnoty proteolytické aktivity krve signifikantně zvyšují [15].
Jedním ze základních projevů přímého působení proteáz je tzv. limitovaná proteolýza. Proteázy se tak zúčastní aktivace, regulace a degradace celé řady faktorů spojených se zánětlivou odpovědí [16].
Působení komplexů proteáza‑antiproteáza
V komplexu proteáza‑antiproteáza dochází ke konformační změně molekuly α2‑makroglobulinu, která významně mění její vlastnosti. Na molekule α2‑makroglobulinu se přitom obnaží ligandy pro receptory na buňkách fagocytárního systému. Vzniká tak tzv. rychlá forma α2‑makroglobulinu. Tento komplex je rychle eliminován fagocytujícími buňkami jater a sleziny [17]. Zatímco ve volném stavu setrvávají antiproteázy v oběhu až osm dnů, ve formě „rychlého“ komplexu proteáza‑antiproteáza „přežívají“ jen 10 až 30 minut, obr. 2.
Cestou komplexů proteáza‑antiproteáza uskutečňují vstřebané proteázy řadu dalších aktivit. Vazbou na tento komplex a jeho následným rychlým odstraněním fagocytujícími buňkami může být z oběhu eliminována řada patologicky zmnožených působků (viz dále).
Za pozitivní účinek vstřebaných enzymů lze pokládat i ovlivnění samotných antiproteáz, které v nadbytku působí imunosupresivně a dysregulačně – omezují např. aktivity fagocytů a výkonných buněk NK (natural killer cells, přirozených zabíječů) a cytotoxických leukocytů.
Ovlivnění lokálně a systémově působících cytokinů
V průběhu lokální nebo systémové zánětlivé odpovědi se uplatňuje řada cytokinů (tumor nekrotizující faktor α – TNFα, transformační růstový faktor β, transforming growth factor β – TGFβ, interferon γ – IFNγ, interleukin 1 – IL‑1, interleukin 6 – IL‑6 a další). Nedostatečná produkce některých cytokinů může vést např. ke snížení odolnosti vůči širokému spektru patogenů nebo k poruchám hojení. Naopak jejich dlouhodobě zvýšené koncentrace přispívají k rozvoji chronických zánětlivých reakcí a jejich negativních projevů (např. kachektizace pacientů při zvýšených hodnotách TNFα). Výsledky experimentů svědčí pro to, že proteázy obsažené v přípravcích určených pro systémovou enzymoterapii mohou produkci určitých cytokinů stimulovat, ale mohou také přispívat ke snížení koncentrací cytokinů patologicky zmnožených.
Desser [18] prokázala zvýšení produkce TNFα, IL‑1β a IL‑6 v mononukleárech periferní krve po stimulaci bromelainem, papainem nebo trypsinem. Rose [19] prezentoval schopnost bromelainu a papainu indukovat produkci IL‑6 v modifikované smíšené kultuře lymfocytů (MMLC), která představuje testovací systém založený na vzájemné interakci buněk vrozené a adaptivní imunity. Stimulace uvolňování IL‑6 může být přičítána mimo jiné aktivaci receptorů aktivovatelných proteázami (viz dále).
Eliminaci patologicky zvýšených koncentrací cytokinů z ložiska zánětu či krevního oběhu může urychlovat již zmiňovaná „rychlá“ forma α2‑makroglobulinu. Cytokiny se v krevní plazmě vážou (podobně jako proteázy) na antiproteázy (zejména na α2‑makroglobulin). Vazba cytokinu na „pomalou“ antiproteázu však není pevná a cytokin může po uvolnění z vazby znovu projevit svoji aktivitu. Cytokiny totiž nejsou na rozdíl od proteáz schopny vyvolat na molekule α2‑makroglobulinu konformační změnu, která ji činí předmětem rychlé fagocytózy. „Rychlá“ forma α2‑makroglobulinu naproti tomu cytokiny pevně váže a tak je inaktivuje [20,21], obr. 2.
Například nadprodukce autokrinního cytokinu TGFβ se podílí na chronizaci zánětu, fibróze a na rozvoji celé řady imunopatologických proces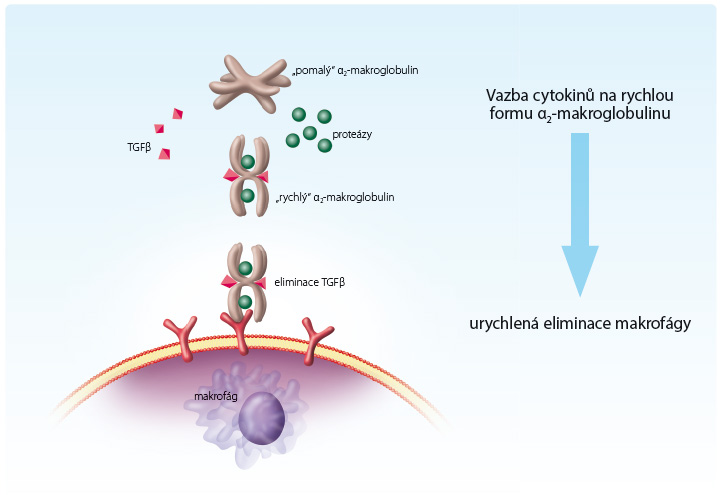 ů. Desser [22] prokázala, že podávání přípravků systémové enzymoterapie snížilo významně zvýšené koncentrace TGFβ1 u pacientů s revmatoidní artritidou, osteomyelofibrózou a herpes zoster.
ů. Desser [22] prokázala, že podávání přípravků systémové enzymoterapie snížilo významně zvýšené koncentrace TGFβ1 u pacientů s revmatoidní artritidou, osteomyelofibrózou a herpes zoster.
Další experiment [23] (Lauer) ukázal, že požití vysokých dávek proteáz (bromelain, trypsin) spouští u zdravých dobrovolníků tvorbu „rychlé“ formy α2‑makroglobulinu. Odebraná plazma měla schopnost vázat značený TGFβ ex vivo a také rušila stimulační vliv TGFβ na fibroblasty v tkáňové kultuře.
Ovlivnění adhezních molekul
Adhezní molekuly – proměnlivé struktury na povrchu každé buňky – hrají důležitou roli při mezibuněčné komunikaci, zejména v případě imunitních buněk. Míra jejich exprese je dána stavem aktivace buňky a významně ovlivňuje její vlastnosti. Zvýšená exprese adhezních molekul nebo její dlouhodobé přetrvávání ovšem může vést k přemrštěné reakci a k oddálení regenerační fáze zánětu s přechodem do chronicity. Klíčové úlohy plní i při vzniku a šíření metastáz. Určité adhezní molekuly představují receptory pro viry (např. ICAM‑1 pro rinoviry, CD4 pro HIV) nebo pro jiné patogeny, které pak s jejich pomocí vstupují do buňky. Pokusy in vitro a in vivo ukazují, že enzymy obsažené v přípravcích systémové enzymoterapie selektivně snižují denzitu exprese některých adhezních molekul na endotelu cév, v poškozených tkáních i na buněčných membránách zánětlivých a nádorových buněk. Snížením denzity exprese těchto adhezních molekul dochází ke zvýšení aktivačního prahu elementů, které se na zánětlivé reakci podílejí, což může vysvětlovat protizánětlivý potenciál systémové enzymoterapie [24–27].
Targoni předložil poznatky, které ukazují další cestu k chápání mechanismu účinku systémové enzymoterapie. Při podávání trypsinu prokázal selektivní snížení exprese tří adhezních molekul (CD4, CD44 a B7.1) z 21 testovaných na autoimunitních T‑lymfocytech, čímž byl zvýšen práh jejich aktivace, která je podkladem vzniku experimentální autoimunitní encefalitidy [28]. Obdobný selektivní účinek trypsinu zmiňuje i Lehmann [29].
Fitzhugh prokázal in vitro i na několika modelech in vivo omezení migrace leukocytů do místa zánětu potlačením exprese určitých adhezních molekul účinkem bromelainu [30].
Působení systémové enzymoterapie cestou receptorů aktivovatelných proteázami
Receptory aktivovatelné proteázami (protease‑activated-receptor, PAR) jsou přítomny na všech buňkách těla. Jsou významné pro regulaci řady procesů a podílejí i na patofyziologii zánětu. Aktivací PAR může systémová enzymoterapie přispívat ke změnám hydrodynamiky, k regulaci onkotického tlaku, a tím např. k redukci zánětlivého edému a následně ke zlepšení mikrocirkulace a k odstranění nahromaděných mediátorů zánětu a buněčného detritu ze zánětlivého ložiska [31,32].
Například receptory PAR‑2 jsou aktivovány trypsinem [33,34]. Jejich aktivace vede k vazodilataci, a tím ke zlepšené mikrocirkulaci v oblasti zánětu či traumatu. Receptor PAR‑2 je přítomen také na mnoha buňkách střevní sliznice a plní zde řadu funkcí včetně regulace permeability epitelu sliznice; PAR‑2 se tak podílejí na řízení reakce imunitního systému na procesy probíhající uvnitř střeva. Po aktivaci receptoru PAR‑2 na epitelu střevní sliznice dochází ke změnám v cytoskeletu epiteliálních buněk. Cytoskelet se kontrahuje, protože jsou fosforylovány lehké řetězce myosinu, což má za následek uvolnění mezibuněčných spojů. Proteázy tak mohou samy ovlivnit svou vlastní absorpci, ale i vstřebávání jiných aktivních substancí (např. antibiotik – efekt vehikula) [35].
Působení na imunitní komplexy
Zvýšené koncentrace imunitních komplexů v cirkulaci i v tkáňových depozitech podmiňují či provázejí mnoho chorob. Jejich vlivem se zvyšuje tvorba a uvolňování vazoaktivních mediátorů, cytokinů a adhezních molekul, dochází k agregaci destiček a k tvorbě fibrinu, je tlumena aktivita elementů makrofágového fagocytujícího systému. Nežádoucí následky má i aktivace komplementové kaskády. Pokusy in vitro a na experimentálních modelech i četné klinické studie u imunokomplexových chorob (glomerulonefritid, vaskulitid, revmatoidních procesů) ukázaly, že proteázy dokážou snižovat hodnoty imunitních komplexů, štěpit je a urychlovat clearance jejich fragmentů [36,37].
Objasnění mechanismů působení systémové enzymoterapie rozhodně není ukončeným procesem. Aktuální vývoj nejrůznějších výzkumných metod přináší stále nové poznatky, které přispívají k vysvětlení dlouhodobě známých a empiricky ověřených pozitivních účinků této léčby.
Rozsah tohoto článku neumožňuje plně obsáhnout problematiku systémové enzymoterapie. Jejím farmakologickým účinkům a klinickému využití bude proto věnován druhý díl článku.
Poděkování
Děkuji MUDr. Martě Honzíkové za zpracování podkladů pro přípravu tohoto článku.
Seznam použité literatury
- [1] Ransberger K. Max Wolf – život ve znamení enzymoterapie. Praha: Dům medicíny, 1995.
- [2] Libický A, Nouza K. Systémová enzymoterapie. Čes a Slov Farm 1996; 45: 51–57.
- [3] Jezdínský J. Systémová enzymoterapie. In: Lincová D, Farghali H, eds. Základní a aplikovaná farmakologie, 2. vydání, Praha: Galén, 2007; 606–611.
- [4] Ito C, Yamanushi K, Shibutani Y, et al. Antiinflammatory action of proteases bromelain, trypsin and their mixed preparation. Folia Pharmacol Japan 1979; 75: 227–237.
- [5] Wood GR, Ziska T, Morgenstern E, et al. Sequential effect of an oral enzyme combination with rutoside in different in vitro and in vivo models of inflammation. Int J Immunother 1997; XIII: 139–146.
- [6] Netti C, Bandi GL, Pecile A. Anti inflammatory action of proteolytic enzymes of animal, vegetable or bacterial origin administered orally, compared with that of known antiphlogistic compounds. Farmaco Editione Practica 1972; 27: 453–456.
- [7] Lorkowski G. Gastrointestinal absorption and biological activities of serine and cysteine proteases of animal and plant origin: review on absorption of serine and cysteine proteases. Int J Physiol Pathophysiol Pharmacol 2012; 4: 10–27.
- [8] Nouza K, Wald M. Systémová enzymoterapie: K problematice vstřebávání enzymových makromolekul. Čas Lék čes 1995;134: 615–619.
- [9] Husby S, Jensenius SC, Svehag SE. Passage of undegraded dietary antigen into the blood of healthy adults. Further characterisation of the kinetics of uptake and the size distribution of the antigen. Scand J Immunol 1986; 24: 447–455.
- [10] Paganelli R, Levinsky RJ. Solid phase radioimmunoassay for detection of circulating food protein antigens in human serum. J Immunol Methods 1980; 37: 333–341.
- [11] Castell JV, Friedrich G, Kuhn CS, et al. Intestinal absorption of undegraded proteins in men: presence of bromelain in plasma after oral intake. Am J Physiol 1997; 273 (1 Pt 1): G139–346.
- [12] Roots I. Bioavailability study on trypsin, bromelain and rutin metabolites following oral dose of Phlogenzym in healthy volunteers. Study No. MU 695 427 (1997): 1–36.
- [13] Donath F, Roots I, Mai I, et al. Dose related bioavailability of bromelain and trypsin after repeated oral administration. Eur J Clin Pharmacol 1997; 52 (Suppl): 146, abstrakt 453.
- [14] Kolac C, Streichhan P, Lehr CM. Oral bioavailability of proteolytic enzymes. Eur J Pharm Biopharm 1996; 42: 222–232.
- [15] Klaschka F. Neue Perspektiven in der Tumortherapie. Gräfeling: Forum Medizin, 1996.
- [16] Prasad C. Limited proteolysis and physiological regulation: an example from thyrotropin releasing hormone metabolism. Thyroid 1998; 8: 969–975.
- [17] Howard GC, Yamaguchi Y, Misra UK, et al. Selective mutations in cloned and expressed alpha macroglobulin receptor binding fragment alter binding to either the alpha2 macroglobulin signaling receptor or the low density lipoprotein receptor related protein/alpha2 macroglobulin receptor. J Biol Chem 1996; 271: 14105–14111.
- [18] Desser L, Rehberger A, Paukovits W. Proteolytic enzymes and amylase induce cytokine production in human peripheral blood mononuclear cells in vitro. Cancer Biother 1994 Fall; 9: 253–263.
- [19] Rose B, Herder C, Löffler H, et al. Dose dependent induction of IL 6 by plant derived proteases in vitro. Clin Exp Immunol 2006; 143: 85–92.
- [20] James K. Interactions between cytokines and alfa 2 macroglobulin. Immunol Today 1990; 11: 163–166.
- [21] LaMarre J, Wollenberg GK, Gonias SL, et al. Cytokine binding and clearance properties of proteinase activated alpha 2 macroglobulins. Lab Invest 1991; 65: 3–14.
- [22] Desser L, Holomanova D, Zavadova E, et al. Oral therapy with proteolytic enzymes decreases excessive TGF beta levels in human blood. Cancer Chemother Pharmacol 2001; 47; Suppl: S10–15.
- [23] Lauer D, Müller R, Cott C, et al. Modulation of growth factor binding properties of alpha2 macroglobulin by enzyme therapy. Cancer Chemother Pharmacol 2001; 47 Suppl: S4–9.
- [24] Hale LP, Haynes BF. Bromelain treatment of human T cells removes CD44, CD45RA, E2/MIC2, CD6, CD7, CD8, and Leu 8/LAM1 surface molecules and markedly enhances CD2 mediated T cell activation. J Immunol 1992; 149: 3809–3816.
- [25] Hale LP, Greer PK, Sempowski GD. Bromelain treatment alters leukocyte expression of cell surface molecules involved in cellular adhesion and activation. Clin Immunol 2002; 104: 183–190.
- [26] Munzig E, Eckert K, Harrach T, et al. Bromelain protease F9 reduces the CD44 mediated adhesion of human peripheral blood lymphocytes to human umbilical vein endothelial cells. FEBS Lett 1994; 351: 215–218.
- [27] Kleef R, Delohery TM, Bovbjerg DH. Selective modulation of cell adhesion molecules on lymphocytes by bromelin protease 5. Pathobiology 1996; 64: 339–346.
- [28] Targoni OS, Tary Lehmann M, Lehmann PV (1999). Prevention of Murine EAE by Oral Hydrolytic Enzyme Treatment. J Autoimmun 1999; 12: 191–198.
- [29] Lehmann PV. Immunomodulation by proteolytic enzymes. Nephrol Dial Transplant 1996; 11: 952–955.
- [30] Fitzhugh DJ, Shan S, Dewhirst MW, et al. Bromelain treatment decreases neutrophil migration to sites of inflammation. Clin Immunol 2008; 128: 66–74.
- [31] Déry O, Corvera CU, Steinhoff M, et al. Proteinase activated receptors: novel mechanisms of signaling by serine proteases. Am J Physiol 1998; 274 (6 Pt 1): C1429–1452.
- [32] Olejár T, Nouza K. Thrombin and trypsin receptors: The same mechanism of signalling on cellular surfaces. Bratisl Lek Listy 1999; 100: 75–79.
- [33] Fields RC, Schoenecker JG, Hart JP, et al. Protease activated receptor 2 signaling triggers dendritic cell development. Am J Pathol 2003; 162: 1817–1822.
- [34] Kong W, McConalogue K, Khitin LM, et al. Luminal trypsin may regulate enterocytes through proteinase activated receptor 2. Proc Natl Acad Sci U S A. 1997; 94: 8884–8889.
- [35] Bueno L, Fioramonti J. Protease activated receptor 2 and gut permeability: a review. Neurogastroenterol Motil 2008; 20: 580–587.
- [36] Emancipator SN, Chintalacharuvu SR, Urankan Nagy A, et al. Oral enzymes in different models of glomerulonephritis. Int J Immunother 1997; XII: 97–103.
- [37] Kunze R, Ransberger K, Stauder G, et al. Proteolytic enzymes modulate the C1q binding capacity of fixed immunocomplexes in vitro. Eur J Inf Immunol Dis 1996; 1: 17–29.