Topické imunomodulátory v léčbě atopické dermatitidy u dětí
Atopická dermatitida (AD) je jedním z nejčastějších kožních onemocnění u dětí – prevalence v prvních deseti letech života je 10–20 % [1]. Jedná se o chronické zánětlivé silně svědivé onemocnění s relabujícím a remitujícím průběhem, s multifaktoriální etiologií, s různorodým klinickým obrazem a s různým stupněm tíže. Vyžaduje proto komplexní léčebný přístup ovlivňující etiologické faktory i provokační momenty. Léčebná strategie je limitována léčebnými možnostmi. Často balancujeme mezi bezpečností léčby a její účinností; bezpečnostní profil léků je u dětí obzvláště důležitý. V posledních desetiletích byly základem léčby lokální kortikosteroidy (LK). Zavedení topických imunomodulátorů (TIM) v léčbě AD jako alternativy steroidní léčby se stalo velkou nadějí pro pacienty s AD. Článek se zaměřuje na léčbu AD topickými imunomodulátory – moderními léky s vysokým protizánětlivým účinkem s přihlédnutím k jejich bezpečnosti a účinnosti. Shrnuje současné zkušenosti praktického využití TIM v léčbě AD u dětí.
Úvod
AD je onemocnění se stoupající incidencí, která v posledních desetiletích dramaticky narůstá zejména v rozvinutých zemích. Tento fakt svědčí o neblahém vlivu „chemizace“ prostředí a změn životního stylu (zajímavé je zjištění, že při migraci obyvatel z rozvojových zemí do oblastí s vyšší incidencí AD dochází i u nich k častějšímu výskytu AD).
Klinická manifestace AD je výsledkem působení mnoha etiologických faktorů: polygenního typu dědičnosti, poruch imunologických, metabolických, neuroendokrinních, infekčních vlivů a působení zevních faktorů. Defekt epidermální bariérové funkce a kožní zánět jsou základními charakteristickými známkami AD. Za příčinu defektu bariérové funkce u AD se považuje porucha genu pro filagrin, geneticky podmíněná zvýšená aktivita endogenních proteáz ve stratum corneum, porucha inhibitorů proteáz, snížené množství ceramidů ve stratum corneum a porušená funkce antigen prezentujících dendritických buněk v epidermis [2]. Výsledkem je zvýšená transepidermální ztráta vody a porucha integrity kůže, možnost snadnějšího průniku alergenů ze zevního prostředí a bakteriální kolonizace kůže. Bariérovou funkci mohou poškodit i exogenní proteázy uvolňované bakteriemi Staphylococcus aureus a roztoči nebo působení mýdel a detergentů, které zvyšují lokální pH a aktivují endogenní proteázy ve stratum corneum [3]. V důsledku nesprávné regulace imunitních mechanismů pak snadněji dochází k nerovnováze a přesmyku z Th1 do Th2 imunitní odpovědi (zvýšená aktivita Th2 lymfocytů se dává do souvislosti s atopií). Porušená kožní bariéra tak může být iniciátorem vzniku AD [4]. Zánět kůže u AD je způsoben uvolněním cytokinů a chemokinů. Mechanické dráždění atopické kůže (např. i pouhé škrábání) vede k lokální produkci prozánětlivých cytokinů, jako je interleukin 1 (IL-1) a tumor nekrotizující faktor a (TNF-α). Tyto cytokiny se vážou na vaskulární endotelové receptory a vedou k uvolnění zánětlivých mediátorů do kůže. U akutní AD vede zvýšená aktivita Th2 k uvolnění cytokinů IL-4 a IL-13, které podporují syntézu imunoglobulinu E (IgE). Díky zvýšené hladině IL-17 v kožních lézích AD dochází k uvolňování prozánětlivých mediátorů také z makrofágů a fibroblastů. Chronické projevy AD provází zvýšená exprese IL-12 a interferonu g (Th1 cytokinů) a zvýšená infiltrace kůže eozinofily [5]. Výzkumy na poli imunologie přinášejí další znalosti o AD a otevírají nové léčebné možnosti se specifickým účinkem na patologické procesy odehrávající se v atopické kůži.
Léčba atopické dermatitidy
Léčba zohledňuje veškeré faktory, které se podílejí na vzniku a exacerbacích AD.
Přehled projevů atopické dermatitidy a léčebných možností přináší tab. 1 [7].
Lokální léčba se zaměřuje na obnovu a zlepšení bariérové funkce epidermis a na léčbu protizánětlivou. Zapomínat nelze ani na léčbu případných bakteriálních, virových nebo mykotických superinfekcí. Ke zlepšení bariérové funkce kůže využíváme emoliencia; jedná se o přípravky ke zvláčnění a promaštění 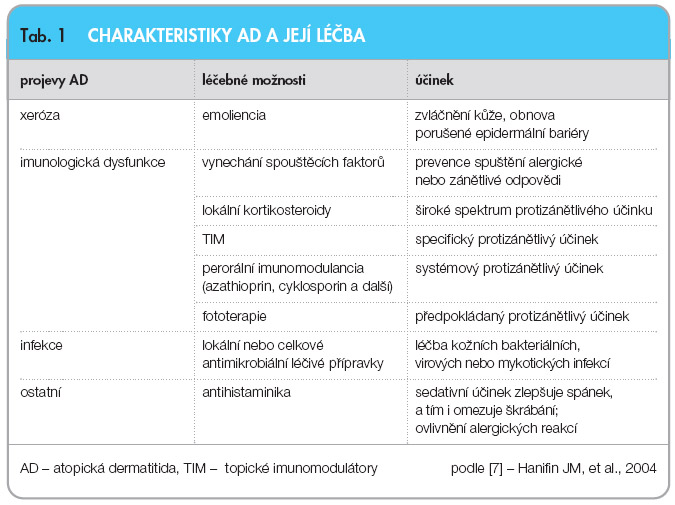 kůže, které zabraňují nadměrným transepidermálním ztrátám vody, pomáhají vázat vodu v epidermis, popř. obsahují látky podobné epidermální matrix (ceramidy, nenasycené mastné kyseliny, cholesterol) [6]. Pravidelné používání emoliencií je základem léčby AD u pacientů s xerózou kůže a s chronickými ložisky ekzému, u ostatních nemocných jsou emoliencia léčbou doplňkovou. Výběr emoliencií je individuální – od lotií přes krémy až po masti, využít se dají i olejové koupele; emoliencia se používají podle stavu kůže několikrát denně. Při pravidelném používání jsou cenným pomocníkem ke zmírnění svědění kůže a působí preventivně proti exacerbacím AD. Obor, který se touto problematikou v dermatologii zabývá, se nazývá korneoterapie.
kůže, které zabraňují nadměrným transepidermálním ztrátám vody, pomáhají vázat vodu v epidermis, popř. obsahují látky podobné epidermální matrix (ceramidy, nenasycené mastné kyseliny, cholesterol) [6]. Pravidelné používání emoliencií je základem léčby AD u pacientů s xerózou kůže a s chronickými ložisky ekzému, u ostatních nemocných jsou emoliencia léčbou doplňkovou. Výběr emoliencií je individuální – od lotií přes krémy až po masti, využít se dají i olejové koupele; emoliencia se používají podle stavu kůže několikrát denně. Při pravidelném používání jsou cenným pomocníkem ke zmírnění svědění kůže a působí preventivně proti exacerbacím AD. Obor, který se touto problematikou v dermatologii zabývá, se nazývá korneoterapie.
Problematika lokální protizánětlivé léčby se zdála být vyřešena počátkem padesátých let, kdy byly v léčbě AD poprvé použity lokální kortikosteroidy. Viditelně snižují zánět kůže díky kombinaci protizánětlivého, antiproliferativního, imunosupresivního a vazokonstrikčního efektu [8]. Potlačují uvolňování zánětlivých cytokinů a působí na řadu buněk podílejících se na imunitních reakcích – na T lymfocyty, monocyty, makrofágy, dendritické buňky a jejich prekurzory. Prvotní nadšení bylo vystřídáno skepsí vedoucí až ke "kortikofobii" (odmítání LK); takovýto postoj vyvolaly jednak nežádoucí vedlejší účinky LK, jednak i to, že po přechodném zlepšení a přerušení aplikace dojde často k návratu k původnímu stavu, dokonce někdy k výraznějšímu vzplanutí onemocnění (rebound fenomén). Systémové nežádoucí vedlejší účinky mohou nastat po aplikaci na více než 30 % povrchu těla a při velké spotřebě silných LK a jsou obdobné jako při celkové léčbě kortikosteroidy (suprese nadledvin, neprospívání, malý vzrůst, Cushingův syndrom, katarakta, glaukom, benigní cefalická hypertenze). Z lokálních nežádoucích vedlejších účinků LK je v popředí atrofie kůže, periorální dermatitida, granuloma gluteale infantum, hypopigmentace, hypertrichóza, teleangiektazie, purpura a praskání kapilár. Od doby prvního použití LK byla vyvinuta celá řada nových preparátů s vysokou protizánětlivou aktivitou a se slabšími antiproliferativními účinky, a tedy i s nižšími atrofogenními a systémovými účinky [9]. Přes veškeré snahy se ideální LK dosud nepodařilo nalézt. V léčbě AD jsou LK lékem první linie při akutním vzplanutí onemocnění; léčba musí být krátkodobá, popřípadě intervalová, s dostatečně dlouhou pauzou bez podávání LK, aby byly minimalizovány případné vedlejší nežádoucí účinky.
Topická imunomodulancia
Objevem srovnatelným s objevem LK bylo v 80. letech minulého století nalezení topických imunomodulancií. Jedná se o nesteroidní makrolidová antibiotika s vysokým protizánětlivým účinkem na podkladě imunosupresivního působení – pimekrolimus a takrolimus. Historie nápadu se odvíjí od zkušenosti s transplantovanými pacienty, u nichž bylo nutno potlačit působení cytotoxických T lymfocytů, které ničily štěp. Touto látkou se stal cyklosporin A (CyA), původně jedno z makrolidových antibiotik; CyA téměř selektivně působil na lymfocyty blokací kalcineurinu, proteinu nezbytného k intracelulárnímu přenosu vápníku. Při celkovém podávání transplantovaným pacientům bylo zjištěno, že velmi účinně léčí i kožní onemocnění – psoriázu a atopický ekzém, kožní nemoci, v jejichž patogenezi hrají lymfocyty rozhodující úlohu. Protože celkové podávání CyA je provázeno řadou nežádoucích účinků a při lokálním použití nepronikal do kůže, a tudíž nebyl účinný, hledala se látka stejných vlastností s lokální účinností [10]. Dlouhá cesta výzkumu byla završena objevením takrolimu a pimekrolimu. Takrolimus (FK 506) byl izolován v 80. letech 20. století z plísně Streptomyces tsukubaensis [11], nejdříve byl použit k celkovému podávání po transplantacích (od roku 1993 schválen v Japonsku k podávání po transplantacích jater), poté byl inkorporován do masťového základu a na přelomu tisíciletí byl schválen pro léčbu AD. Téměř současně byl objeven pimekrolimus – derivát askomycinu – přírodní substance produkované plísní Streptomyces hygroscopicus var. Ascomyceticus. Pimekrolimus byl připraven přímo pro lokální léčbu zánětlivých kožních chorob.
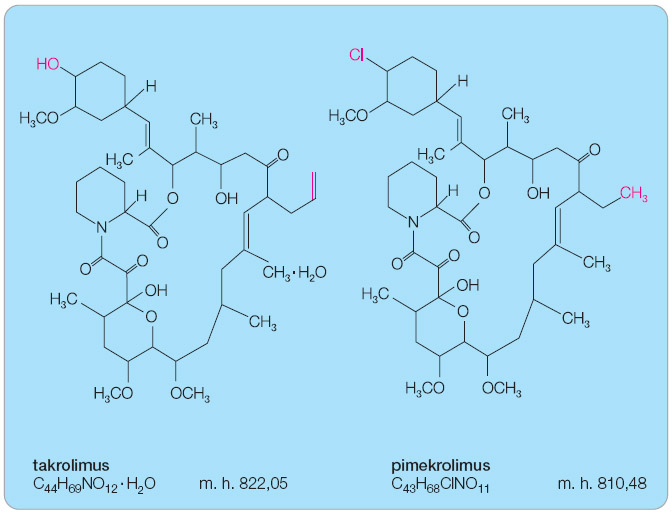 Obě látky mají velmi podobnou chemickou strukturu, jsou to makrolidové laktony (obr. 1), a stejný mechanismus účinku. U obou léků je zaznamenána statisticky podobná účinnost, jejich podávání provázejí obdobné nežádoucí účinky a stejné jsou i kontraindikace léčby. V ČR je k dispozici takrolimus v lékové formě 0,03% masti pro děti od 2 let a ve formě 0,1% masti pro pacienty od 16 let. Pimekrolimus je určen pro pacienty od 2 let v lékové formě krému (1%). Snášenlivost přípravků a účinnost je individuální, tak jako u všech dermatologických extern.
Obě látky mají velmi podobnou chemickou strukturu, jsou to makrolidové laktony (obr. 1), a stejný mechanismus účinku. U obou léků je zaznamenána statisticky podobná účinnost, jejich podávání provázejí obdobné nežádoucí účinky a stejné jsou i kontraindikace léčby. V ČR je k dispozici takrolimus v lékové formě 0,03% masti pro děti od 2 let a ve formě 0,1% masti pro pacienty od 16 let. Pimekrolimus je určen pro pacienty od 2 let v lékové formě krému (1%). Snášenlivost přípravků a účinnost je individuální, tak jako u všech dermatologických extern.
Mechanismus účinku
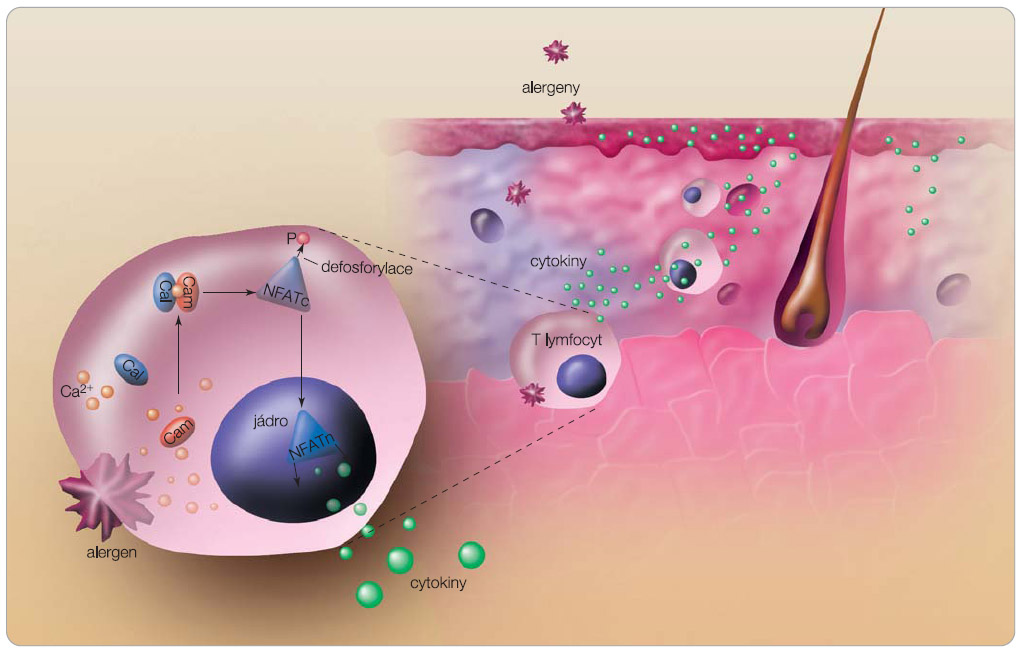 Mechanismus účinku topických imunomodulátorů je založen převážně na inhibici kalcineurinu, selektivně ovlivňují klíčové imunopatogenetické pochody (inhibují aktivaci T lymfocytů a produkci zánětlivých mediátorů (obr. 2, 3) [12, 13]. Mechanismus účinku takrolimu u AD není přesně znám. K zamezení aktivace T lymfocytů a k zábraně uvolnění prozánětlivých cytokinů dochází vazbou takrolimu na cytoplazmatický vazebný protein FKBP12 (označovaný také jako makrofilin 12) za vzniku komplexu, který inhibuje fosforylázovou aktivitu enzymu kalcineurinu [14]. Kalcineurin není schopen defosforylovat transkripční faktory aktivovaných T lymfocytů (NFAT) a umožnit jejich přesun do jádra. Tím je zabráněno transkripci a syntéze interleukinů IL-2, IL-3, IL-4, IL-5 a dalších
Mechanismus účinku topických imunomodulátorů je založen převážně na inhibici kalcineurinu, selektivně ovlivňují klíčové imunopatogenetické pochody (inhibují aktivaci T lymfocytů a produkci zánětlivých mediátorů (obr. 2, 3) [12, 13]. Mechanismus účinku takrolimu u AD není přesně znám. K zamezení aktivace T lymfocytů a k zábraně uvolnění prozánětlivých cytokinů dochází vazbou takrolimu na cytoplazmatický vazebný protein FKBP12 (označovaný také jako makrofilin 12) za vzniku komplexu, který inhibuje fosforylázovou aktivitu enzymu kalcineurinu [14]. Kalcineurin není schopen defosforylovat transkripční faktory aktivovaných T lymfocytů (NFAT) a umožnit jejich přesun do jádra. Tím je zabráněno transkripci a syntéze interleukinů IL-2, IL-3, IL-4, IL-5 a dalších 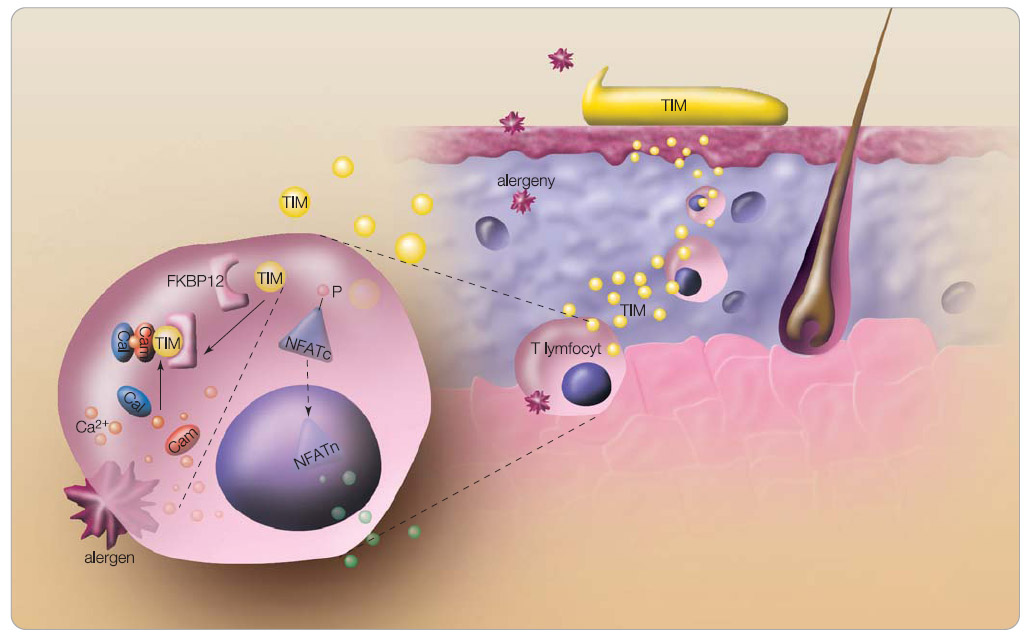 prozánětlivých cytokinů, např. GM-CSF (granulocyty–makrofágy kolonie stimulující faktor), TNF-α (tumor nekrotizující faktor α) a INF-gama (interferon gama). Takrolimus inhibuje také uvolňování mediátorů zánětu z mastocytů, bazofilů a eozinofilů. V Langerhansových buňkách snižuje stimulační aktivitu vůči T lymfocytům. Neovlivňuje syntézu dermálního kolagenu, proto nevykazuje atrofogenní účinek, jako je tomu u LK.
prozánětlivých cytokinů, např. GM-CSF (granulocyty–makrofágy kolonie stimulující faktor), TNF-α (tumor nekrotizující faktor α) a INF-gama (interferon gama). Takrolimus inhibuje také uvolňování mediátorů zánětu z mastocytů, bazofilů a eozinofilů. V Langerhansových buňkách snižuje stimulační aktivitu vůči T lymfocytům. Neovlivňuje syntézu dermálního kolagenu, proto nevykazuje atrofogenní účinek, jako je tomu u LK.
Také pimekrolimus selektivně inhibuje produkci a uvolňování zánětlivých cytokinů z T lymfocytů vazbou na imunofilin makrofilin 12 se všemi dalšími důsledky, jak bylo popsáno výše.
Farmakokinetika
Bylo prováděno mnoho krátkodobých i dlouhodobých (1 rok) studií u dospělých i u dětí se zaměřením na bezpečnost a účinnost obou preparátů. Oba preparáty mají minimální systémovou absorpci.
Systémová expozice pimekrolimu byla studována u 58 dětí ve věku od 3 měsíců do 14 let. Rozsah postižení představoval 10–92 % tělesného povrchu, děti byly léčeny přípravkem podávaným 2krát denně po 3 týdny, u 5 pacientů trvala léčba jeden rok. Koncentrace pimekrolimu v krvi byly konstantně nízké bez ohledu na rozsah lézí a délku léčení. Okolo 60 % koncentrací pimekrolimu v krvi bylo nižších než 0,5 ng/ml a u 97 % všech vzorků se koncentrace pimekrolimu v krvi pohybovaly pod úrovní 2 ng/ml. U 2 pacientů ve věku od 8 měsíců do 14 let byly nejvyšší naměřené hodnoty 2,0 ng/ml. Mezi kojenci a batolaty (3–23 měsíců) byla nejvyšší koncentrace 2,6 ng/ml naměřena pouze u jednoho pacienta. U 5 dětí léčených po dobu jednoho roku byly koncentrace v krvi stabilně nízké a nejvyšší koncentrace 1,94 ng/ml byla naměřena pouze u jednoho pacienta. U žádného z těchto 5 pacientů nebylo zjištěno zvýšení koncentrace v krvi po celou dobu léčby [16]. Pimekrolimus je metabolizován cytochromem P-450 (CYP3A4). Po lokální aplikaci jsou hladiny pimekrolimu v krvi velmi nízké, proto nemohl být stanoven metabolismus pimekrolimu po lokální aplikaci. Po jednorázovém perorálním podání radioaktivně značeného pimekrolimu dobrovolníkům byl hlavní v krvi detekovatelnou komponentou nezměněný pimekrolimus. Radioaktivita značené účinné látky byla vyloučena převážně stolicí (78,4 %) a pouze malá část (2,5 %) byla nalezena v moči. Výchozí látka nebyla detekována v moči a ve stolici byl pimekrolimus nalezen v nezměněné formě a v množství menším než 1 % [16].
Takrolimus, který se používá k imunosupresi transplantovaných pacientů, musí dosahovat v krvi koncentrace v rozmezí 5–20 ng/ml, aby se zabránilo rejekci transplantovaného orgánu. Při místní aplikaci je systémová expozice takrolimu malá, na hranici detekovatelnosti laboratorními metodami (< 0,5 ng/ml) nebo vůbec žádná [17]. Ve studii s 39 pacienty ve věku 5–75 let se středně těžkou až těžkou AD byl aplikován lokální takrolimus v koncentraci 0,3 % (tedy vyšší koncentrace než komerční) po dobu 8 dní ve 14 aplikacích. Systémová expozice takrolimu byla velmi nízká a jeho průměrné koncentrace v krvi se pohybovaly u dětí ve věku 5–11 let v rozmezí 0,1–1,9 ng/ml, u dospělých ve věku 14–75 let v rozmezí 0,2–3,5 ng/ml [18]. Další studie s 0,03% takrolimem, uskutečněná u dětí ve věku 3–24 měsíců, prokázala minimální koncentraci takrolimu v krvi; u 97 % krevních vzorků byla zaznamenána koncentrace takrolimu v krvi nižší než 1 ng/ml [19]. Čím větší plochy kůže jsou ošetřovány, tím je vyšší i detekovatelné množství takrolimu. Reparací kožní bariéry při hojení AD se rychlost a množství vstřebaného takrolimu snižuje, poněvadž zdravou kůží takrolimus neproniká [20]. Po lokální aplikaci proniká takrolimus do epidermis a dermis, v kůži není metabolizován. Systémově podaný takrolimus je metabolizován v játrech pomocí cytochromu CYP3A4. Přestože při léčbě AD takrolimem nejsou v krvi signifikantní koncentrace takrolimu, nedoporučuje se současná léčba látkami inhibujícími CYP3A4 (typu itrakonazolu a makrolidových antibiotik) [21].
Navzdory mnoha studiím potvrzujícím dobrý bezpečnostní profil TIM se objevily názory, že dlouhodobá lokální imunosuprese T lymfocytů může vést k rozvoji kožních nádorů (lymfomů a karcinomů). V roce 2005 vydal americký Úřad pro kontrolu potravin a léčiv varování před možností vzniku malignit v souvislosti s aplikací TIM [22] a zařadil je na seznam pracovně přezdívaný black box warning. Potencionální možnost vzniku malignit se opírala o 3 faktory: a) imunusupresivní mechanismus účinku, b) studie na zvířatech, c) několik postmarketingových případů lymfomů a kožních karcinomů. V experimentech na myších byla incidence lymfomů skutečně vyšší. Aplikace výsledků na lidský model se jeví jako nevhodná z několika důvodů: myší kůže je propustnější, k penetraci dochází snadněji, zvířata mast olizovala, byla použita mnohonásobně vyšší koncetrace (3% takrolimus), mast byla používána denně po dobu 2 let [23]. Studie u lidí zatím nezjistily zvýšené riziko malignit oproti obecné populaci. Několik hlášených lymfomů nemělo rysy posttransplantačního lymfoproliferativního typu jako u celkově imunosuprimovaných pacientů. Za dobu více než 10 let používání TIM bylo předepsáno několik milionů tub a ze zhodnocení výsledků vyplývá, že léčebný přínos TIM převažuje nad riziky. Přesto budou nutné další dlouhodobé studie – 10 a více let ke zhodnocení možnosti vývoje malignit.
Klinická účinnost a vedlejší účinky
Oba prostředky mají silný protizánětlivý účinek, srovnatelný s LK. TIM zmírňují do 3–7 dnů svědění a mezi 7. až 21. dnem se snižuje intenzita příznaků AD o 70 % [24]. Klinické studie prokázaly, že přípravky snižují frekvenci exacerbací AD a jejich intenzitu, prodlužují období mezi vzplanutím, zmírňují svědění a další kožní příznaky spojené s AD [25, 26]. TIM nevyvolávají rebound fenomén ani tachyfylaxi a nezpůsobují kožní atrofie ani při dlouhodobém používání. Incidence nežádoucích vedlejších účinků je nízká. Nejčastěji se jedná o různé kožní senzace typu pálení, svědění nebo píchání kůže (asi 10 % pacientů) [27] v místě aplikace, méně často o zarudnutí, kožní infekce a folikulitidu (2–3 % pacientů) [26]. Pálení, píchání, svědění a erytém jsou přechodné a mizí po prvním týdnu používání. Kůže se stává fotosenzitivní, proto by se pacienti neměli vystavovat přímému nebo umělému UV záření a měli by používat ochranné krémy. V místě aplikace může dojít k exacerbaci existující bakteriální infekce a zvyšuje se riziko virových infekcí. Kožní infekce způsobuje většinou Staphylococcus aureus, méně často jde o impetigo způsobené beta-hemolytickým streptokokem [27]. Aplikace TIM může zvyšovat četnost kožních infekcí, přestože většina studií uvádí snížení počtu bakterií na kůži ošetřované TIM. Takrolimus se vylučuje mateřským mlékem, proto je při kojení jeho podávání kontraindikováno. Vzácně se mohou vyskytnout chřipkové příznaky, bolesti hlavy, alergické reakce a astma. V klinických studiích nebyla potvrzena nižší účinnost očkování při současné aplikaci TIM, doporučuje se očkovat s 2týdenním odstupem po poslední aplikaci TIM [28].
Podle posledního doporučení FDA jsou TIM indikovány pro druhou linii léčby AD, a to pro krátkodobou nebo intermitentní léčbu střední nebo těžké AD u pacientů bez snížené imunity, u kterých selhává konvenční lokální léčba nebo u kterých ji nelze doporučit pro děti starší 2 let.
Pravidla pro léčbu TIM:
- Léčba TIM je kontraindikována u dětí do 2 let věku, v graviditě a při kojení.
- Léčba TIM je kontraindikována při přecitlivělosti na makrolidy nebo na účinnou složku TIM.
- TIM nelze aplikovat u pacientů s erytrodermií a genetickými defekty epidermální bariéry (např. Nethertonův syndrom) pro zvýšenou možnost vstřebávání.
- TIM nepodáváme imunosuprimovaným pacientům (např. po transplantacích).
- TIM nepoužíváme v léčbě pacientů s malignitami (např. s lymfomem).
- Není vhodné podávat TIM při virové nebo bakteriální superinfekci (herpes simplex, varicella, impetiginizace) – hrozí diseminace.
- Při očkování je potřeba dodržet 2týdenní interval od poslední aplikace.
- TIM nelze aplikovat na sliznice.
- Nedoporučujeme aplikovat TIM do okluze.
- TIM nepoužíváme nepřetržitě po dobu delší než 6 týdnů, při dlouhodobější léčbě dodržujeme 2týdenní pauzu.
- Kůži ošetřenou TIM je třeba chránit před UV zářením.
- TIM aplikujeme 2krát denně v kombinaci s emoliencii.
Léčba TIM je zvláště vhodná u pacientů s chronickými projevy AD nebo u nemocných s častými vzplanutími AD, u nichž by ke zmírnění onemocnění bylo zapotřebí kontinuálního ošetřování LK. Vhodné jsou pro pacienty s ekzémem na citlivých partiích kůže – kolem očí, na tvářích, na krku, na genitálu, kde hrozí systémová absorpce a riziko kožní atrofie při aplikaci LK.
Léčba atopické dermatitidy LK a TIM
Léčba akutního vzplanutí a péče o atopickou kůži musí být individuální s přihlédnutím k tíži onemocnění, četnosti exacerbací a chronicitě projevů. Je třeba zvážit poměr rizika a efektu jak při léčbě LK, tak při léčbě TIM, aby se léčba AD optimalizovala. U pacientů s exacerbací po přerušení aplikace LK je vhodné přejít na léčbu TIM. V monoterapii se TIM aplikují 2krát denně vždy při prvních projevech zánětu. LK a TIM lze kombinovat – oba přípravky mají jiný mechanismus účinku; předpokládá se, že mohou působit synergicky; lze je používat alternativně – např. 2 týdny aplikace LK střídat s 2 týdny aplikace TIM [29].
Závěr
AD je časté chronické kožní onemocnění, které začíná v časném dětství a výrazně ovlivňuje zdravotní stav dítěte a jeho vývoj, má dopad i na život celé rodiny. Včasné rozpoznání nemoci a adekvátní léčba směřuje k zablokování „atopického pochodu". U dětí s AD může epikutánní senzitizace vést k systémové alergické odpovědi a k senzitizaci na vzdušné alergeny a později v dětství může vyústit v rozvoj astmatu a/nebo alergické rýmy [30]. Zavedení TIM do léčby AD je výrazným pokrokem – příznivě ovlivňují průběh choroby a zlepšují kvalitu života pacientů. Jejich přínos jednoznačně převažuje nad rizikem, pokud jsou předepisovány správně a pokud jsou respektována pravidla léčby. Jejich použití vyžaduje zkušenost, proto zůstávají v rukou dermatologů.
Seznam použité literatury
- [1] Larsen FS, Hanifin JM. Epidemiology of atopic dermatitis. Immunol Allergy Clin North Am 2002; 22: 1–25.
- [2] Barták P. Několik poznámek k patogenezi atopické dermatitidy. Referátový výběr z dermatovenerologie. 2004; 46 (Spc. 1): 2–4.
- [3] Cork MJ, Robinson DA, Vasilopoulus Y, et al. New perspectives on epidermal barrier dysfunction in atopic dermatitis: gen-environment interactions. J Allergy Clin Immunol 2006; 118: 3–21.
- [4] Cork MJ, Danby S, Vasilopoulus Y, et al. Epidermal barier dysfunction in atopic dermatitis. Textbook of Atopic dermatitis. United Kingdom in 2008: 35–52.
- [5] Homey BM, Steinhoff M, Ruzicka T, et al. Cytokines and chemokines orchestrate atopic skin inflammation. J Allergy Clin Immunol 2006; 118: 178–189.
- [6] Čapková Š. Možnosti léčby atopické dermatitidy v roce 2008. Farmakoterapie 2008; Suplement dermatologie 3; 22–31.
- [7] Hanifin JM, Cooper KD, Ho VC, et al. Guidelines of care for atopic dermatitis. J Am Acad Dermatol 2004; 50: 391–404.
- [8] Jirásková M, Jirásek L. Možnosti a úskalí léčby kortikoidy v dermatologii. Practicus 2005; 1: 6–10.
- [9] Viktorinová M. Kortikosteroidy pro lokální léčbu kožních chorob. Remedia 2003; 13: 266–281.
- [10] Ettler K. Lokální imunomodulancia (Prakticky a kriticky). Ref výb Dermatovenerol 2005; 47: 24–25.
- [11] Kino T, Hatanaka H, Miyata S, et al. FK-506, a novel immunosuppressant isolated from a Streptomyces. II. immunosuppressive effect of FK-506 in vitro. J Antibiot (Tokyo). 1987; 40: 1256–1265.
- [12] Thesptrup-Pedersen K. Tacrolimus treatment of atopic eczema/dermatitis syndrom. Curr Opin Allergy Clin Immunol 2003; 3: 359–362.
- [13] Gupta AK, Chow M. Pimecrolimus: A review. J Acad Dermatol Venereol 2003; 17: 493–503.
- [14] Liu A, Albers MW, Wandless TJ, et al. Inhibition of T cell signaling by immunophilin-ligand complexes correlates with loss of calcineurin phosphatase activity. Biochemistry 1992; 31: 3896–3901.
- [15] Eichenfield LF, Ho V, Matsunaga J, et al. Blood concentrations, tolerability and efficacy of pimecrolimus cream 1% in Japanese infants and children with atopic dermatitis. J Dermatol 2007; 34: 231–236.
- [16] Souhrn údajů o přípravku Elidel. AISLP verze 2009.1.–1. 1. 2009; revize textu: 20. 2. 2008.
- [17] Paller A, Eichenfield LF, Leung DY, et al. A 12-week study of tacrolimus ointment for the treatment of atopic dermatitis in pediatric patients. J Am Acad Dermatol 2001; 44: 47–57.
- [18] Alaiti S, Kang S, Fiedler VC, et al. Tacrolimus (FK506) ointment for atopic dermatitis: A phase I study in adults and children. J Am Acad Dermatol 1998; 38: 69–76.
- [19] Reitamo S, Rubins A, Ho V, et al. Pharmacokinetics od topical tacrolimus in paediatric patients aged 3 to 24 months. Presented at the 15th Congress of European Academy of Dermatology and Venerology, Rhodes, Greece, 2006.
- [20] Harper J, Smith C, Rubins A, et al. A multicenter study of the pharmacokinetics of tacrolimus ointment after first and repeated application to children with atopic dermatitis. J Invest Dermatol 2005; 124: 695–699.
- [21] Breuer K, Werfel T, Kapp A. Safety and efficacy of topical calcineurin inhibitors in the treatment of childhood atopic dermatitis. Am J Clin Dermatol 2005; 6: 65–77.
- [22] Rockville MD. Center for Drug Evaluation and Research. Alert for healthcare professionals: pimecrolimus (marketed as Elidel), tacrolimus (marketed as Protopic). Food and Drug Administration. March 2005.
- [23] Anne Marie Mc Neill, John YM, Koo JY. Unknown Risks of non-steroid topical medications for atopic dermatitis. Int J Dermatol 2007; 46: 656–658.
- [24] Langley R. New therapeutic targets in atopic eczema. Acta Dermatol Venerik 2005; (Suppl. 215): 25–27.
- [25] Fowler J, Johnson A, Chen M, et al. Improvement in pruritus in children with atopic dermatitis using pimecrolimus cream 1%. Curie 2007; 79: 65–72.
- [26] Singalavanija S, Noppakun N, Limpongsanuruk W, et al. Efficacy and safety of tacrolimus ointment in pediatric patients with moderate to severe atopic dermatitis. J Med assoc Thai 2006; 89: 1915–1922.
- [27] Eichenfield LF, Thaci D, de Prost Y, et al. Clinical management of atopic eczema with pimecrolimus cream 1% ( Elidel) in paediatric patiens. Dermatology 2007; (Suppl. 1): 3–17.
- [28] Reynaert G, Rey AC, Graveriau C, et al. Streptococcal impetigo at topical tacrolimus application sites in a woman with atopic dermatitis. Ann Dermatol Venereol 2007; 134 (3 Pt 1): 261–263.
- [29] Schachner LA. What’s new in atopic dermatitis. ESP Congress, Athens, 2008.
- [30] Spergel JM, Paller AS. Atopic dermatitis and atopic march. J Allergy Clin Immunol 2003;112 (Suppl. 6): 118–127.