Vybrané novinky v prevenci, diagnostice a léčbě infekce HIV v letech 2019–2020
Souhrn:
Sedláček D, Hofman S. Vybrané novinky v prevenci, diagnostice a léčbě infekce HIV v letech 2019–2020. Remedia 2020; 30: 460–464.
Onemocnění AIDS (Acquired Immune Deficiency Syndrome, syndrom získaného selhání imunity) se objevilo v polovině roku 1981 a dosud ukončilo životy téměř 40 milionů lidí na celém světě. Přibližně stejný počet nakažených v různé fázi onemocnění dosud žije. Intenzivní výzkum možných léků probíhá po celou dobu, ale zatím nemáme lék ani vakcínu, které by byly schopny onemocnění definitivně vyléčit. Časná celoživotní léčba účinnými antiretrovirotiky, propracovaná do nejmenších detailů, umožňuje významně zpomalit rozvoj onemocnění, které se v současné době považuje za chronické, s délkou života infikovaných osob srovnatelnou s obecnou populací. Výzkum nadále pokračuje a nové objevy v oblasti biologie a genetiky lidského viru imunodeficience (human immunodeficiency virus, HIV) umožňují jednak zásahy do dalších míst jeho životního cyklu, jednak do imunitních mechanismů hostitele. Přípravky aktivující populaci infikovaných rezervoárových CD4+ lymfocytů T nabízejí jednu z cest. Další možností jsou široce působící neutralizující protilátky schopné vázat HIV kolující v krvi nebo vyplavený z rezervoárů. Výsledky klinických studií umožňují zavádět nové léky a léčebné postupy. Mnoho zemí pravidelně aktualizuje své národní doporučené postupy, podobně jako Česká republika. Na přípravě univerzální vakcíny proti HIV se pracuje již více než 30 let, zatím bezúspěšně. Probíhá mnoho klinických studií zaměřených na vývoj jednak preventivních, jednak terapeutických vakcín. Komplexní přístup s využitím antiretrovirotik, zásahů do rezervoárů HIV a neutralizujících protilátek by v budoucnu mohl pomoci k naplnění cíle Světové zdravotnické organizace – eradikovat HIV/AIDS do roku 2030.
Summary:
Sedlacek D, Hofman S. Selected updates in prevention, diagnostics and treatment of HIV infection in 2019–2020. Remedia 2020; 30: 460–464.
AIDS (Acquired Immune Deficiency Syndrome) emerged in the half of 1981 and has already ended lives of nearly 40 million people around the world. Approximately the same number of infected people in different stages of the disease still lives. Intense research of possible drugs is ongoing for the whole period, but we do not have a medicine neither a vaccine that would be capable of curing the disease once and for all. Early lifetime treatment with efficacious antiretrovirals elaborated into a detailed plan enables significant deceleration of the disease progression that is now regarded as chronic, with life expectancy of the infected people similar to general public. The research continues and new developments in the area of biology and genetics of HIV (human immunodeficiency virus) make it possible both to disrupt its life cycle in new places and to impact the host immune mechanisms. Meidcinal products that activate the population of infected reservoir CD4+ T lymphocytes offer one opportunity. Another possibility is wide‑spectrum neutralizing antibodies capable of HIV binding from blood and flooded out from reservoirs. The results of clinical studies enable an introduction of new drugs and medical procedures. Many countries regularly update their national recommended guidelines, just like the Czech Republic. The development of a universal vaccine has been in progress for more than 30 years, up till now unsuccessfully. There are many clinical studies focused on the development of both preventive and therapeutic vaccines. Complex approach with antiretrovirals, HIV reservoir impacts and neutralizing antibodies could help reach the goal of World Health Organization – to eradicate HIV/AIDS to 2030.
Key words: HIV, AIDS – treatment, antiretrovirals, research, clinical studies, conference reports
Úvod
Léčba infekce lidským virem imunodeficience (human immunodeficiency virus, HIV) využívající tzv. klasická antiretrovirotika je v současné době propracována do nejmenších detailů. Existují mezinárodní doporučené postupy, které rychle reagují na nové poznatky z rozsáhlých randomizovaných klinických studií, jež jsou publikovány na velkých světových či evropských konferencích. Mnoho zemí si pravidelně aktualizuje své národní doporučené postupy, podobně jako Česká republika.
Současná situace infekce HIV/AIDS
ve světě
Odhaduje se, že od roku 1981 se HIV nakazilo 78 milionů lidí, z nichž polovina již zemřela. Předpokládá se, že v současné době žije 37,9 milionu osob infikovaných HIV. Ročně se nakazí další necelé dva miliony osob (téměř 6 000 lidí denně). Celosvětově stále dominuje HIV 1, subtyp C (asi 50 % z celkového počtu nakažených HIV), v průmyslově rozvinutých zemích je nejčastější HIV 1, subtyp B (12 %). Ročně umírá v důsledku AIDS asi 770 000 osob. Jeho oběťmi jsou převážně dívky, ženy, mladí lidé, muži, kteří mají sex s muži, a další osoby v riziku, stigmatizovaní, kteří často nemají přístup k prevenci a léčbě. To platí zejména v Subsaharské Africe, kde v některých komunitách žije více než polovina populace s HIV [1,2].
Současný stav antiretrovirové
terapie
V průběhu posledních dvou dekád
se pro léčbu infekce HIV vytvořily léčebné postupy, které
vycházely z dostupnosti nově vyvinutých léků ze skupiny
nukleosidových/nukleotidových inhibitorů reverzní transkriptázy
(N(t)RTI), nenukleosidových inhibitorů reverzní transkriptázy
(NNRTI), inhibitorů virové proteázy (PI), inhibitorů vstupu
(entry inhibitors, EI), inhibitorů fúze (FI) a inhibitorů
virové integrázy (integrase strand transfer inhibitors, INSTI).
Nejčastěji užívané kombinace antiretrovirotik jsou uvedeny
v tabulkách 1 a 2.
Informace z konferencí o HIV/AIDS
v letech 2019–2020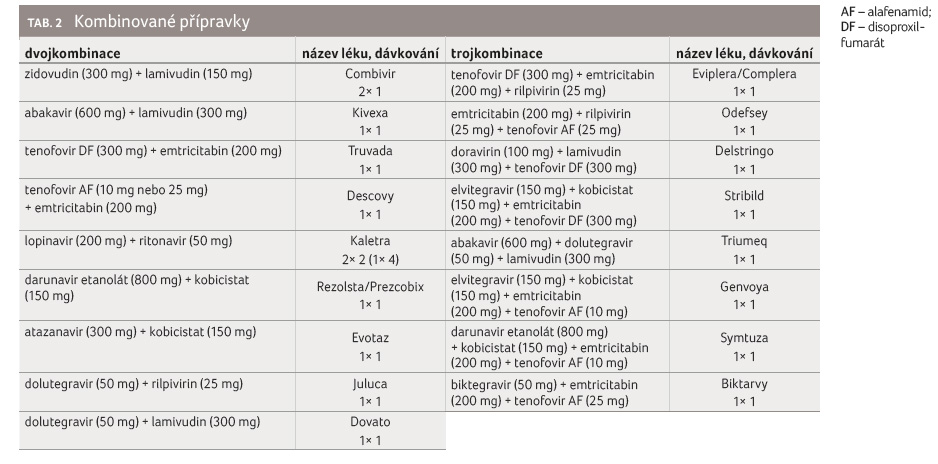
Výzkum a vývoj nových antiretrovirových léků stále pokračuje, a to již čtvrtou dekádou. Kromě klasických skupin antiretrovirových přípravků, v nichž přibývají nové léky již jen velmi pozvolna, se v posledních letech pozornost vědců zaměřuje na novější cíle replikačního cyklu HIV, simplifikaci režimů a látky působící dlouhodobě, umožňující méně časté dávkování než antiretrovirotika užívaná v perorálních každodenních režimech. Pozornost byla věnována také široce působícím neutralizujícím protilátkám použitelným pro záchrannou léčbu osob infikovaných vysoce rezistentními kmeny HIV.
V loňském roce proběhlo několik důležitých konferencí zaměřených na problematiku diagnostiky a léčby infekce HIV. Většinou byly prezentovány výsledky právě probíhajících studií, ale i novinky ze základního či aplikovaného výzkumu.
V listopadu 2019 se odborná veřejnost dozvěděla o tom, že byl objeven nový kmen HIV. Nazývá se HIV 1 skupiny M, podtyp L a byl detekován pomocí celogenomového sekvenování nové generace. Objev pracovní skupiny společnosti Abbott byl zveřejněn v časopise JAIDS [3]. Pokud má být neobvyklý virus prohlášen za nový podtyp HIV, musejí být objeveny nezávisle tři případy. První dva vzorky tohoto podtypu byly objeveny v Demokratické republice Kongo v osmdesátých a devadesátých letech, třetí až v roce 2001. Teprve nové technologie odhalily příslušné odlišnosti. Tato metoda je obecně použitelná při pátrání po dalších původcích infekčních onemocnění s cílem zabránit případným pandemiím.
CROI 2020
Letošní Konference o retrovirech a oportunních infekcích (Conference on Retroviruses and Opportunistic Infections, CROI 2020, Boston), přestože byla z důvodů pandemie COVID 19 na poslední chvíli zrealizována virtuálně, přinesla mnoho nových poznatků a byla předzvěstí vývoje virtuální kongresové problematiky pro letošní rok.
Na předkongresovém sympoziu byly prezentovány dva nové léčebné postupy. První vychází z možnosti odstranění většiny buněk infikovaných HIV z organismu a inhibice zbývajících. Druhý je založen na geneticko inženýrských postupech a má buď zvýšit odolnost CD4+ buněk, které se tak stanou imunními vůči HIV, nebo u CD4+ buněk navodí novou hypersenzitivní imunitní reakci na virus [4].
Praktické využití má příspěvek o výsledcích antiretrovirové terapie (ART) zaměřený na osoby starší 50 let. Jedná se o sdružená data získaná za 144 týdnů trvání dvou randomizovaných, dvojitě zaslepených, non inferiorních studií fáze III u dosud neléčených pacientů (GS US 380 1489 a GS US 380 1490). Studie porovnávaly kombinaci léčiv BIC/FTC/TAF (biktegravir/emtricitabin/tenofovir alafenamid) a režim obsahující dolutegravir s NRTI z hlediska účinnosti a bezpečnosti. Statistické zpracování prokázalo, že účinnost obou léčebných režimů přesahovala 80 % a byla ve 144. týdnu srovnatelná v obou sledovaných podskupinách, tj. u osob mladších i starších 50 let [5].
Zajímavé je sdělení o tzv. londýnském pacientovi (Adam Castillejo), HIV pozitivním muži, který před 30 měsíci v rámci komplexní léčby maligního hematologického onemocnění podstoupil transplantaci kmenových buněk od vybraného dárce s homozygotní delecí 32bp pro chemokinový koreceptor CCR5. I po dvou a půl letech bez ART u něho onemocnění neprogreduje a v jeho lymfatických tkáních, krvi a dalších biologických tekutinách není dosud prokazatelný funkční HIV. Až 99 % jeho imunitních buněk bylo v jeho krvi nahrazeno dárcovskými. Tento způsob léčby je vysoce rizikový a je vyhrazen pro osoby infikované HIV, které současně mají život ohrožující hematologické malignity. Není však vyloučeno, že v budoucnu v rámci genové terapie bude možno podobné postupy aplikovat i v jiných situacích. Prvním pacientem, jehož se podařilo vyléčit z infekce HIV, byl již v roce 2011 Timothy Brown, tzv. berlínský pacient s podobným onemocněním i způsobem léčby [6].
Podobná byla zpráva o čtyřletém dítěti intrauterinně nakaženém HIV, které bylo od druhého dne života po dobu jednoho roku léčeno ART. Nyní, po třech letech po ukončení léčby, je stále v remisi [7].
Po mnoha letech neúspěchů bylo prezentováno sdělení o účinné vakcíně, která indukuje tvorbu tzv. široce působících neutralizačních protilátek proti HIV. Může to být první krok ke konstrukci dlouho očekávané preventivní či terapeutické vakcíny. Účinné, bezpečné a všeobecně dostupné vakcíny proti HIV jsou dlouho očekávanou součástí preventivních protiepidemických programů. Vakcíny spolu s účinnou léčbou dávají naději, že s jejich pomocí bude infekce HIV postupně eliminována. Problematika vývoje vakcíny proti HIV je složitá především s ohledem na časté chyby při přepisu genomu retrovirů, čímž vznikají varianty původního HIV označované jako kvazispecies. Touto cestou se mj. vytvořily i jednotlivé subtypy HIV. Ty mohou mít odlišné vlastnosti díky odlišnosti různých proteinů syntetizovaných během translace. Na povrchu HIV vznikají antigenně odlišná místa, která přirozeně brání imunitnímu sytému ve správném rozpoznání virových partikulí, ale i rezervoárů s jejich obsahem. Podobně je však obtížné najít konstantní úseky proteinů s antigenními vlastnostmi společnými pro více subtypů HIV, které by mohly být použity při přípravě vakcíny. Nové objevy na poli technologií nás však přibližují k očekávaným cílům – jednak k přípravě vakcíny, jednak k posílení vlivu imunitního systému s následnými zásahy do rezervoárů a jejich likvidací [8].
Vzhledem k imunologickým rozdílům mezi ženami a muži hraje pohlaví zřejmě důležitou roli v ovlivnění úspěšnosti léčebných strategií. Zařazování žen do klinických studií je však významně omezeno [9].
AIDS 2020
Také 23. mezinárodní konference o AIDS (AIDS 2020), která se měla původně uskutečnit v San Francisku (6.−10. 7. 2020), se letos koná virtuálně pro reálné riziko nákazy SARS-CoV 2. Pro letošní rok bylo zvoleno motto „resilience“ (volně přeloženo jako psychická odolnost). Program bude zaměřen především na onemocnění COVID 19 u osob s infekcí HIV, na nové přípravky stimulující imunitní systém a zmenšující latentní rezervoáry HIV, na problematiku zvyšování hmotnosti osob léčených antiretrovirotiky, na šíření povědomí o tom, že osoby s nedetekovatelnými hodnotami HIV jsou minimálně rizikové pro své okolí (undetectable equals untransmittable, U = U) a na zkušenosti s preexpoziční profylaxí a jejím postupným zaváděním do afrických zemí.
Zprávy z literatury
V lednu 2020 se odborná komunita dozvěděla o výsledcích studie vědců z Univerzity v Severní Karolíně Chapel Hill a Univerzity Emory s použitím přípravku AZD5582, který umožnil aktivaci krevních a rezervoárových CD4+ T lymfocytů latentně infikovaných HIV. Přípravek vykazoval minimální toxicitu. Práce byla publikována v časopise Nature [10]. Autoři nejprve suprimovali produkci HIV v CD4+ buňkách pomocí ART s využitím humanizovaného myšího modelu odpovídajícího plně funkční imunitní odpovědi u lidí. Výzkum byl později rozšířen o ART suprimované makaky rhesus infikované opičím virem imunodeficitu (SIV). Přípravek AZD5582 pozoruhodně reaktivoval latentní SIV v klidových CD4+ T lymfocytech a indukoval produkci virové RNA v krvi v téměř všech tkáních (v některých případech byl nárůst více než dvacetinásobný), přestože makakové dostávali ART. Stejné výsledky byly pozorovány na myším modelu.
Tato skutečnost je považována za důležitý krok k možné budoucí eradikaci HIV u infikovaných lidí. Různé látky aktivující produkci HIV v rezervoárech a tím usnadňující jeho odhalení a likvidaci nakažených buněk pomocí imunitního systému jsou studovány již několik let. Některé látky užívané k aktivaci kanonické (klasické) dráhy nukleárního faktoru kappa B (NFκB) byly použity i k aktivaci CD4+ T lymfocytů. Spuštění této dráhy, v níž je postupně aktivováno několik stovek genů, se jevilo jako příliš agresivní a toxické. Pozornost výzkumníků byla proto obrácena na nekanonickou signální dráhu NFκB v CD4+ T lymfocytech. Ukázalo se, že AZD5582 (mimetikum druhého mitochondriálního aktivátoru kaspázy, SMACm) může sloužit jako účinná aktivační látka, která zajišťuje postupnou a trvalou aktivaci nekanonické signální dráhy NFκB, neboť aktivuje méně lidských genů než jiné podobné látky, a tím je mnohem méně toxická. Byl tak vytvořen jednoduchý, reprodukovatelný nástroj pro testování hypotézy, že aktivace latentních HIV může navodit likvidaci rezervoáru [10].
Stejní autoři z Univerzity Emory publikovali v tomtéž čísle časopisu Nature jiný způsob aktivace rezervoárových virů [11]. Primátům s potlačenou produkcí SIV pomocí ART injikovali protilátky s cílem odstranit CD8+ T lymfocyty, buňky důležité pro kontrolu infekce. Poté primátům aplikovali látku N 803 (modifikovaný interleukin [IL] 15 s dimerickým receptorem pro IL 15) a pozorovali, že po podání této kombinace bylo možné v krvi a tkáních prokázat virovou RNA, přestože tam dříve přítomna nebyla. Stejné výsledky autoři obdrželi i s použitím modelu s humanizovanými myšmi. Zatím není jasné, zda se strategie s eliminací CD8+ T lymfocytů dá použít také u lidí, přesto tyto výsledky představují nové možnosti, jak porozumět mechanismům kontroly HIV u lidí a případně je také ovlivňovat. Dnes již víme, že HIV lze z rezervoárů uvolnit, a tím se objevuje řada možností pro vývoj nových léčebných postupů, které mohou v budoucnu vést k vyléčení pacientů infikovaných HIV.
Počátkem března 2020 proběhla v odborné literatuře zpráva výzkumného centra Univerzitní nemocnice v Montrealu o důležitosti časného zahájení ART. To, co jsme již dlouho znali z naší klinické praxe, se nyní konečně vysvětlilo. Díky široké mezinárodní spolupráci se prokázalo, že zahájení ART bezprostředně po potvrzení HIV pozitivity může zmenšit rezervoáry HIV až 100krát. Rezervoáry HIV jsou především lymfatické tkáně obsahující tzv. klidové CD4+ T lymfocyty. Tyto buňky mají dlouhý poločas života a HIV je zapsán v jejich genomu. HIV se v nich množí, neboť rezervoáry mohou být pro ART hůře dostupné. U 170 akutně infikovaných osob (medián věku 27 let, 164 mužů) se však prokázalo, že v prvních dvou týdnech infekce HIV (etapy Fiebig I–II) jsou tyto rezervoáry, lokalizované v lymfatických uzlinách a lymfoidních tkáních včetně střevní, pro ART dostupné, a díky tomu mohou být významně zredukovány. Úplná eliminace rezervoárů však zatím možná není. Pozdní zahájení léčby již tuto výhodu nemá [12].
Pro další rozšíření preexpoziční profylaxe (PrEP) je jistě příznivá zpráva, která se objevila v polovině května 2020. V randomizované studii HPTN 083 (sponzorované NIAID) s více než 4 500 dobrovolníky, která byla zahájena v roce 2016 a v důsledku pandemie COVID 19 se opozdila, byl osobám neinfikovaným HIV každé dva měsíce intragluteálně aplikován dlouhodobě působící kabotegravir (CAB, nový inhibitor HIV integrázy). Výsledek studie potvrdil významnou ochranu proti viru HIV: ve větvi s CAB se vyskytlo 12 nákaz HIV, ve větvi s tenofovir disoproxil fumarátem/emtricitabinem (TDF/FTC) 38 nákaz, což představuje 0,38% incidenci v rameni s CAB oproti 1,21% incidenci v rameni s TDF/FTC. Rozdíl činí 69 %. Tento postup se může stát další preventivní alternativou vedle již delší dobu užívaných kombinací s TDF/FTC. Z nežádoucích vedlejších reakcí se vyskytovalo zarudnutí v místě vpichu. Zatím chybí jednoznačné vysvětlení pro 12 případů selhání CAB. Uvažuje se o rychlejší eliminaci léku u některých jedinců nebo o možné nákaze v časné fázi po aplikaci CAB, jehož sérová koncentrace ještě nebyla účinná, pokud v této době neužívali předepsaný TDF/FTC. Není vyloučena ani možnost nákazy variantou HIV rezistentní vůči CAB (https://www.hptn.org/research/studies/hptn083).
Doporučené postupy
Evropská klinická společnost pro AIDS publikovala od roku 2005 již 10. verzi doporučených postupů pro léčbu infekce HIV/AIDS; tato verze vešla v platnost v listopadu 2019. Dokument je rozdělen do šesti částí: celkový přehled problematiky v tabelární formě, doporučení pro zahájení a změny ART, lékové interakce, diagnostika, monitorování a léčba komorbidit a koinfekce a oportunní infekce. K dispozici je rovněž elektronická verze, která je průběžně doplňována a je dostupná na adrese https://eacs.sanfordguide.com/. Doporučený postup pro HIV pozitivní osoby žijící v ČR byl inovován a vyšel v časopise Klinická mikrobiologie a infekční lékařství v polovině roku 2019. Je rovněž dostupný na stránkách Společnosti infekčního lékařství JEP na adrese www.infekce.cz/DPHIV19.htm.
Nové přípravky zaváděné v ČR
V průběhu předešlých 10 let
se postupně optimalizovala léčba HIV s využitím
trojkombinačních režimů. Ne vždy je však nutné (někdy možné)
používat tuto léčbu trvale. Studie ukázaly, že pacienti
dlouhodobě stabilizovaní při podávání trojkombinačního režimu
mohou mít prospěch i z režimů dvojkombinačních.
Některé dvojkombinační režimy lze dle výsledků studií použít
i jako iniciální. Takovým je např. dvojkombinace
dolutegraviru (50 mg) a lamivudinu (300 mg) (Dovato).
Ze skupiny NNRTI se v letošním roce na našem trhu
objevil doravirin tbl. 100 mg (Pifeltro) a jeho kombinace
s lamivudinem (300 mg) a tenofovir DF (300 mg)
(Delstringo).
Výzkum a vývoj nových ART
Již bylo zmíněno, že vývoj nových
potenciálních léčiv stále pokračuje (obr. 1) [13].
Autoři studií se zaměřují na nové cíle, používají
monoklonální protilátky cíleně konstruované proti nejrůznějším
epitopům, vyvíjejí přípravky s dlouhým biologickým
poločasem umožňující léčbu méně adherentních pacientů,
snaží se zasáhnout do rezervoárů HIV a kombinují
jednotlivé přípravky vyšších generací z různých tříd
ve snaze maximálně oddálit vývoj rezistentních kmenů HIV.
Některé substance a jejich vlastnosti jsou uvedeny v tabulce 3.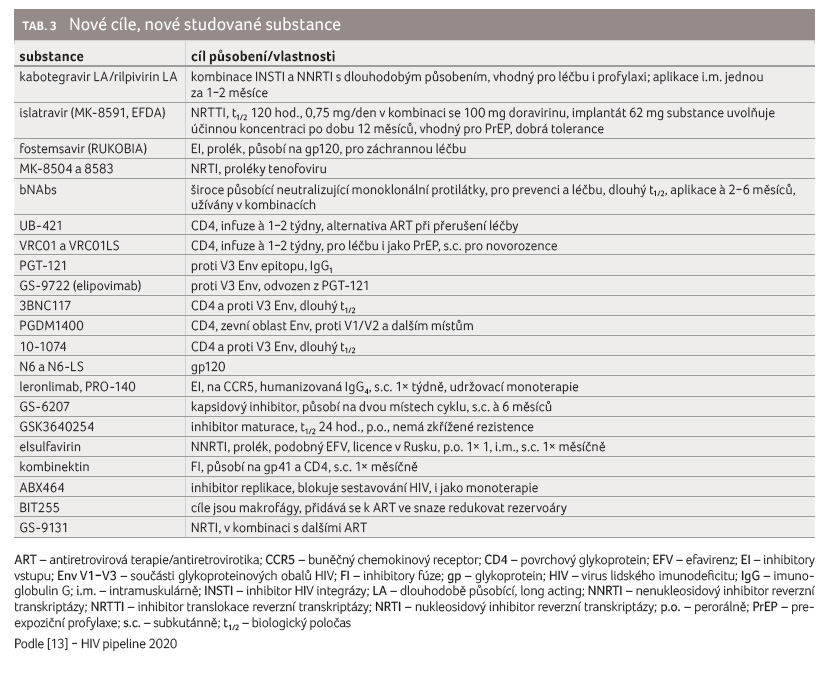
Závěr
Přestože onemocnění AIDS i jeho původce HIV jsou známy již bezmála 40 let, nebyl dosud nalezen způsob, jak onemocnění vyléčit. Počáteční vývoj léčiv se zaměřoval na jednotlivé fáze replikačního cyklu HIV, později se léky kombinovaly tak, aby najednou zasáhly více míst životního cyklu HIV. Vývoj léčby pokračoval od původních přípravků vyšších generací přes pokusy o zásahy do dalších míst životního cyklu HIV až po nynější snahy o aktivaci klidových stadií HIV v rezervoárech. To se v současné době jeví jako velmi nadějný počin, který by do budoucna, pravděpodobně ještě i s podporou dalších léčebných přípravků, mohl napomoci k úplnému odstranění jak infikovaných CD4+ T lymfocytů, tak i samotného HIV i jeho genetických kódů z rezervoárových buněk a tím k vyléčení. Spolu s vývojem protektivních vakcín by tak mohl být naplněn cíl Světové zdravotnické organizace – eradikace HIV/AIDS do roku 2030.
Seznam použité literatury
- [1] WHO. Global HIV & AIDS statistics — 2020 fact sheet. Dostupné na: https://www.unaids.org/en/resources/fact‑sheet
- [2] WHO. Number of people (all ages) living with HIV Estimates by WHO region. Dostupné na: https://apps.who.int/gho/data/view.main.22100WHO?lang=en
- [3] Yamaguchi J, Vallari A, McArthur C, et al. Brief Report: Complete Genome Sequence of CG‑0018a‑01 Establishes HIV‑1 Subtype L. JAIDS 2020; 83: 319−322.
- [4] Rust B, Colonna L, Brandenstein K, et al. Chimeric antigen receptor T‑cells control SHIV replication in post‑ATI macaques. Conference on Retroviruses and Opportunistic Infections 2020. Abstr 76.
- [5] Mills A, Gupta SK, Brinson C, et al. 144‑Week efficacy and safety of B/F/TAF in treatment‑naive adults ≥50 yrs. Conference on Retroviruses and Opportunistic Infections 2020. Abstr 477.
- [6] Gupta RK, Peppa D, Pace M, et al. Sustained HIV remission in the London patient: The case for HIV cure. Conference on Retroviruses and Opportunistic Infections 2020. Abstr 346LB.
- [7] Heresi GP, Richman DD, Al Hammoud R, et al. Sustained remission in a 4‑year‑old hiv‑infected child treated in first year of life. Conference on Retroviruses and Opportunistic Infections 2020. Abstr 347LB.
- [8] Casazza JP, Narpala S, Novik L, et al. Durable HIV‑1 antibody production in humans after AAV8‑mediated gene transfer. Conference on Retroviruses and Opportunistic Infections 2020. Abstr 41LB.
- [9] Scully EP. Sex differences in HIV. Conference on Retroviruses and Opportunistic Infections 2020. Abstr 63.
- [10] Nixon CC, Mavigner M, Sampey GC, et al. Systemic HIV and SIV latency reversal via non‑canonical NF‑κB signalling in vivo. Nature 2020; 578: 160–165.
- [11] McBrien JB, Mavigner M, Franchitti L, et al. Robust and persistent reactivation of SIV and HIV by N‑803 and depletion of CD8+ cells. Nature 2020; 578: 154–159.
- [12] Leyre L, Kroon E, Vandergeeten C, et al. Abundant HIV‑infected cells in blood and tissues are rapidly cleared upon ART initiation during acute HIV infection. Sci Transl Med 2020; 12: eaav3491.
- [13] HIV pipeline 2020. Dostupné na: http://i‑base.info/htb/37221