Vyšetřování citlivosti k tigecyklinu v 15 mikrobiologických laboratořích České republiky
Tigecyklin je nové antibiotikum, jehož aktivita zasahuje gramnegativní i grampozitivní bakterie včetně kmenů rezistentních k jiným skupinám antibiotik. Laboratorní výsledky vyšetření citlivosti původců infekcí k tigecyklinu lze použít jako relevantní podklad pro léčbu pacientů nebo ke sledování stavu a trendů rezistence pouze za předpokladu jejich správné interpretace. Cílem této práce bylo prověřit podmínky, které umožní získat reprodukovatelné a hodnověrné výsledky vyšetření citlivosti k tigecyklinu v rutinní praxi.
V 15 laboratořích České republiky bylo diskovou difuzní metodou vyšetřeno 807 kmenů bakterií izolovaných z příslušných vzorků odebraných pacientům s infekčním onemocněním. Inhibiční zónu kolem disku s 15 mg tigecyklinu menší, než je limit 19 mm pro citlivé kmeny, vytvářelo 59 kmenů (7,3 %); u nich byla v Národní referenční laboratoři pro antibiotika vyšetřena minimální inhibiční koncentrace (MIC) tigecyklinu. Při vyšetření MIC bujonovou diluční mikrometodou, která je metodou volby pro vyšetření citlivosti bakterií k antibiotikům pro vysokou reprodukovatelnost výsledků, se počet kmenů necitlivých k tigecyklinu snížil na 2,3 %, byl-li pro interpretaci citlivosti gramnegativních tyček použit limit (neboli break-point) FDA 2 mg/l, respektive na 4,8 %, byl-li použit pro interpretaci limit EUCAST 1 mg/l. V této práci bylo potvrzeno, že výsledky MIC tigecyklinu získané Etestem jsou o jednu až dvě koncentrace vyšší než výsledky získané bujonovou diluční mikrometodou. Koncentrace 1 mg/l rozděluje distribuci MIC tigecyklinu v divoké populaci gramnegativních tyček zejména při vyšetření MIC Etestem, a proto použití limitu FDA 2 mg/l snižuje počet chyb. Nově navrhovaný limit pro diskovou difuzní metodu 16 mm sice výrazně snížil počet diskrepancí ve srovnání s původním limitem 19 mm, ale k jeho zavedení do rutinní praxe je zapotřebí více údajů.
Úvod
Tigecyklin je nový analog tetracyklinu ze skupiny glycylcyklinů. Podobně jako tetracykliny se vyznačuje širokým spektrem účinku na mnohé aerobní i anaerobní bakterie, a je účinný i na kmeny k tetracyklinům rezistentní. Podrobnější informace o tomto novém antibiotiku přinesla Remedia v minulém roce [1]. Zvlášť pozoruhodná je skutečnost, že tigecyklin také inhibuje v terapeuticky dosažitelných koncentracích kmeny bakterií rezistentní k jiným antibiotikům, jako jsou např. MRSA (meticilin-rezistentní Staphylococcus aureus), pneumokoky rezistentní k penicilinu, enterobakterie produkující enzymy inaktivující β-laktamová antibiotika včetně širokospektrých β-laktamáz a karbapenemáz a také mnohé přirozeně multirezistentní kmeny gramnegativních nefermentujících tyček z rodu Acinetobacter a Stenotrophomonas. Vzhledem k tomu, že v poslední době se tyto bakterie uplatňují stále častěji jako příčina závažných infekcí, patří tigecyklin do skupiny život zachraňujících léků. V roce 2005 schválila americká instituce Food and Drug Administration (FDA) klinické použití tigecyklinu u dospělých s komplikovanými infekcemi kůže, měkkých tkání a s nitrobřišními infekcemi, včetně komplikované apendicitidy, nitrobřišních abscesů, hlubokých infekcí a infekcí u popálených a infikovaných ulcerací. Tytéž indikace pro tigecyklin schválila evropská agentura European Medicines Agency (EMEA) v roce 2006. V březnu roku 2009 rozšířila FDA indikace tigecyklinu o léčbu dospělých pacientů v komunitě s plicními infekcemi způsobenými obvyklými původci, jako jsou pneumokoky, hemofily a legionely, včetně bakteremických forem těchto infekcí. Vzhledem k vynikajícímu průniku a rychlé distribuci tigecyklinu v měkkých tkáních a dobré in vitro účinnosti na některé původce nozokomiálních infekcí se po získání uspokojivých klinických podkladů předpokládá v budoucnu další rozšíření indikací tigecyklinu, např. pro léčbu nozokomiálních plicních infekcí způsobených MRSA, případně pro další infekce, u nichž je použití tigecyklinu v současné době mimo schválené indikace (tzv. off label). V roce 2008 byly zveřejněny první výsledky o dobré účinnosti tigecyklinu in vitro v České republice (ČR) získané vyšetřením multirezistentních invazivních izolátů bakterií bujonovou diluční mikrometodou v Národní referenční laboratoři pro antibiotika (NRL/ATB) [2]. Přes optimistické výsledky z této a jiných studií, potvrzující dobrou aktivitu tigecyklinu in vitro [3–8] i při léčbě [7, 9–14], je nezbytné průběžně získávat vlastní informace o situaci ve stavu citlivosti hlavních původců infekcí k tigecyklinu v ČR a sledovat případné změny.
Základní podmínkou umožňující dosáhnout věrohodných výsledků laboratorního vyšetření citlivosti bakterií k antibiotikům, které lze použít jako relevantní podklad pro výběr léčby, je správná interpretace naměřených hodnot aktivity antibiotika získaných diskovou difuzní metodou nebo stanovením minimální inhibiční koncentrace (MIC) antibiotika. Vzhledem k tomu, že výsledky vyšetření citlivosti bakterií získané různými metodami se mohou lišit, je dobrou praxí při zavádění nového antibiotika prověřit podmínky, které umožní získat reprodukovatelné a hodnověrné výsledky. Nezbytnost získat vlastní zkušenosti s vyšetřováním citlivosti bakterií k tigecyklinu vyplynula ze skutečnosti, že 1) pro kategorizaci citlivosti u enterobakterií podle MIC tigecyklinu udává FDA hodnoty [15], od kterých se liší hodnoty navrhované evropskou institucí EUCAST (European Committee on Antimicrobial Susceptibility Testing) [16]; 2) kritéria pro hodnocení výsledků diskové difuzní metody uvádí pouze FDA [15]; 3) hodnotu MIC ovlivňuje použitá metoda vyšetření [17, 18]; 4) byla navržena nová kritéria pro hodnocení výsledků získaných diskovou difuzní metodou u enterobakterií [19, 20]. Tento článek přináší první zkušenosti s vyšetřováním citlivosti bakteriálních původců infekcí k tigecyklinu v rutinní praxi 15 laboratoří ČR ověřené v NRL/ATB.
Materiál a metody
Laboratoře
V zúčastněných laboratořích, které vyšetřují vzorky od pacientů hospitalizovaných ve velkých českých nemocnicích, byly v průběhu dvou měsíců zaznamenávány konsekutivní kvantitativní údaje o citlivosti vybraných bakterií k tigecyklinu. Vyšetřování se zúčastnily tyto laboratoře: Bakteriologické oddělení FNKV, Praha; Antibiotické středisko VFN Praha; Antibiotické středisko FN Motol, Praha; Oddělení klinické mikrobiologie IKEM, Praha; Bakteriologické oddělení Klinlab, Praha; Oddělení bakteriologie FN Plzeň; Antibiotické středisko FN Hradec Králové; Oddělení klinické mikrobiologie Masarykova nemocnice, Ústí nad Labem; Antibiotické středisko Nemocnice České Budějovice; Oddělení klinické mikrobiologie FN Brno; Antibiotické středisko FN U Sv. Anny Brno; Antibiotické středisko, FN Olomouc; Antibiotické středisko, Zdravotní ústav Ostrava; Oddělení klinické mikrobiologie, Státní nemocnice Opava.
Bakterie
Do souboru byly zahrnuty bakterie izolované z klinicky validních vzorků od pacientů z krve, hnisu, dýchacích cest a moči. Každá laboratoř měla vyšetřit celkem 60 kmenů tak, aby soubor zahrnoval 10 kmenů Staphylococcus aureus (citlivých k oxacilinu), 10 kmenů Escherichia coli, 15 kmenů Klebsiella pneumoniae a po pěti kmenech MRSA, koaguláza-negativních stafylokoků, enterokokoků, Acinetobacter baumannii a Stenotrophomonas maltophilia. Laboratoře při identifikaci těchto kmenů postupovaly podle rutinně používaných metod, v NRL/ATB byla identifikace kmenů potvrzena konvenčními testy.
Vyšetřování citlivosti
Citlivost k tigecyklinu byla vyšetřena rutinní diskovou difuzní metodou [21]. U kmenů, které vytvářely kolem disku s obsahem 15 µg tigecyklinu inhibiční zóny menší než 19 mm, a byly tudíž podle kritérií FDA necitlivé k tigecyklinu [15], byla vyšetřena minimální inhibiční koncentrace (MIC) tigecyklinu pomocí Etestu (rozmezí koncentrací 0,016–256 mg/l; AB Biodisk, Solna). Tyto kmeny byly současně zaslány do NRL/ATB k ověření výsledků Etestu laboratoří a k vyšetření MIC tigecyklinu bujonovou diluční mikrometodou (BDM) [21]. Kromě toho laboratoře zaslaly do NRL/ATB 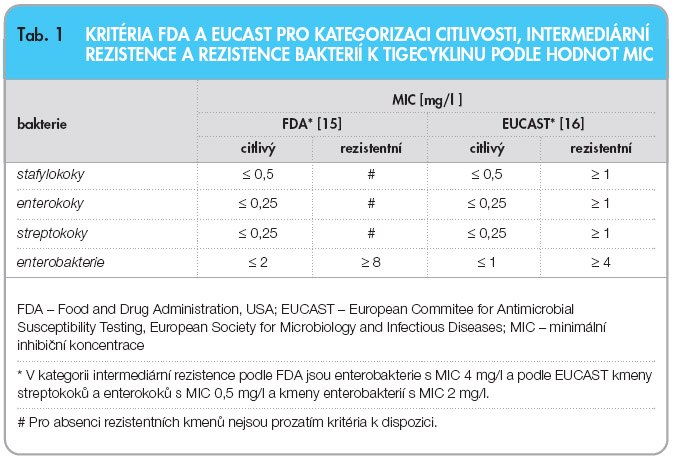 také dva grampozitivní a dva gramnegativní kmeny citlivé k tigecyklinu k ověření výsledků vyšetření a rovněž všechny izoláty Acinetobacter baumannii a Stenotrophomonas maltophilia. Pro stanovení MIC v mikrotitračních destičkách byly koncentrace tigecyklinu, poskytnutého výrobcem (Wyeth), v rozmezí 0,004–8 mg/l připraveny v čerstvě připraveném Mueller Hinton bujonu k zamezení inaktivace antibiotika kyslíkem [17]. Ke kategorizaci citlivosti kmenů bakterií podle výsledků MIC byla použita kritéria FDA [15] a EUCAST [16], která uvádějí hraniční koncentrace (break-pointy) pro citlivé kmeny a rezistentní kmeny (tab. 1).
také dva grampozitivní a dva gramnegativní kmeny citlivé k tigecyklinu k ověření výsledků vyšetření a rovněž všechny izoláty Acinetobacter baumannii a Stenotrophomonas maltophilia. Pro stanovení MIC v mikrotitračních destičkách byly koncentrace tigecyklinu, poskytnutého výrobcem (Wyeth), v rozmezí 0,004–8 mg/l připraveny v čerstvě připraveném Mueller Hinton bujonu k zamezení inaktivace antibiotika kyslíkem [17]. Ke kategorizaci citlivosti kmenů bakterií podle výsledků MIC byla použita kritéria FDA [15] a EUCAST [16], která uvádějí hraniční koncentrace (break-pointy) pro citlivé kmeny a rezistentní kmeny (tab. 1).
Kontrola kvality vyšetření citlivosti k tigecyklinu byla v laboratořích i v NRL/ATB pro antibiotika ověřována kontrolními kmeny podle obecně respektovaných hodnot udávaných Clinical and Laboratory Standard Institute (CLSI) [22]. Pro diskovou difuzní metodu a diluční mikrometodu byly použity kmeny Escherichia coli ATCC 25922 a Enterococcus faecalis ATCC 29212, pro diskovou metodu byl použit také kmen Staphylococcus aureus ATCC 25923 a pro diluční mikrometodu kmen Staphylococcus aureus ATCC 25213.
Výsledky
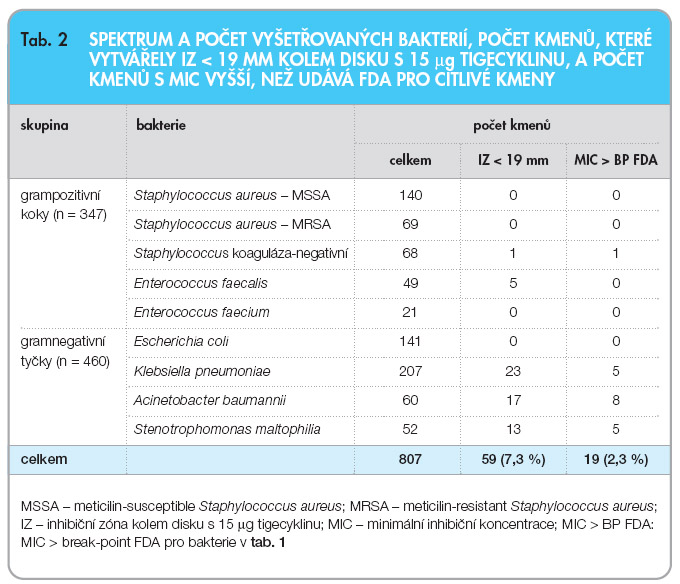 Zúčastněné laboratoře shromáždily výsledky diskové difuzní metody vyšetření citlivosti k tigecyklinu celkem u 807 kmenů bakterií, z nich 347 byly grampozitivní koky a 460 gramnegativní tyčky. Inhibiční zóny kolem disku s 15 µg tigecyklinu menší než 19 mm, tzn. necitlivost k tigecyklinu podle kritérií FDA [15], vytvářelo celkem 59 z 807 kmenů (7,3 %). Šest z těchto kmenů byly grampozitivní koky (1 koaguláza-negativní stafylokok a 5 kmenů Enterococcus faecalis) a 53 kmeny gramnegativních tyček (23 kmenů Klebsiella pneumoniae, 17 kmenů Acinetobacter baumannii a 13 kmenů Stenotrophomonas maltophilia). Podrobnější přehled podává tab. 2.
Zúčastněné laboratoře shromáždily výsledky diskové difuzní metody vyšetření citlivosti k tigecyklinu celkem u 807 kmenů bakterií, z nich 347 byly grampozitivní koky a 460 gramnegativní tyčky. Inhibiční zóny kolem disku s 15 µg tigecyklinu menší než 19 mm, tzn. necitlivost k tigecyklinu podle kritérií FDA [15], vytvářelo celkem 59 z 807 kmenů (7,3 %). Šest z těchto kmenů byly grampozitivní koky (1 koaguláza-negativní stafylokok a 5 kmenů Enterococcus faecalis) a 53 kmeny gramnegativních tyček (23 kmenů Klebsiella pneumoniae, 17 kmenů Acinetobacter baumannii a 13 kmenů Stenotrophomonas maltophilia). Podrobnější přehled podává tab. 2.
U 59 kmenů, které se jevily jako necitlivé k tigecyklinu při vyšetření diskovou difuzní metodou, byla vyšetřena 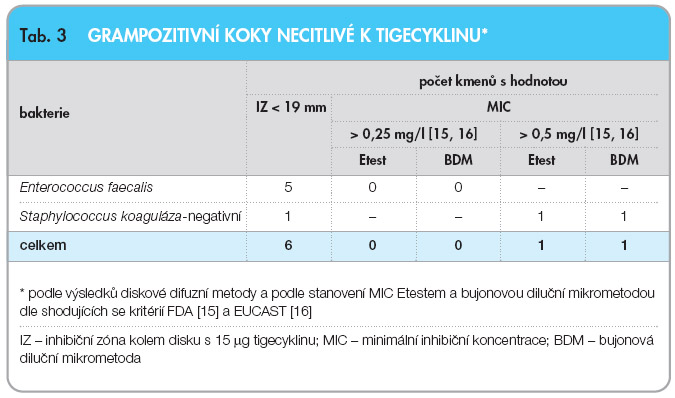 MIC tigecyklinu bujonovou diluční metodou (BMD) a Etestem. Při vyšetření BDM a při použití kritérií FDA bylo necitlivých k tigecyklinu jen 19 kmenů (2,3 %) (tab. 2). Srovnání počtu necitlivých kmenů při vyšetření diskovou metodou, BMD a Etestem uvádí tab. 3 pro grampozitivní koky a tab. 4 pro gramnegativní tyčky. Pět enterokoků, které se jevily při vyšetření diskovou metodou jako necitlivé k tigecyklinu, bylo inhibováno koncentrací ≤ 0,25 mg/l tigecyklinu bez ohledu na metodu vyšetření MIC, a tyto kmeny tudíž byly k tigecyklinu citlivé, zatímco necitlivost koaguláza-negativního stafylokoka k tigecyklinu (MIC > 0,5 mg/l) byla potvrzena oběma metodami vyšetření MIC (tab. 3).
MIC tigecyklinu bujonovou diluční metodou (BMD) a Etestem. Při vyšetření BDM a při použití kritérií FDA bylo necitlivých k tigecyklinu jen 19 kmenů (2,3 %) (tab. 2). Srovnání počtu necitlivých kmenů při vyšetření diskovou metodou, BMD a Etestem uvádí tab. 3 pro grampozitivní koky a tab. 4 pro gramnegativní tyčky. Pět enterokoků, které se jevily při vyšetření diskovou metodou jako necitlivé k tigecyklinu, bylo inhibováno koncentrací ≤ 0,25 mg/l tigecyklinu bez ohledu na metodu vyšetření MIC, a tyto kmeny tudíž byly k tigecyklinu citlivé, zatímco necitlivost koaguláza-negativního stafylokoka k tigecyklinu (MIC > 0,5 mg/l) byla potvrzena oběma metodami vyšetření MIC (tab. 3).
Break-point tigecyklinu pro citlivé enterobakterie udávaný FDA je 2 mg/l, a tudíž se liší o jednu koncentraci dvojnásobně geometrické řady od break-pointu EUCAST, který je 1 mg/l (tab. 1). Pro gramnegativní tyčky jiné, než jsou enterobakterie, zatím neexistují specifické break-pointy pro tigecyklin, a 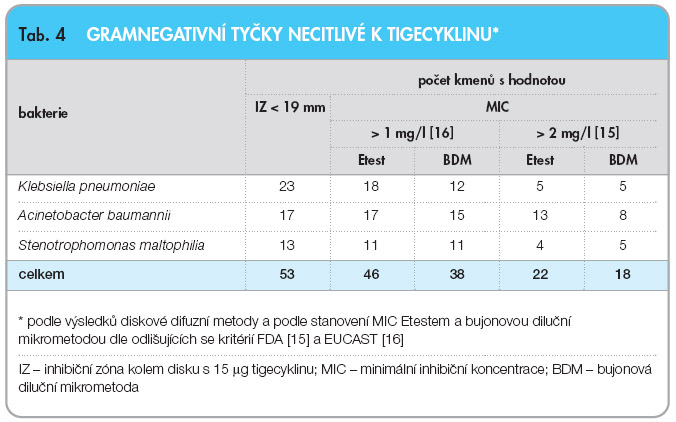 k hodnocení jejich citlivosti se používají kritéria pro enterobakterie. V tab. 4 jsou podle těchto kritérií hodnoceny výsledky vyšetření MIC získané Etestem a BDM u 53 kmenů gramegativních tyček necitlivých podle výsledků diskové metody (průměr inhibiční zóny < 19 mm). Necitlivých k tigecyklinu bylo 22 kmenů při vyšetření Etestem a pouze 18 kmenů při vyšetření BDM, pokud byl použit FDA break-point > 2 mg/l, zatímco byl-li použit break-point > 1 mg/l [16], počet necitlivých kmenů při vyšetření Etestem dosáhl 46 a při vyšetření BDM byl jejich počet 38 (tab. 4).
k hodnocení jejich citlivosti se používají kritéria pro enterobakterie. V tab. 4 jsou podle těchto kritérií hodnoceny výsledky vyšetření MIC získané Etestem a BDM u 53 kmenů gramegativních tyček necitlivých podle výsledků diskové metody (průměr inhibiční zóny < 19 mm). Necitlivých k tigecyklinu bylo 22 kmenů při vyšetření Etestem a pouze 18 kmenů při vyšetření BDM, pokud byl použit FDA break-point > 2 mg/l, zatímco byl-li použit break-point > 1 mg/l [16], počet necitlivých kmenů při vyšetření Etestem dosáhl 46 a při vyšetření BDM byl jejich počet 38 (tab. 4).
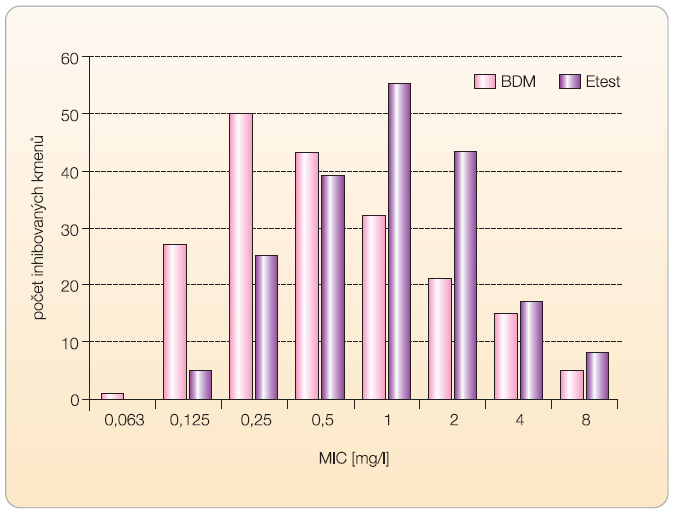 Graf 1 ilustruje distribuci MIC tigecyklinu v souboru 192 bakterií (včetně 59 kmenů necitlivých k tigecyklinu podle diskové metody), u nichž byla v NRL/ATB vyšetřena MIC BDM i Etestem. Z grafu je patrné, že hodnoty MIC získané BDM jsou o jednu až dvě koncentrace dvojnásobně geometrické řady nižší než hodnoty MIC při vyšetření Etestem. Bylo zjištěno, že při vyšetření Etestem převyšoval počet kmenů s MIC tigecyklinu > 1 mg/l (n = 68) počet kmenů necitlivých k tigecyklinu podle diskové metody (n = 58), znamená to, že MIC vyšší než 1 mg/l měly při vyšetření Etestem také kmeny, které vytvářely inhibiční zóny ≥ 19 mm, a byly tedy podle výsledků diskové metody k tigecyklinu citlivé.
Graf 1 ilustruje distribuci MIC tigecyklinu v souboru 192 bakterií (včetně 59 kmenů necitlivých k tigecyklinu podle diskové metody), u nichž byla v NRL/ATB vyšetřena MIC BDM i Etestem. Z grafu je patrné, že hodnoty MIC získané BDM jsou o jednu až dvě koncentrace dvojnásobně geometrické řady nižší než hodnoty MIC při vyšetření Etestem. Bylo zjištěno, že při vyšetření Etestem převyšoval počet kmenů s MIC tigecyklinu > 1 mg/l (n = 68) počet kmenů necitlivých k tigecyklinu podle diskové metody (n = 58), znamená to, že MIC vyšší než 1 mg/l měly při vyšetření Etestem také kmeny, které vytvářely inhibiční zóny ≥ 19 mm, a byly tedy podle výsledků diskové metody k tigecyklinu citlivé.
Tab. 5 uvádí srovnání počtu kmenů gramnegativních tyček necitlivých k tigecyklinu při vyšetření diskovou metodou s diskem o obsahu 15 µg tigecyklinu podle kritéria FDA (< 19 mm) a podle nové hodnoty (< 16 mm), kterou navrhují pracovníci respektované instituce CLSI [19, 20]. Podle nově navrženého kritéria (< 16 mm) se počet kmenů gramnegativních tyček necitlivých k tigecyklinu snížil z 53 na 27 (tab. 5). Tento počet koreloval s počtem kmenů K.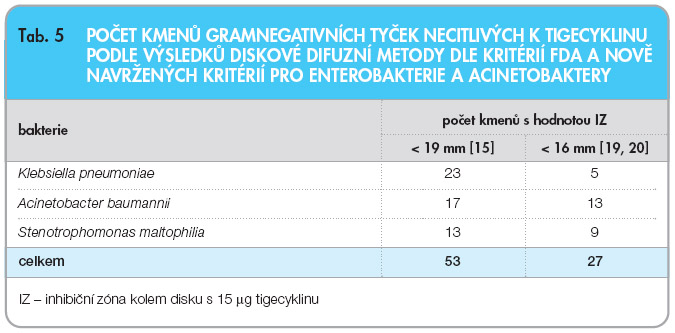 pneumoniae necitlivých k tigecyklinu s použitím FDA break-pointu > 2 mg/l dle výsledků standardní BDM i vyšetření pomocí Etestu a rovněž se snížil počet diskrepancí u kmenů nefermentujících tyčinek A. baumannii a S. maltophilia (viz tab. 4 a 5). Podle nově navrhovaného kritéria < 16 mm se počet necitlivých kmenů K. pneumoniae snížil z 23 na pět, zatímco počet necitlivých kmenů A. baumannii a S. maltophilia se snížil ze 17 na 13, respektive z 13 na 9 kmenů (tab. 5).
pneumoniae necitlivých k tigecyklinu s použitím FDA break-pointu > 2 mg/l dle výsledků standardní BDM i vyšetření pomocí Etestu a rovněž se snížil počet diskrepancí u kmenů nefermentujících tyčinek A. baumannii a S. maltophilia (viz tab. 4 a 5). Podle nově navrhovaného kritéria < 16 mm se počet necitlivých kmenů K. pneumoniae snížil z 23 na pět, zatímco počet necitlivých kmenů A. baumannii a S. maltophilia se snížil ze 17 na 13, respektive z 13 na 9 kmenů (tab. 5).
Diskuse
Tigecyklin je antibiotikum významné pro léčbu komplikovaných infekcí včetně infekcí nozokomiálních, jehož účinek může být ohrožen rezistencí původců těchto infekcí. Jako u všech ostatních antibiotik může však být skutečná aktivita tigecyklinu při vyšetření in vitro také ovlivněna podmínkami, použitou metodou nebo kritériem zvoleným pro kategorizaci citlivosti. Nejspolehlivější výsledky poskytuje stanovení minimální inhibiční koncentrace antibiotik (MIC) bujonovou diluční mikrometodou. Toto vyšetření je pro reprodukovatelnost a konzistenci výsledků metodou volby pro vyšetření kvantitativní citlivosti rychle rostoucích bakterií, mezi které patří – s výjimkou anaerobů a mykobakterií – téměř všichni původci humánních infekcí [23]. Jiné metody vyšetření MIC a disková difuzní metoda jsou metodami alternativními. V případě potřeby se jejich výsledky ověřují vyšetřením MIC bujonovou diluční mikrometodou, která je v ČR také metodou referenční, stejně jako v USA [22, 23].
Z celkového počtu 807 bakterií vyšetřených ve zúčastněných laboratořích diskovou difuzní metodou vytvářelo 59 kmenů (7,3 %) inhibiční zóny kolem disku s 15 mg tigecyklinu menší, než je limit pro citlivé kmeny. Po vyšetření MIC tigecyklinu u těchto 59 kmenů bujonovou diluční mikrometodou v NRL/ATB bylo 27 kmenů gramnegativních tyčinek necitlivých k tigecyklinu podle FDA break-pointu 2 mg/l [15], podle EUCAST break-pointu 1 mg/l [16] byl jejich počet 38. Bez ohledu na použitý break-point patřily všechny necitlivé kmeny ke gramnegativním tyčkám s výjimkou jediného kmene koaguláza-negativního stafylokoka. Celkově je ve vyšetřovaném souboru (celkem 807 kmenů) počet kmenů necitlivých k tigecyklinu nízký, podle použitého break-pointu > 2 mg/l a > 1 mg/l činí 2,3 %, respektive 4,8 %, a koreluje s výsledky velkých studií [3, 5, 8]. Při vyšetření MIC Etestem a bujonovou diluční mikrometodou je počet necitlivých kmenů gramnegativních tyčinek 22, respektive 18 kmenů pouze tehdy, použije-li se k hodnocení výsledků break-point 2 mg/l. Použije-li se k vyhodnocení výsledků MIC break-point 1 mg/l, v závislosti na použité metodě je počet necitlivých kmenů o více než polovinu vyšší a činí 38 kmenů při vyšetření bujonovou diluční mikrometodou a 46 kmenů při vyšetření Etestem. Tyto diskrepance jsou pravděpodobně způsobeny tím, že se distribuce MIC tigecyklinu v divoké populaci většiny bakterií pohybuje v rozmezí 0,063–2 mg/l [24]; použije-li se k hodnocení break-point 1 mg/l, určitá část této populace (jejíž velikost závisí na druhu bakterie) se proto jeví jako necitlivá k tigecyklinu. Počet těchto kmenů se může dále zvýšit, je-li MIC tigecyklinu stanovena Etestem. Srovnání hodnot MIC tigecyklinu vyšetřených u stejných kmenů bakterií bujonovou diluční mikrometodou a Etestem ukázalo, že hodnoty MIC získané Etestem jsou u většiny bakterií vyšší zhruba o jednu koncentraci dvojnásobně geometrické řady a u některých kmenů druhu Acinetobacter spp., Serratia spp. a Streptococcus pneumoniae mohou být vyšší až čtyřnásobně [16]. Toto pozorování bylo potvrzeno i v této práci, kdy počet kmenů necitlivých k tigecyklinu byl nezávislý na použité metodě jen za předpokladu, že k hodnocení byl použit vyšší break-point. Výsledek vyšetření citlivosti diskovou difuzní metodou je mnohem významněji ovlivněn podmínkami testu, zejména koncentrací inokula, než vyšetření MIC [23].
Počet diskrepancí, kdy se kmeny zdánlivě jevily jako necitlivé k tigecyklinu při vyšetření diskovou difuzní metodou ve srovnání s výsledky referenční metody vyšetření MIC, byl radikálně snížen, pokud limitní inhibiční zóna pro oddělení citlivých kmenů bakterií od necitlivých byla snížena na 16 mm [19, 20] z původních 19 mm [15]. Aplikace nově navrhovaného break-pointu 16 mm snížila počet chyb při vyšetření citlivosti acinetobakterů z 23,3 % na akceptovatelný počet 9,7 % [19], podobně u enterobakterií byl počet chyb snížen z 3,1 % na 0,6 % [20]. Použití limitní inhibiční zóny 16 mm eliminovalo část diskrepancí s výsledky vyšetření MIC bujonovou diluční mikrometodou také v této práci.
V ČR se k vyšetření MIC používá v řadě laboratoří bujonová diluční mikrometoda, v rutinní praxi je však nejčastěji používána disková difuzní metoda a k vyšetření MIC se také používá Etest. Pečlivá ověřování výsledků citlivosti souboru bakterií k tigecyklinu, získaných těmito metodami na 15 mikrobiologických pracovištích velkých nemocnic a v NRL/ATB, umožnila zjistit příčinu rozdílných výsledků. Lze předpokládat, že závěry této analýzy přispějí k získání reprodukovatelných a hodnověrných výsledků potřebných pro výběr antibiotika k léčbě pacienta i k analýze stavu a trendů citlivosti bakterií k tigecyklinu.
Poděkování
Děkujeme firmě Wyeth Whitehall Czech s.r.o. za podporu projektu zavedení in vitro testování nového antibiotika. Za spolupráci děkujeme pracovníkům z regionálních mikrobiologických laboratoří: Evě Bendové, Tamaře Bergerové, Marii Dovalové, Markétě Hanslianové, Magdaleně Horníkové, Evě Chmelařové, Milanu Kolářovi, Anně Jedličkové, Haně Müllerové, Janě Niemczykové, Otakaru Nyčovi, Vladimíru Petkovovi, Eugenii Pozlerové, Martě Štolbové a Renatě Tejkalové, a z Národní referenční laboratoře pro antibiotika: Martě Fridrichové, Ivetě Vrbové a Jiřímu Kašíkovi.
Seznam použité literatury
- [1] Marešová V, Urbášková P. Tigecyklin. Remedia 2008; 18: 194–200.
- [2] Žemličková H, Urbášková P. In vitro activity of tigecycline against methicillin resistant Staphylococcus aureus, vancomycin-resistant enterococci, and extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae clinical isolates collected in the Czech Republic. Abstract P592. In: 18th European Congress of Clinical Microbiology and Infectious Diseases. Barcelona, Spain, 19–22 April, 2008. Clin Microbiol Infect 2008; 14 (Suppl. 7).
- [3] Bouchillon SK, Hoban DJ, Johnson BM, et al. In vitro activity of tigecycline against 3989 gram-negative and gram-positive clinical isolates from the United States Tigecycline Evaluation and Surveillance Trial (TEST Program; 2004). Diagn Microbiol Infect Dis 2005; 52: 173–179.
- [4] Castanheira M, Sader HS, Deshpande LM, et al. Antimicrobial activities of tigecycline and other broad-spectrum antimicrobials tested against serine-carbapenemase- and metallo-b-lacta-mase-producing Enterobacteriaceae: report from the SENTRY Antimicrobial Surveillance Program. Antimicrob Agents Chemother 2008; 52: 570–573.
- [5] Draghi DC, Tench S, Dowzicky MJ, Sahm DF. Baseline in vitro activity of tigecycline among key bacterial pathogens exhibiting multidrug resistance. Chemotherapy 2008; 54: 91–100.
- [6] Gales AC, Jones RN, Andrade SS, et al. In vitro activity of tigecycline, a new glycylcycline, tested against 1,326 clinical bacterial strains isolated from Latin America. Braz J Infect Dis 2005; 9: 348–356.
- [7] Kelesidis T, Karageorgopoulos DE, Kelesidis I, Falagas ME. Tigecycline for the treatment of multidrug-resistant Enterobacteriaceae: a systematic review of the evidence from microbiological and clinical studies. J Antimicrob Chemother 2008; 62: 895–904.
- [8] Sader HS, Jones RN, Stilwell MG, et al. Tigecycline activity tested against 26,474 bloodstream infection isolates: a collection from six continents. Diagn Microbiol Infect Dis 2005; 5: 181–186.
- [9] Breedt J, Teras J, Gardovskis J, et al. Safety and efficacy of tigecycline in treatment of skin and skin structure infections: Results of a double-blind phase 3 comparison study with vancomycin-aztreonam. Antimicrob Agents Chemother 2005, 49: 4658–4666.
- [10] Dandache P, Nicolau DP, Sakoulas G. Tigecycline for the treatment of multidrug-resistant Klebsiella pneumoniae meningitis. Infect Dis Clin Practice 2009; 17: 66–68.
- [11] Daly MW, Riddle DJ, Ledeboer NA. Tigecycline for treatment of pneumonia and empyema caused by carbapenemase-producing Klebsiella pneumoniae. Pharmacotherapy 2007; 27: 1052–1057.
- [12] Florescu I, Beran M, Domov R, et al. Efficacy and safety of tigecycline compared with vancomycin or linezolid for treatment of serious infections with methicillin-resistant Staphylococcus aureus or vancomycin-resistant enterococci: a Phase 3, multicentre, double-blind, randomized study. J Antimicrob Chemother 2008; 62 (Suppl. I): i17–i28.
- [13] Poulakou G, Kontopidou FV, Paramythiotou E, et al. Tigecycline in the treatment of infections from multi-drug resistant gram-negative pathogens. J Infect 2009; 58: 273–284.
- [14] Swoboda S, Ober M, Hainer C, et al. Tigecycline for the treatment of patients with severe sepsis or septic shock: a drug use evaluation in a surgical intensive care unit. J Antimicrob Chemother 2008; 61: 729–733.
- [15] Tygacil package insert. Dostupný na http://www. accessdata.fda.gov/drugsatfda_docs/nda/2005/21-821_Tygacil.cfm
- [16] EUCAST – European Committee on Antimicrobial Susceptibility Testing. Tetracyclines – EUCAST clinical MIC breakpoints. Dostupný na http:// www.escmid.org/research_projects/eucast/clinical_breakpoints/
- [17] Brown SD, Traczewski MM. Comparative in vitro antimicrobial activity of tigecycline, a new glycylcycline compound, in freshly prepared medium and quality control. J Clin Microbiol 2007; 45: 2173–2179.
- [18] Pillar CM, Draghi DC, Dowzicky MJ, Sahm DF. In vitro activity of tigecycline against gram-positive and gram-negative pathogens as evaluated by broth microdilution and Etest. J Clin Microbiol 2008; 46: 2862–2867.
- [19] Jones RN, Ferraro MJ, Reller LB, et al. Multicenter studies of tigecycline disk diffusion susceptibility results for Acinetobacter spp. J Clin Microbiol 2007; 45: 227–230.
- [20] Sader HS, Ferraro MJ, Reller LB, et al. Reevaluation of disk diffusion breakpoints for tigecycline when testing Enterobacteriaceae. Poster C-054, 107th General Meeting of American Society for Microbiology; Toronto 2007.
- [21] Urbášková P. Rezistence bakterií k antibiotikům. Vybrané metody. ISBN 80-238-3106-2. TRIOS Praha 1998.
- [22] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; eighteen informational supplement. CLSI Document M100-S18. Clinical and Laboratory Standards Institute, USA, Pa, 2008.
- [23] Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically: approved standard-seventh edition. CLSI Document M7-A7. Clinical and Laboratory Standards Institute, USA, Pa, 2006.
- [24] EUCAST. European Committee on Antimicrobial Susceptibility Testing. MIC distributions of wild type microorganisms. Dostupný na http: //eucast. www137.server1.mensemedia.net/mic_distributions_of_wild_type_microorganisms/