Význam proproteinových konvertáz subtilisin/kexinového typu (PCSK) nejen v regulaci metabolismu lipidů
Souhrn:
Zavedení statinů do léčby dyslipidemie před třemi dekádami bylo nesporně jedním z klíčových úspěchů moderní medicíny. V poslední době přichází nová skupina hypolipidemik založená na inhibici proproteinových konvertáz subtilisin/kexinového typu 9 (inhibitory PCSK9). Výsledky hodnocení prvého roku léčby dvěma monoklonálními protilátkami – alirocumabem a evolocumabem – dokládají, že se jedná o vysoce potentní léčebnou strategii při vysoké snášenlivosti a bezpečnosti. Rodina devíti proproteinových konvertáz PCSK má však zřejmě daleko významnější úlohu než jen řízení metabolismu aterogenních lipoproteinů. Mimo jiné se uplatňují v řízení metabolismu glycidů, ukládání tukové tkáně, kontroly krevního tlaku, vývoje a funkce CNS, v onkogenezi či v obranyschopnosti organismu k bakteriálním a virovým infekcím. Je velmi pravděpodobné, že o „farmakologii PCSK“ ještě uslyšíme. Cílem tohoto článku je podat základní přehled o mechanismu účinku inhibitorů PCSK9 a zasadit tuto léčebnou strategii do širšího kontextu.
Key words:
proprotein convertases – PCSK9 – alirocumab – evolocumab – dyslipidemia treatment – LDL receptor – apolipoprotein B100.
Summary:
Introducing statins into the treatment of dyslipidemia was, no doubt, one of the crucial successes of modern medicine. Lately, a new group of hypolipidemics acting through the inhibition of proprotein convertases subtilisin/kexin type 9 (PCSK9 inhibitors) has entered the market. The evaluation of the first year experience with two monoclonal antibodies – alirocumab and evolocumab – shows that these drugs offer a highly potent treatment strategy with supreme tolerability and safety. The family of nine proprotein convertases PCSK, however, seems to have much wider effects than just regulation of atherogenic lipoprotein metabolism. These enzymes also have their role in glycide metabolism regulation, fat tissue deposition, blood pressure control, development and function of CNS, oncogenesis or protection of the organism from bacterial and viral infections. It is very likely that we shall hear more about the “PCSK pharmacology”. The aim of this article is to provide a basic review of PCSK9 inhibitor mechanisms of action and to place this treatment strategy in a wider context.
Nadějnou novinkou v léčbě dyslipidemie jsou inhibitory proproteinových konvertáz PCSK9 (proprotein convertase subtilisin/kexin 9). Vskutku revoluční strategie snížení vysoké koncentrace LDL (low‑density lipoproteins, lipoproteiny o nízké hustotě) cholesterolu vedla k tomu, že inhibice PCSK9 byla zařazena na prvé místo v „Top 10 Cardiology Stories 2015“. V posledním roce se objevuje plejáda více či méně zasvěcených přehledů věnovaných klinickému významu alirocumabu a evolocumabu, dvou inhibitorů PCSK9 na bázi humánních monoklonálních protilátek. Jejich společným jmenovatelem je důraz na výsledky klinického hodnocení, menší prostor však byl věnován jejich mechanismu působení a farmakodynamickému účinku.
Cílem tohoto sdělení je rozšířit pohled nejen na inhibici izoenzymu PCSK9, ale na celou skupinu proproteinových konvertáz. Článek je určen farmakologům i klinikům, které, doufám, neodradí již samotný obtížně zapamatovatelný a mnoho neříkající název skupiny. Bez nadsázky se dá říci, že čeští „lipidologové“ se dělí na ty, kteří již název bez škobrtnutí vysloví, a na ty, kteří se to ještě učí.
Význam proproteinových konvertáz subtilisin/kexinového typu v regulaci fyziologických pochodů
Nejprve je vhodné uvést několik poznámek k názvosloví této relativně nové skupiny „regulátorů“. Proproteinové konvertázy jsou rodinou enzymů, resp. lépe izoenzymů, které aktivují řadu biologicky aktivních proteinů (zejména enzymy, cytokiny, neuropeptidy, membránové 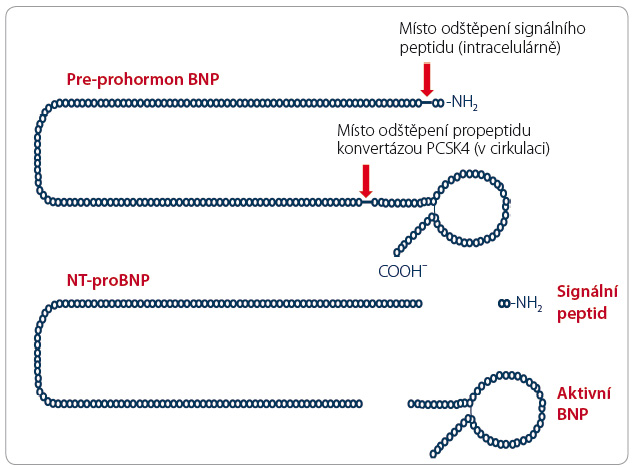 proteiny či glykoproteiny), jež jsou secernovány v neaktivním stavu jako proproteiny. Takto jsou aktivovány desítky, či spíše stovky prohormonů, proenzymů a dalších proproteinů. Insulinem, reninem, natriuretickými peptidy, parathormonem či von Willebrandovým faktorem počínaje a bakteriálními toxiny či proteiny umožňujícími průnik viru do buňky hostitele konče. Vlastní aktivace proproteinu je dosaženo odštěpením části řetězce a odhalením jeho biologicky účinného místa (obr. 1).
proteiny či glykoproteiny), jež jsou secernovány v neaktivním stavu jako proproteiny. Takto jsou aktivovány desítky, či spíše stovky prohormonů, proenzymů a dalších proproteinů. Insulinem, reninem, natriuretickými peptidy, parathormonem či von Willebrandovým faktorem počínaje a bakteriálními toxiny či proteiny umožňujícími průnik viru do buňky hostitele konče. Vlastní aktivace proproteinu je dosaženo odštěpením části řetězce a odhalením jeho biologicky účinného místa (obr. 1).
Druhá část jména – subtilisin/kexin‑like – byla zvolena k označení těchto proproteinových konvertáz pro jejich strukturální podobnost s enzymy bakteriální stěny (subtilisiny) či s enzymy stěny kvasinek (kexiny). Během více než dvaceti let výzkumu věnovaných izoenzymům PCSK se částice „like“ z názvu vytratila a termín se stal méně pochopitelným. Poslední část, tedy číslovka 1 až 9, upřesňuje, o který izoenzym se jedná [1].
Rodina konvertáz označovaných zkratkou PCSK se účastní v regulaci řady fyziologických pochodů a je klíčová v udržení homeostázy. Dominantní tkáně exprese představuje nervová soustava, endokrinní žlázy a játra. Porucha jejich funkce stojí v pozadí řady patologických stavů. Dopad změny aktivity ve smyslu plus či minus byl prověřován jak v experimentu (zejména u myší s vyřazeným genem – tzv. knockoutovaných – pro konkrétní konvertázu), tak u lidí s mutacemi typu gain‑of‑function a loss‑of‑function (se zvýšenou či se sníženou aktivitou izoenzymů). Doložen byl význam konvertáz pro vývoj dyslipidemie (PCSK9), diabetu (PCSK2), pro diferenciaci oddílů mozku během embryogeneze a později jejich podíl na aktivitě CNS (PCSK2); mutace ovlivňují vznik obezity (více izoenzymů), modifikují aktivitu primární hemostázy (PCSK3), uplatňují se v etiopatogenezi maligního bujení a poruch fertility (PCSK4) či v regulaci krevního tlaku (PCSK4 a PCSK6). Pro zajímavost je možno uvést i vliv na afinitu ke kuřáckému návyku (PCSK1 a PCSK2) nebo na pravo/levé rozpoznávání při vývoji organismu – např. snížení aktivity PCSK6 stojí v pozadí za vznikem situs inversus nebo ovlivňuje výskyt sinistrality („leváctví“). Přítomnost konvertáz typu PCSK ve tkáních makroorganismu je klíčová pro aktivaci povrchových proteinů umožňujících intracelulární průnik řady virů (včetně HIV) či uvolnění a aktivaci bakteriálních exotoxinů [2–4].
Je pravděpodobné, že v příštích letech o „farmakologii PCSK“ ještě uslyšíme. Již nyní jsou inhibitory PCSK4 (furinu) intenzivně testovány v rámci onkologické léčby či v léčbě řady infekcí, zejména anthraxu. Ve vývoji jsou desítky molekul na bázi biologické léčby (zejména monoklonálních protilátek) i klasických „mikromolekul“ [5].
Pro klinické užití byla schválena dvě léčiva na bázi humánních monoklonálních protilátek proti PCSK9 – alirocumab a evolocumab. Počáteční, zatím zhruba roční zkušenosti dokládají výbornou účinnost (snížení koncentrace LDL (low density lipoproteins, lipoproteiny o nízké hustotě) cholesterolu o více než 60 % s odpovídajícím, více než 50%, poklesem mortality/morbidity). Překvapivá je i bezpečnost a snášenlivost léčby každým z těchto léčiv přípravků [6]. Vzhledem k tomu, že právě tolerance a bezpečnost léčby zůstává v pozadí, je vhodné uvést několik dat ze jmenované analýzy amerického Úřadu pro potraviny a léky (Food and Drug Administration, FDA) [6]. Podíváme‑li se na nežádoucí účinky spojené s léčbou těmito monoklonálními protilátkami, nevidíme rozdíly proti placebu. Lokální a celkové alergické reakce se objevily při podávání placeba ve 2,4 % případů, při léčbě evolocumabem ve 3,2 %; infekční komplikace se při podávání placeba vyskytly celkem v 19,1 %, při podávání evolocumabu v 21,0 %. Nežádoucí účinky typické pro aplikaci statinů se rovněž neobjevily. Myalgie či artralgie se objevily při podávání placeba ve 4,8 %, při podávání evolocumabu ve 4,4 %, vzestup hodnot kreatinkinázy (nad pětinásobek normy) byl v obou skupinách identický – došlo k němu v 0,7 %. Rovněž porucha glycidového metabolismu – hyperglykemie či nově vzniklý diabetes mellitus – se objevila v obou skupinách stejně často: v 0,8 %, resp. v 0,9 %. Jiný mechanismus účinku při inhibici PCSK9 s sebou nenese „klasické“ nežádoucí projevy provázející léčbu statiny.
Účinnost a bezpečnost dalších dvou desítek molekul na bázi monoklonálních protilátek, klasických mikromolekulárních léků či interferující kyseliny ribonukleové (RNA) se nalézá v různých fázích vývoje a hodnocení. Vzhledem k orientaci článku na klinickou medicínu je vhodné se dále věnovat této perspektivní oblasti.
Význam izoenzymu PCSK9 v regulaci metabolismu lipidů
Proproteinová konvertáza subtilisin/kexinového typu 9 je významným regulátorem metabolismu lipidů a lipoproteinů. Nejčastěji uváděný mechanismus působení PCSK9, založený na aktivaci lyzosomální degradace receptoru pro LDL, je jen polovinou pravdy. Dalším významným účinkem je zabránění lyzosomální degradaci apolipoproteinu B100 (apoB100), přítomného v aterogenních lipoproteinech o nízké hustotě a o velmi nízké hustotě (very low density lipoproteins, VLDL) a umožnění jeho recyklace. Oba mechanismy, včetně jejich regulace, je nutno blíže vysvětlit.
Regulace koncentrace receptoru pro LDL na membráně hepatocytu
Za fyziologického stavu je nabídka cholesterolu (daná syntézou v játrech a příjmem v potravě) v rovnováze s jeho utilizací ve tkáních a s jeho odpadem do stolice. Játra produkují lipoproteiny typu VLDL. Postupným snižováním koncentrace triglyceridů se tyto lipoproteiny přeměňují na intermediální částice (intermediate‑density lipoprotein, IDL) a dále na LDL. Nespotřebované lipoproteiny – zejména typu LDL, IDL a VLDL, méně již specifické lipoproteiny Lp(a) – jsou zpětně vychytávány z plazmy do jater pomocí hepatálního LDL receptoru. Aterogenní lipoproteiny obsahují, vedle cholesterolu, jeho esterů, triglyceridů a fosfolipidů, jednu molekulu multifunkčního proteinu apoB100 (ev. apoE). Vazba apoB100 s hepatálním re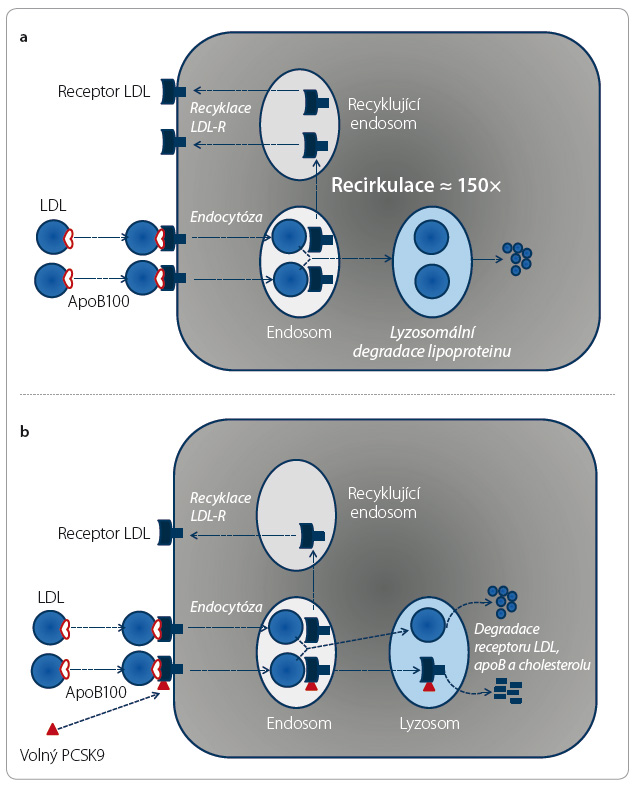 ceptorem umožní internalizaci komplexu lipoprotein/LDL receptor do hepatocytu a zde jeho lyzosomální degradaci. Rozhodujícím podnětem pro spuštění pochodu je vazba apoB100 na LDL receptoru. Obdobně je zprostředkována internalizace lipoproteinů IDL a VLDL pomocí apolipoproteinu E.
ceptorem umožní internalizaci komplexu lipoprotein/LDL receptor do hepatocytu a zde jeho lyzosomální degradaci. Rozhodujícím podnětem pro spuštění pochodu je vazba apoB100 na LDL receptoru. Obdobně je zprostředkována internalizace lipoproteinů IDL a VLDL pomocí apolipoproteinu E.
Katabolismus lipoproteinu v cílové buňce vede k uvolnění cholesterolu a jeho esterů pro další využití. Receptor LDL je proto přítomen zejména ve tkáních s vysokou spotřebou cholesterolu, např. pro syntézu steroidních hormonů (kůra nadledvin, corpus luteum či testes) na straně jedné, dále pak v játrech, kde jsou zbytky lipoproteinů (remnants) či nadbytečný LDL vychytávány.
Koncentrace LDL receptoru na membráně je jedním z klíčových momentů zásobování tkání cholesterolem i zpětné  absorpce „přebytečného materiálu“ v játrech. Vedle sekrece lipoproteinů játry je plazmatická koncentrace aterogenních lipidů účinně kontrolována též reabsorpcí. Syntéza LDL receptoru, stejně jako syntéza cholesterolu (aktivací HMG‑CoA‑syntázy a reduktázy), je při nedostatku cholesterolu ve tkáních reaktivována transkripčním faktorem SREBP‑2 (sterol‑regulatory element‑binding protein). Naopak degradace LDL receptoru je pod kontrolou izoenzymu PCSK9 [7].
absorpce „přebytečného materiálu“ v játrech. Vedle sekrece lipoproteinů játry je plazmatická koncentrace aterogenních lipidů účinně kontrolována též reabsorpcí. Syntéza LDL receptoru, stejně jako syntéza cholesterolu (aktivací HMG‑CoA‑syntázy a reduktázy), je při nedostatku cholesterolu ve tkáních reaktivována transkripčním faktorem SREBP‑2 (sterol‑regulatory element‑binding protein). Naopak degradace LDL receptoru je pod kontrolou izoenzymu PCSK9 [7].
Jak LDL receptor, tak apoB100 mohou být degradovány spolu s LDL či mohou recyklovat. Konkrétně LDL receptor recirkuluje více než stokrát, tj. jedna molekula receptoru umožní degradaci více než 100 molekul lipoproteinu. Pokynem k lyzosomální proteolýze receptoru LDL je vazba PCSK9 na receptor (obr. 2a, b). Izoenzym PCSK9 je tak signálem pro ukončení recyklace, tedy jaký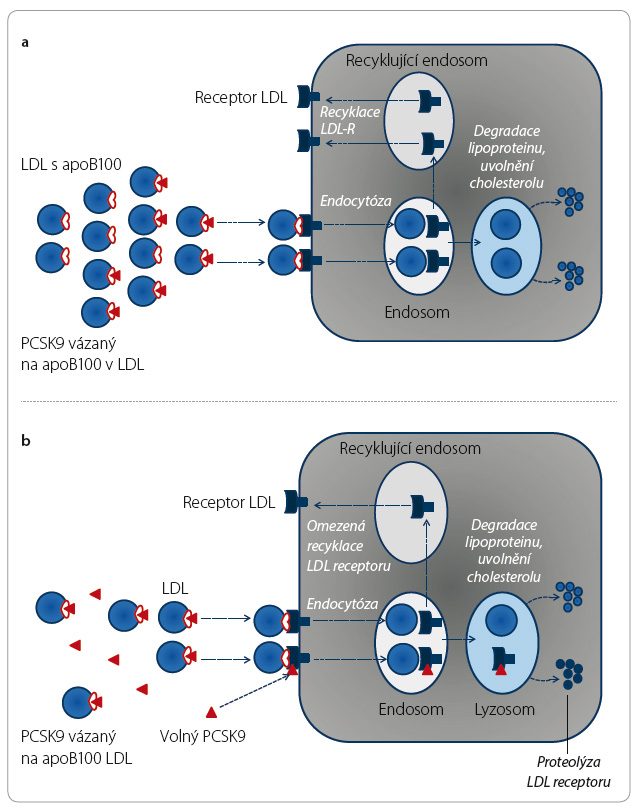 msi „polibkem smrti“ (obr. 3).
msi „polibkem smrti“ (obr. 3).
Koncentrace částic LDL v plazmě aktivně kontroluje nabídku volného PCSK9 pro vazbu na receptor. Volný izoenzym PCSK9 je převážně vázán na apoB100 a jen část je volná a schopná vazby na LDL receptor. Při nadbytku lipoproteinu v plazmě tak vazebné receptory nejsou degradovány a recirkulují (obr. 4a, b). Při poklesu koncentrace LDL je vázáno méně konvertázy PCSK9 a část je volná pro vazbu na LDL receptor. Lyzosomální degradací receptoru jeho nabídka na membráně klesá a koncentrace LDL opět stoupne. Touto „autoregulací“ je udržována koncentrace LDL, resp. cholesterolu v nich obsaženého, tedy LDL cholesterolu, v relativně úzkém rozmezí.
Regulace nabídky apoB100 v hepatocytu pro syntézu aterogenních lipoproteinů
Souběžně s regulací osazení buněčných membrán receptorem LDL kontroluje izoenzym PCSK9 též recyklaci apoB100 [8]. Zde však je situace opačná – vazba PCSK9 s apoB100 vede naopak k zabránění degradaci apolipoproteinu a ten je schopen další recirkulace (obr. 5). Díky „polibku života“ se tak zvyšuje nabídka apoB100 pro syntézu VLDL v játrech.
Další aspekty působení PCSK9 na lipidový metabolismus
Bez nadsázky se dá říci, že aktivita PCSK9 na úrovni metabolismu lipidů je pleiotropní. Vedle ovlivnění degradace LDL receptoru a apoB100 je stimulována řada transkripčních faktorů a „lipogenních“ genů. Výsledkem je např. zvýšení postprandiální koncentrace triglyceridů [9]. Pro inhibici PCSK9 se tak rýsuje další terapeutický cíl.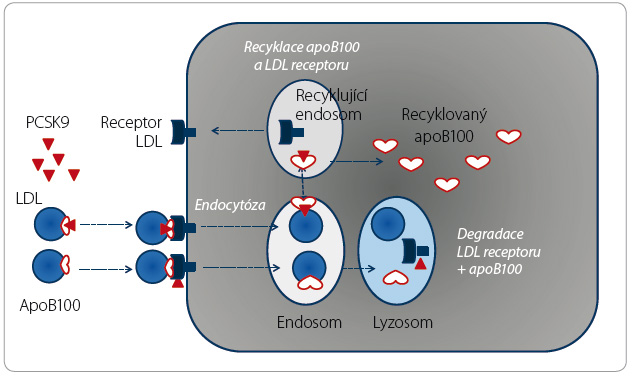
Mechanismus, jakým je redukována koncentrace aterogenního a trombogenního Lp(a), není objasněn, jeho internalizace pomocí LDL receptoru je menší a nevysvětluje významný pokles hodnot Lp(a).
V metabolismu HDL (high density lipoprotein, lipoproteiny o vysoké hustotě) se uplatňuje zejména aktivace endoteliální a lipoproteinové lipázy, jejichž aktivitu kontrolují ostatní proproteinové konvertázy, zejména PCSK4, PCSK5 a PCSK6 [10]. To vysvětluje relativně malý účinek inhibice PCSK9 na koncentraci HDL a na obsah cholesterolu v HDL (HDL cholesterol).
Místo inhibitorů PCSK9 v léčbě aterogenní dyslipidemie
Aterogenní lipoproteiny jsou hlavním rizikovým faktorem vzniku aterotrombotických příhod. Jejich význam je rozhodující při vývoji aterosklerotické léze – od endoteliální dysfunkce přes tukové proužky a vývoj vlastního plátu až po destabilizaci plátu rupturou. Po funkční stránce LDL negativně ovlivňuje jak motilitu cévní stěny, tak reparační procesy a hemostázu. Výsledkem je vazospastická pohotovost a zvýšené riziko trombotické okluze v místě nestabilní léze. Léčebné zásahy směřující ke snížení koncentrace aterogenních lipoproteinů jsou tak v popředí zájmu.
Možností ovlivnit hodnoty cholesterolu v LDL je řada. Můžeme snížit příjem cholesterolu v potravě, můžeme omezit 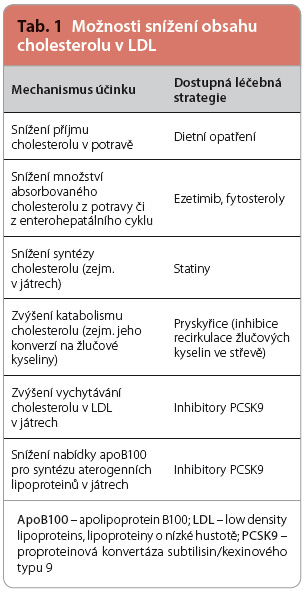 absorpci cholesterolu z potravy a cholesterolu kolujícího v enterohepatálním cyklu, můžeme snížit syntézu cholesterolu v játrech, či naopak zvýšit jeho katabolismus (například jeho přeměnou na žlučové kyseliny). Poslední, aktuálně dostupnou možností je zvýšení reabsorpce LDL částic do jater nebo snížení nabídky apoB100 k syntéze aterogenních lipidů (tab. 1). V praxi zpravidla jednotlivé postupy kombinujeme, nejčastější strategií jsou dietní opatření v kombinaci se statiny, event. s doplněním léčby o ezetimib. Nově se nabízí možnost stimulace reabsorpce LDL v játrech inhibitory PCSK9, a to jak samostatně (při intoleranci jiných postupů), tak zpravidla v kombinaci.
absorpci cholesterolu z potravy a cholesterolu kolujícího v enterohepatálním cyklu, můžeme snížit syntézu cholesterolu v játrech, či naopak zvýšit jeho katabolismus (například jeho přeměnou na žlučové kyseliny). Poslední, aktuálně dostupnou možností je zvýšení reabsorpce LDL částic do jater nebo snížení nabídky apoB100 k syntéze aterogenních lipidů (tab. 1). V praxi zpravidla jednotlivé postupy kombinujeme, nejčastější strategií jsou dietní opatření v kombinaci se statiny, event. s doplněním léčby o ezetimib. Nově se nabízí možnost stimulace reabsorpce LDL v játrech inhibitory PCSK9, a to jak samostatně (při intoleranci jiných postupů), tak zpravidla v kombinaci.
Myšlenka inhibice izoenzymu PCSK9 k léčbě dyslipidemie s vysokou koncentrací LDL cholesterolu byla motivována zjištěním, že mutace ovlivňující aktivitu genu pro PCSK9 mají dopad na koncentraci LDL cholesterolu, resp. na výskyt aterotrombotických příhod. V roce 2003 bylo doloženo, že změny aktivity genu pro PCSK9 typu „gain‑of‑function“ jsou příčinou familiární hypercholesterolemie [11]. Mutace genu PCSK9 je tak, vedle missense mutací genů kontrolujících LDL receptory a apoB100, třetí příčinou tohoto typu hypercholesterolemie. Naopak mutace typu „loss‑of‑function“ s poklesem hodnot PCSK9 byly provázeny nízkými koncentracemi LDL cholesterolu a rezistencí k aterogenezi [12].
Vztah mezi hodnotou PCSK9 a kardiovaskulární morbiditou/mortalitou byl d![Graf 1 Výskyt aterotrombotických příhod v závislosti na hodnotě PCSK9. V nejvyšším tercilu PCSK9 bylo o více než 50 % z celkového počtu příhod více než v tercilu nejnižším; podle [13] – Werner, et al., 2014. HR – hazard ratio, poměr rizik; IC – confindence interval, interval spolehlivosti; PCSK9 – proproteinová konvertáza subtilisin/kexinového typu 9](https://www.remedia.cz/photo-a-30573---.jpg) oložen i v prognostické studii trvající čtyři roky [13]. Nemocní v nejvyšším tercilu hodnot PCSK9 měli o více než 50 % zvýšené riziko vzniku příhody ve srovnání s nemocnými v tercilu nejnižším (hazard ratio, poměr rizik – HR: 1,55; confidence interval, interval spolehlivosti – 95% CI: 1,11–2,16; p = 0,009), viz graf 1. Nicméně od prvých zjištění o vztahu mezi PCSK9 a koncentrací LDL cholesterolu trvalo dvacet let, než bylo doloženo, že inhibice PCSK9 monoklonálními protilátkami sníží nejen koncentraci LDL cholesterolu, ale zlepší i prognózu léčených.
oložen i v prognostické studii trvající čtyři roky [13]. Nemocní v nejvyšším tercilu hodnot PCSK9 měli o více než 50 % zvýšené riziko vzniku příhody ve srovnání s nemocnými v tercilu nejnižším (hazard ratio, poměr rizik – HR: 1,55; confidence interval, interval spolehlivosti – 95% CI: 1,11–2,16; p = 0,009), viz graf 1. Nicméně od prvých zjištění o vztahu mezi PCSK9 a koncentrací LDL cholesterolu trvalo dvacet let, než bylo doloženo, že inhibice PCSK9 monoklonálními protilátkami sníží nejen koncentraci LDL cholesterolu, ale zlepší i prognózu léčených.
Možností inhibice PCSK9 je více, podle mechanismu účinku je lze rozdělit do dvou typů: inhibice syntézy PCSK9 a blokáda funkce PCSK9 (obr. 6). V časných fázích klinického hodnocení je interferující RNA (siRNA, small interfering RNA) s kódovým označením ALN‑PCS. Interferující RNA inhibuje syntézu proteinu, v tomto případě izoenzymu PCSK9. Ve studii 1. fáze hodnocení byl doložen pokles koncentrace HDL cholesterolu o 40 % a cirkulujícího PCSK9 o 70 % [14]. Další látka s kódovým označením K‑312 na bázi inhibitoru CETP (cholesteryl ester transfer protein), která potlačuje též hepatální expresi PCSK9, nyní rovněž prochází časnými fázemi hodnocení [15].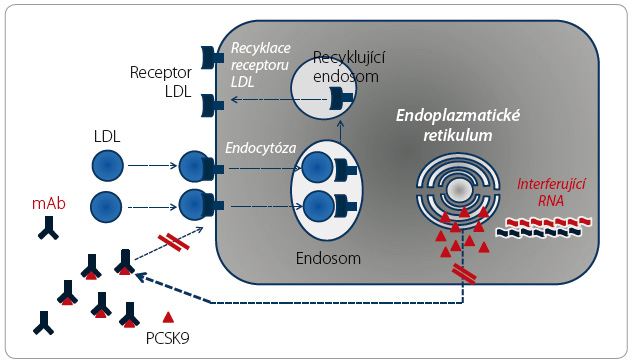
Blokádu vazby izoenzymu PCSK9 na substrát (LDL receptor či apoB100) lze docílit dvojím způsobem – podáním specifických monoklonálních protilátek či klasickými „mikromolekulárními“ léčivy. Dvě léčiva na bázi plně humánních monoklonálních protilátek – alirocumab a evolocumab – jsou již schválena ke klinickému užití a v době odevzdání článku jsou v České republice ve fázi schvalování podmínek úhrady. Doložen byl nejen příznivý účinek léčby na snížení koncentrace LDL cholesterolu o více než polovinu, ale i významné zlepšení prognózy během řádově ročního podávání (studie řady ODYSSEY s alirocumabem a OSLER s evolocumabem). Zda se potvrdí účinnost (pokles kardiovaskulární mortality a morbidity o více než 50 %) i výborná tolerance a bezpečnost léčby i při dlouhodobém podávání, bude zřejmé po dokončení probíhajících studií s oběma přípravky.
Z ostatních monoklonálních protilátek je v poslední fázi hodnocení humanizovaná monoklonální protilátka bococizumab (studie řady SPIRE). Řada dalších monoklonálních protilátek se nachází v časných fázích hodnocení [16,17]. Obdobně je prověřován účinek malých molekul, tedy klasických chemických látek. Některé, např. adnectin, jsou v časných fázích klinického hodnocení, u jiných probíhá preklinické testování [16].
Srovnáme‑li potenciál monoklonálních protilátek a klasických molekul, pak významným rozdílem je nutnost parenterální aplikace u protilátek. Podle vlastních zkušeností s řadou nemocných léčených v rámci klinického hodnocení jsem přesvědčen, že subkutánní podávání s frekvencí jednou až dvakrát za měsíc bude spíše výhodou. Obava, že tato aplikační forma bude nemocným na obtíž, byla planá. Výhodou je dobrá tolerance a zvýšená spolupráce nemocných. Na straně druhé je pravděpodobné, že nižší náklady na výrobu klasických léčiv (chemických látek) povedou ke snížení ceny léčiv, která představuje hlavní handicap většího rozvoje této léčebné strategie.
Velmi důležitá je otázka deplece cholesterolu v buňkách s jeho vyšší spotřebou. Nebude výrazné snížení plazmatické koncentrace LDL cholesterolu po inhibici PCSK9 provázeno nedostatečným přísunem cholesterolu do „cholesterol‑dependentních“ tkání? Zdá se, že nikoliv. Receptory pro LDL jsou přítomny nejen na povrchu hepatocytu, ale též na povrchu buněk ostatních tkání. Jejich exprese je regulována jeho intracelulární nabídkou, pokles koncentrace expresi LDL receptoru stimuluje. Je pravděpodobné, že inhibice PCSK9 zabrání degradaci LDL receptoru i v buňkách non‑hepatálních tkání. Zvýšená koncentrace receptoru na buněčné membráně stimuluje internalizaci LDL do buňky a výsledná intracelulární koncentrace cholesterolu se nemusí snížit. Je to zcela jiná situace, než jakou představuje léčba statiny. Deplece cholesterolu v hepatocytu (po snížení jeho syntézy při léčbě statiny) vede ke zvýšení plazmatické koncentrace izoenzymu PCSK9 [18]. Vyšší nabídka PCSK9 vede k degradaci LDL receptoru, a intracelulární přesun cholesterolu tak vázne.
Poslední část článku by měla být věnována cílovým skupinám nemocných, pro které je vhodná léčba inhibitory PCSK9. Dá se předpokládat, že v nejbližších letech se léčba vysoké koncentrace LDL cholesterolu bude nadále řídit současnou strategií, kdy zásadní roli hrají dietní opatření a změna životosprávy a při jejich nedostatečném účinku je indikována farmakoterapie založená na statinech a případně na ezetimibu. U řady nemocných však tato léčba nestačí a bude vhodná nová strategie.
V první řadě bude nová léčebná strategie přínosem pro osoby s familiární hypercholesterolemií. Počet těchto nemocných s významně akcelerovanou aterogenezí je v populaci vysoký a ukazuje se, že frekvence choroby se pohybuje kolem 1 : 200. Část heterozygotních nemocných, kteří dostatečně neodpovídají na stávající hypolipidemickou léčbu, bude jistě vhodnou skupinou k léčbě inhibitory PCSK9. Homozygotní forma nemoci je sice vzácná, avšak i zde byl doložen účinek, byť pokles koncentrace LDL cholesterolu byl méně výrazný.
Druhou skupinou budou jistě nemocní se závažnou dyslipidemií (s dominující hypercholesterolemií) a s vysokým kardiovaskulárním rizikem, kteří netolerují statiny a léčba ezetimibem u nich nevede k dostatečnému snížení koncentrace LDL cholesterolu. Řada autorů uvádí, že počet pacientů s intolerancí statinů dosahuje kolem 10–15 %, toto číslo je výrazně nadhodnocené. Volba optimální dávky, optimálního statinu, vyloučení léků i potravin interferujících s transportem a s metabolismem statinů a dobrá spolupráce lékaře s nemocným toto procento zásadně sníží. Obdobnou skupinou jsou pacienti, u kterých úprava životosprávy v kombinaci s farmakoterapií nestačí k dostatečnému snížení kardiovaskulárního rizika. I zde je nutno spatřovat potenciál pro podávání této slibné skupiny hypolipidemik. Účinnost v ostatních stavech, například při přítomnosti dyslipidemie s vysokou hodnotou Lp(a), bude nutno prověřit.
Obrázky v článku: archiv autora.
Tato práce byla podpořena projektem PRVOUK – P35.
Seznam použité literatury
- [1] Seidah NG, Chrétien M, Day R. The family of subtilisin/kexin like pro protein and pro hormone convertases: divergent or shared functions. Biochimie 1994; 76: 197–209.
- [2] Turpeinen H, Ortutay Z, Pesu M. Genetics of the first seven proprotein convertase enzymes in health and disease. Curr Genomics 2013; 14: 453–467.
- [3] Chen S, Cao P, Dong N, et al. PCSK6 mediated corin activation is essential for normal blood pressure. Nat Med 2015; 21: 1048–1053.
- [4] Scamuffa N, Calvo F, Chrétien M, et al. Proprotein convertases: lessons from knockouts. FASEB J 2006; 20: 1954–1963.
- [5] Artenstein AW, Opal SM. Proprotein convertases in health and disease. N Engl J Med 2011; 365: 2507–2518.
- [6] http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/ Drugs/EndocrinologicandMetabolicDrugsAdvisoryCommittee/UCM450072.pdf
- [7] Lagace TA. PCSK9 and LDLR degradation: regulatory mechanisms in circulation and in cells. Curr Opin Lipidol 2014; 25: 387–393.
- [8] Sun H, Samarghandi A, Zhang N, et al. Proprotein Convertase Subtilisin/Kexin Type 9 Interacts With Apolipoprotein B and Prevents Its Intracellular Degradation, Irrespective of the Low Density Lipoprotein Receptor. Arterioscler Thromb Vasc Biol 2012; 32: 1585–1595.
- [9] Rashid S, Tavori H, Brown PE, et al. PCSK9 Promotes Intestinal Overproduction of Triglyceride Rich Apolipoprotein B Lipoproteins Through Both LDL Receptor Dependent and Independent Mechanisms. Circulation 2014; 130: 431–441.
- [10] Choi S, Korstanje R. Proprotein convertases in highdensity lipoprotein metabolism. Biomarker Research 2013; 27: 1–8.
- [11] Abifadel M, Varret M, Rabes JP, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet 2003; 34: 154–156.
- [12] Cohen JC, Boerwinkle E, Mosley TH, Hobbs HH. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N Engl J Med 2006; 354: 1264–1272.
- [13] Werner C, Hoffmann MM, Winklerb K, et al. Risk prediction with proprotein convertase subtilisin/kexin type 9 (PCSK9) in patients with stable coronary disease on statin treatment. Vascular Pharmacology 2014; 62: 94–102.
- [14] Fitzgerald K, Frank Kamenetsky M, Shulga Morskaya S. Effect of an RNA interference drug on the synthesis of proprotein convertase subtilisin/kexin type 9 (PCSK9) and the concentration of serum LDL cholesterol in healthy volunteers: a randomised, single blind, placebo controlled, phase 1 trial. Lancet 2014; 383: 60–68.
- [15] Miyosawa K, Watanabe Y, Murakami K, et al. New CETP inhibitor K 312 reduces PCSK9 expression: a potential effect on LDL cholesterol metabolism. Am J Physiol Endocrinol Metab 2015; 309: E177–190.
- [16] Dorey E. PCSK9 inhibitors: the next cholesterol lowering blockbusters? Pharmaceutical Journal 2015; 294: No 7858, online DOI: 10.1211/PJ.2015.20068181.
- [17] Seidah NG, Prat A. The biology and therapeutic targeting of the proprotein convertases. Nat Rev Drug Discov 2012; 11: 367–383.
- [18] Nozue T, Hattori H, Ogawa K, et al. Effects of Statin Therapy on Plasma Proprotein Convertase Subtilisin/kexin Type 9 and Sortilin Levels in Statin Naive Patients with Coronary Artery Disease. J Atheroscler Thromb 2016 Jan 21.