ZAOSTŘENO Asciminib
OBSAH
Asciminib v České republice aneb Účinná odpověď na výzvy v léčbě chronické myeloidní leukemie
Vážené a milé čtenářky, vážení a milí čtenáři,
 do rukou se vám dostává materiál Zaostřeno věnovaný moderní léčbě pacientů s chronickou myeloidní leukemií (CML), tedy s chorobou, která může díky již téměř 25 let zavedené účinné terapii cílené na patogenetickou podstatu onemocnění zdánlivě budit dojem vyřešené záležitosti. Jak jinak totiž označit situaci, kdy je díky léčbě inhibitory tyrozinkináz (TKI) očekávaná délka života pacientů s CML prakticky srovnatelná s délkou života příslušníků celkové populace a kdy i životní náplň ve smyslu pracovního zařazení, rodinného života i volnočasových aktivit není významně odlišná. Na evropském trhu je navíc k dispozici hned několik zástupců TKI, z nichž je možno vybírat tak, aby byla v rámci individualizovaného přístupu léčba co nejúčinnější a současně i co nejlépe snášená s ohledem na rizikové faktory a přidružená onemocnění a specifický profil nežádoucích účinků jednotlivých přípravků.
do rukou se vám dostává materiál Zaostřeno věnovaný moderní léčbě pacientů s chronickou myeloidní leukemií (CML), tedy s chorobou, která může díky již téměř 25 let zavedené účinné terapii cílené na patogenetickou podstatu onemocnění zdánlivě budit dojem vyřešené záležitosti. Jak jinak totiž označit situaci, kdy je díky léčbě inhibitory tyrozinkináz (TKI) očekávaná délka života pacientů s CML prakticky srovnatelná s délkou života příslušníků celkové populace a kdy i životní náplň ve smyslu pracovního zařazení, rodinného života i volnočasových aktivit není významně odlišná. Na evropském trhu je navíc k dispozici hned několik zástupců TKI, z nichž je možno vybírat tak, aby byla v rámci individualizovaného přístupu léčba co nejúčinnější a současně i co nejlépe snášená s ohledem na rizikové faktory a přidružená onemocnění a specifický profil nežádoucích účinků jednotlivých přípravků.
Nejdéle používaným zástupcem z řady TKI, který byl prvním cíleným protinádorovým lékem a do té doby i nejrychleji uvedeným přípravkem pro léčbu nádorů do klinické praxe, je imatinib, který působí mechanismem ATP‑kompetitivní inhibice kinázy BCR::ABL1, jež svojí konstitutivní aktivací zodpovídá za patogenezi onemocnění. Zejména z důvodu absence či ztráty účinnosti imatinibu u zhruba 20–30 % jím léčených pacientů byly postupně vyvinuty a do klinické praxe uvedeny ještě účinnější přípravky vyšších generací. Zatímco nilotinib, dasatinib, bosutinib a ponatinib působí na leukemické buňky analogickým způsobem jako imatinib, poslední v řadě dostupných TKI – asciminib – se odlišuje mechanismem účinku, kdy po vazbě do tzv. myristoylové kapsy vyřazuje cílovou kinázu z funkce alosterickou inhibicí. Kromě předpokladu účinnosti i v případě mutací kinázy BCR::ABL1, které zabraňují působení ATP‑kompetitivních inhibitorů, je významným odlišujícím rysem rovněž selektivita jeho účinku, resp. působení jen na kinázu ABL1, a nikoliv na řadu dalších mimocílových kináz.
Čím je ale motivována potřeba inovativních léků pro pacienty s CML, jejichž vyhlídky se zdají být velmi příznivé? Faktorů je hned několik. Jednak je to zmíněná rezistence na dosud užívaný přípravek, dále pak toxicita léků, kdy některé z nežádoucích účinků TKI vyšších generací mohou mít závažný až život ohrožující charakter. Ale i co do intenzity mírné projevy intolerance TKI zhoršují kvalitu života pacientů a mohou negativně ovlivnit adherenci k léčbě s nepříznivými implikacemi na její účinnost. V neposlední řadě je žádoucí, aby co nejvíce pacientů dosáhlo setrvalé hluboké molekulární odpovědi a mohli ideálně léčbu zcela vysadit a tím rizika jejího dlouhodobého užívání spolehlivě eliminovat, což se v současné době daří jen u menšiny nemocných léčených tradičními ATP‑kompetitivními TKI.
Asciminib je již zavedenou terapií v případě selhání či nesnášenlivosti alespoň dvou předchozích TKI a v této indikaci je dostupný i pro pacienty v České republice. Nutnost žádat o schválení úhrady příslušnou zdravotní pojišťovnu je sice přitěžujícím faktorem, ale z přibývajících případů vyplývá, že čeští specialisté administrativní překážku rádi překonají, aby získali pro své pacienty co nejoptimálnější léčebnou alternativu. Současně narůstá cenná klinická zkušenost s účinným lékem a každé její sdílení je vítaným příspěvkem k obohacení odborných znalostí.
Je mým velkým potěšením uvést hned čtyři případy pacientů, jimž byl podán asciminib v pokročilých liniích léčby, za mnohdy nepříznivé situace přítomnosti přidružených onemocnění či nakumulované toxicity předcházející terapie. Pevně věřím, milí čtenáři, že vás prezentované případy zaujmou a jejich barvitost spolu s téměř až detektivním laděním vás přesvědčí o skutečnosti, že CML není v žádném případě vyřešeným či snad nudným onemocněním, ale naopak, že v terénu modelu úspěšné protinádorové terapie stále nacházíme mnoho dalších výzev k řešení.
Doc. MUDr. Daniela Žáčková, Ph.D.
Úspěšná a dobře tolerovaná terapie asciminibem u pacienta s chronickou fází CML a se zhoršující se ICHDK v rámci čtvrté linie léčby
Souhrn
Černá O. Úspěšná a dobře tolerovaná terapie asciminibem u pacienta s chronickou fází CML a se zhoršující se ICHDK v rámci čtvrté linie léčby.
Asciminib je nová léčebná modalita pro pacienty s chronickou fází chronické myeloidní leukemie (CML), u kterých došlo k selhání již minimálně dvou linií léčby. Jedná se o první alosterický inhibitor aktivity kinázy BCR::ABL1. Její aktivita je tak tlumena specifickým působením na ABL1 myristoylovou kapsu (STAMP), kde inhibuje působení ABL, která chybí u CML vlivem fúze s BCR. Asciminib působí jen na kinázu ABL1. Má vysokou specifičnost a účinnost i v případě mutací v kinázové doméně, kde léčba ostatními tyrozinkinázovými inhibitory není účinná. Bezpečnostní profil asciminibu je velmi dobrý, toto bylo ověřeno v registrační klinické studii fáze III ASCEMBL. Klíčová slova: chronická myeloidní leukemie – asciminib – studie ASCEMBL – ischemická choroba dolních končetin.
Summary
Cerna O. Successful and well tolerated fourth‑line asciminib therapy in a patient with chronic phase CML and worsening ischemic lower limb disease.
Asciminib is a new treatment modality for patients with the chronic phase of chronic myeloid leukemia (CML) who have already received at least two lines of treatment. It is the first allosteric inhibitor of BCR::ABL1 kinase activity. Its activity is thus dampened by a specific action on the ABL1 myristoyl pocket, where it inhibits the action of ABL, which is absent in CML‑ABL due to the fusion with BCR. Asciminib acts only on the ABL1 kinase. It has high specificity and effectiveness even in the case of mutations in the kinase domain, where treatment with other tyrosine kinase inhibitors is not effective. The safety profile of asciminib is very good, this was verified in the phase III registration clinical trial, ASCEMBL. Key words: chronic myeloid leukemia – asciminib – ASCEMBL trial – ischemic lower limb disease.
Úvod
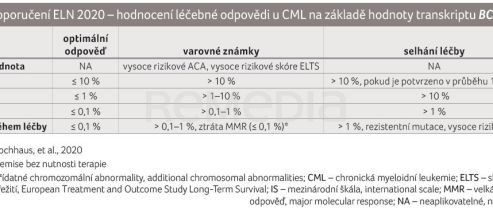
Chronická myeloidní leukemie (CML) je nádorové myeloproliferativní onemocnění. Podstatou je reciproká translokace části ramének mezi chromozomy 9 a 22 a vznik tzv. filadelfského (Ph) chromozomu. Pří této translokaci dochází k vytvoření fúzního genu BCR‑ABL1, kdy se setkají gen ABL1 z chromozomu 9 a BCR z chromozomu 22 a splynou. Fúzní gen BCR‑ABL1 kóduje vznik patologicky aktivované tyrozinkinázy BCR::ABL1 (protein p120), která způsobuje nekontrolovanou proliferaci krvetvorných buněk a snížení proapoptotické schopnosti [1]. Léčba CML zaznamenala v posledních 20 letech výrazné zlepšení a velmi příznivě ovlivnila prognózu pacientů právě díky vývoji molekulární biologie a zavedením cílené protinádorové léčby prvním tyrozinkinázovým inhibitorem (TKI) – imatinibem. Záhy následovalo zavedení dalších TKI druhé a třetí linie – nilotinibu, dasatinibu, bosutinibu, ponatinibu. Všechny tyto TKI mají vazbu na tyrozinkinázu BCR::ABL1 v oblasti, která váže adenosintrifosfát (ATP), a inhibují její fosforylaci. Terapie prostřednictvím TKI se stala léčebným standardem. Díky ní je očekávané dožití pacientů s chronickou fází CML téměř srovnatelné se standardní populací. V léčbě vycházíme z doporučení European LeukemiaNet (ELN) z roku 2020 (tab. 1) [2].
 Úprava těchto doporučení se v letošním roce koncipuje především s ohledem na kvalitu života pacientů. Terapie TKI je dlouhodobá, resp. i trvalá a řada pacientů má více či méně vyjádřené nežádoucí účinky spojené s léčbou, které mohou být obtěžující, ačkoliv ještě nejsou důvodem ke změně terapie. Zvažuje se tedy ev. také redukce terapeutické dávky, intermitentní užívání, to vše dle aktivity onemocnění. Snahou je vysazení léčby s cílem dosažení remise onemocnění bez terapie. Byla a je koncipována celá řada studií zaměřených na možnost vysazování TKI v první i dalších liniích této léčby.
Úprava těchto doporučení se v letošním roce koncipuje především s ohledem na kvalitu života pacientů. Terapie TKI je dlouhodobá, resp. i trvalá a řada pacientů má více či méně vyjádřené nežádoucí účinky spojené s léčbou, které mohou být obtěžující, ačkoliv ještě nejsou důvodem ke změně terapie. Zvažuje se tedy ev. také redukce terapeutické dávky, intermitentní užívání, to vše dle aktivity onemocnění. Snahou je vysazení léčby s cílem dosažení remise onemocnění bez terapie. Byla a je koncipována celá řada studií zaměřených na možnost vysazování TKI v první i dalších liniích této léčby.
U 20–30 % pacientů selhává léčebná odpověď na terapii TKI, a to buď vlivem rezistence na základě vzniku mutací v kinázové doméně BCR::ABL1, nebo vlivem intolerance léčby [3]. Tyto překážky může překonat nová léčebná možnost v podobě asciminibu, jehož působení je odlišné.
![OBR. 1A–C Konstitutivně aktivní kináza BCR::ABL1 a její inhibice asciminibem; podle [4] – Réa, Hughes, 2022.](https://www.remedia.cz/photo-pg-1566---.jpg) Jedná se o první alosterický inhibitor aktivity kinázy BCR::ABL1. Její aktivita je tlumena specifickým působením na ABL1 myristoylovou kapsu (Specifically Targeting the ABL Myristoyl Pocket, STAMP), kde inhibuje působení ABL, které chybí u CML vlivem fúze s BCR. Asciminib působí jen na kinázu ABL1. Má vysokou specifičnost a účinnost i v případě mutací v kinázové doméně, kde léčba ostatními TKI není efektivní (obr. 1) [4]. Bezpečnostní profil asciminibu je velmi dobrý, toto bylo ověřeno v registrační klinické studii fáze III ASCEMBL (obr. 2) [5,6].
Jedná se o první alosterický inhibitor aktivity kinázy BCR::ABL1. Její aktivita je tlumena specifickým působením na ABL1 myristoylovou kapsu (Specifically Targeting the ABL Myristoyl Pocket, STAMP), kde inhibuje působení ABL, které chybí u CML vlivem fúze s BCR. Asciminib působí jen na kinázu ABL1. Má vysokou specifičnost a účinnost i v případě mutací v kinázové doméně, kde léčba ostatními TKI není efektivní (obr. 1) [4]. Bezpečnostní profil asciminibu je velmi dobrý, toto bylo ověřeno v registrační klinické studii fáze III ASCEMBL (obr. 2) [5,6].
![OBR. 2 Uspořádání studie ASCEMBL; podle [5,6] – Patel, et al., 2017; Réa, et al., 2021.](https://www.remedia.cz/photo-pg-1565---.jpg) Tento perorální přípravek je velmi dobře snášen, užívá se v dávce 2× 40 mg denně, či se dávka modifikuje dle nežádoucích účinků (např. cytopenie). Tablety se musejí polykat celé a bez konzumace jídla dvě hodiny před užitím léku a jednu hodinu po něm.
Tento perorální přípravek je velmi dobře snášen, užívá se v dávce 2× 40 mg denně, či se dávka modifikuje dle nežádoucích účinků (např. cytopenie). Tablety se musejí polykat celé a bez konzumace jídla dvě hodiny před užitím léku a jednu hodinu po něm.
Dle Souhrnu údajů o přípravku má asciminib indikaci pro léčbu dospělé populace s chronickou fází CML po selhání minimálně dvou předchozích linií léčby. Přípravek dosud nemá úhradu ze zdravotního pojištění, je tedy nutné schválení úhrady revizním lékařem dle § 16 [7].
Popis případu
U dvaašedesátiletého pacienta byla CML v chronické fázi diagnostikována v červenci 2010 v jeho 51 letech. Podle relativní rizikové stratifikace na základě skóre Sokal, EUTOS a ELTS (European Treatment and Outcome Study [EUTOS] Long‑Term Survival) se jednalo o onemocnění nízce rizikové, klinicky asymptomatické, náhodně zjištěné, bez splenomegalie.
Pacient byl bez komorbidit, bez zátěže v rodinné anamnéze, bez metabolického syndromu, bez obezity. Léčí se jen monoterapií pro hypertenzi a je chronický kuřák.
V srpnu 2010 jsme zahájili standardní léčbu prvoliniovým TKI imatinibem v dávce 400 mg denně. Dne 5. října 2010 bylo dosaženo kompletní hematologické odpovědi, 30. listopadu 2010 kompletní cytogenetické odpovědi i velké molekulární remise. Terapeutickou odpověď bylo možno hodnotit jako optimální. Tolerance léčby imatinibem však byla velmi problematická. V průběhu terapie se stále výrazně zhoršovaly bolesti kostí a svalů, které pacienta limitovaly v pohybu, a výrazně tak zhoršovaly kvalitu života. Podrobným revmatologickým, neurologickým a cévním vyšetřením byla vyloučena jiná etiologie než v souvislosti s léčbou imatinibem. Pacient byl tedy z důvodu intolerance imatinibu na začátku července 2012 převeden na druhou linii léčby nilotinibem perorálně v dávce 2 tbl. à 200 mg dvakrát denně.
Svalové bolesti až křeče se však i při této terapii stupňovaly, a tak při trvající velké molekulární remisi na úrovni MR 4,5 byla dávka nilotinibu snížena od 2. prosince 2012 na poloviční 2× 200 mg/den. Obtíže přetrvávaly i při další redukci dávky nilotinibu za bedlivé monitorace transkriptu BCR::ABL1 a za stále trvající velké molekulární remise bez přítomnosti mutací v kinázové doméně BCR::ABL1. Pacient byl bez vývoje ischemických komplikací, zajištěn antiagregační terapií. Z důvodu intolerance léčby nilotinibem byla zahájena třetí linie léčby TKI dasatinibem od února 2017. Tato terapie však trvala jen velmi krátce a z důvodu těžké gastrointestinální intolerance byla ukončena.
Byla tedy navrácena ještě výrazněji redukovaná dávka nilotinibu 2× 200 mg/den dvakrát týdně za stále trvající velké molekulární remise na úrovni MR 4,5. V září 2021 byla u pacienta diagnostikována závažná ischemická choroba tepen dolních končetin (ICHDK) a významné stenózy femorálních tepen obou dolních končetin. U nemocného byl proveden cévní femoro‑popliteální bypass. Pro okluzi pravé arteria axillaris byl zaveden stent a byla posílena antiagregační terapie.
Z důvodu těchto cévních komplikací byla léčba nilotinibem v listopadu 2022 zcela ukončena. Pacient byl bez léčby TKI a pečlivě monitorován se stále trvající hlubokou molekulární remisí. Svalové a kostní bolesti se zmírnily a cévní komplikace se dále nezhoršovaly.
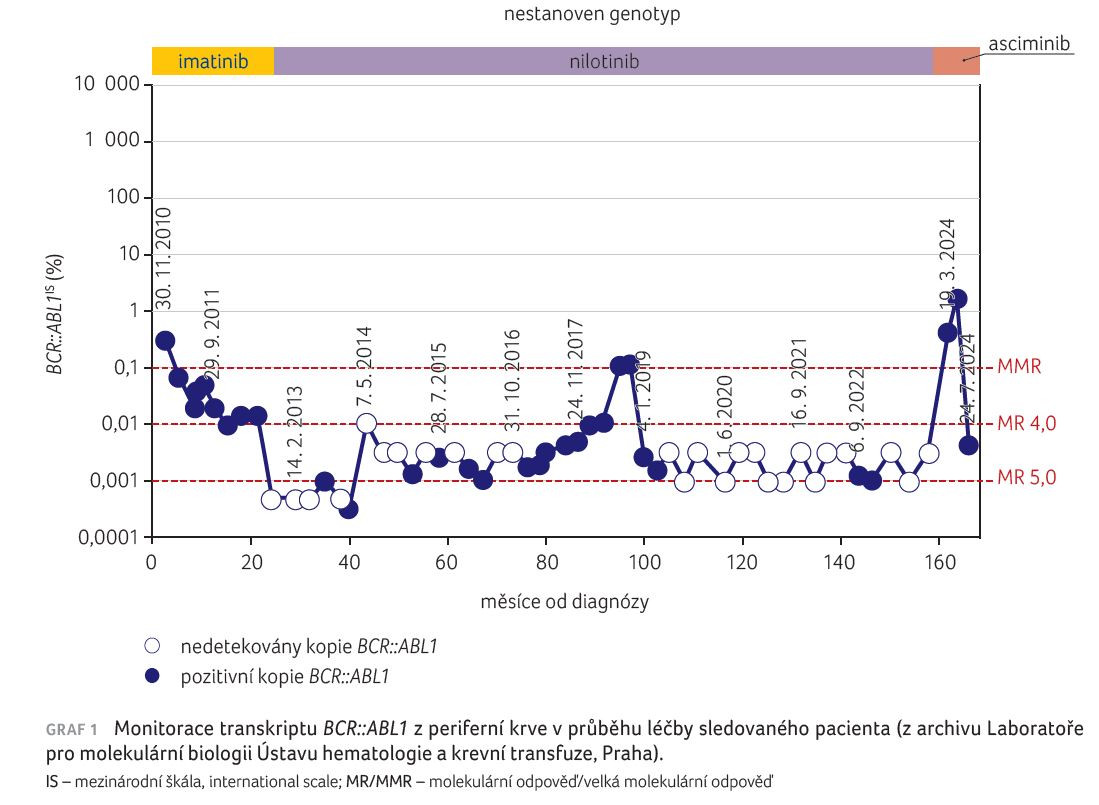 V březnu 2024 došlo k výraznému nárůstu transkriptu BCR::ABL1 (graf 1), ke ztrátě molekulární remise, avšak se stále trvající hematologickou a cytogenetickou remisí, bez průkazu jakýchkoliv mutací v kinázové doméně BCR::ABL1. Indikovali jsme zahájení čtvrté linie léčby nyní již dostupným lékem asciminibem v dávce 2× 40 mg/den. Úhrada léčby byla revizním lékařem zdravotní pojišťovny ihned schválena a terapie byla zahájena 14. května 2024. Pacient léčbu toleroval velmi dobře, neměl žádné nežádoucí účinky, které pozoroval v předchozích léčebných liniích. Byl bez bolestí kostí či svalů, bez zažívacích obtíží, bez vývoje cytopenie i při plném dávkování léku. Ani nehematologická toxicita léčby nebyla zaznamenána a nelimitovala péči. Co je velmi důležité, nezhoršily se ischemické cévní komplikace. Kvalita života pacienta je velmi dobrá, byl a je stále plně pracující. Po třech měsících léčby bylo opět docíleno velké molekulární odpovědi se zcela normálními hodnotami krevního obrazu. Dne 24. července 2024 bylo již znovu dosaženo velké molekulární odpovědi na úrovni MR 4,0. Léčba bez redukce dávky stále úspěšně pokračuje a její úhrada je dále schvalována.
V březnu 2024 došlo k výraznému nárůstu transkriptu BCR::ABL1 (graf 1), ke ztrátě molekulární remise, avšak se stále trvající hematologickou a cytogenetickou remisí, bez průkazu jakýchkoliv mutací v kinázové doméně BCR::ABL1. Indikovali jsme zahájení čtvrté linie léčby nyní již dostupným lékem asciminibem v dávce 2× 40 mg/den. Úhrada léčby byla revizním lékařem zdravotní pojišťovny ihned schválena a terapie byla zahájena 14. května 2024. Pacient léčbu toleroval velmi dobře, neměl žádné nežádoucí účinky, které pozoroval v předchozích léčebných liniích. Byl bez bolestí kostí či svalů, bez zažívacích obtíží, bez vývoje cytopenie i při plném dávkování léku. Ani nehematologická toxicita léčby nebyla zaznamenána a nelimitovala péči. Co je velmi důležité, nezhoršily se ischemické cévní komplikace. Kvalita života pacienta je velmi dobrá, byl a je stále plně pracující. Po třech měsících léčby bylo opět docíleno velké molekulární odpovědi se zcela normálními hodnotami krevního obrazu. Dne 24. července 2024 bylo již znovu dosaženo velké molekulární odpovědi na úrovni MR 4,0. Léčba bez redukce dávky stále úspěšně pokračuje a její úhrada je dále schvalována.
Shrnutí kazuistiky
Kazuistika demonstruje úspěšnou a velmi dobře tolerovanou léčbu čtvrtou linií TKI po předchozí intoleranci imatinibu, nilotinibu a dasatinibu a při vývoji ischemických cévních komplikací (nejspíše při terapii nilotinibem), které byly důvodem ukončení terapie. Při dlouhotrvající hluboké remisi na úrovni MR 4,5 po 11 letech léčby TKI byla terapie vysazena. Po 14 měsících po ukončení terapie TKI, což odpovídá výsledkům klinických studií s vysazováním TKI, však došlo k relapsu onemocnění. S ohledem na předchozí intoleranci terapie TKI a vzhledem ke komorbiditám při nepřítomnosti mutací v kinázové doméně byla indikována dnes již dostupná nová léčebná modalita asciminibem v plné dávce 2× 40 mg/den perorálně. Léčba byla velmi dobře tolerována, zcela bez nežádoucích účinků a bez zhoršení ischemických komplikací. Terapie byla i z hlediska hematologického velmi efektivní, po třech měsících léčby došlo opět k molekulární remisi onemocnění. Terapie je po celou dobu bez hematologické toxicity, bez redukce dávkování, nadále pokračuje a velmi zlepšila kvalitu života pacienta.
Diskuse
Asciminib je indikován pro léčbu dospělé populace s chronickou fází chronické myeloidní leukemie po selhání minimálně dvou předchozích linií léčby. Jedná se o první alosterický inhibitor aktivity kinázy BCR::ABL1. Její aktivita je tlumena specifickým působením na ABL1 myristoylovou kapsu (STAMP), kde inhibuje působení ABL, které chybí u CML vlivem fúze s BCR. Asciminib působí pouze na kinázu ABL1. Má vysokou specifičnost a účinnost i v případě mutací v kinázové doméně [6]. U 20–30 % pacientů léčebná odpověď na terapii tyrozinkinázovými inhibitory selhává, a to buď vlivem rezistence na základě vzniku mutací v kinázové doméně BCR::ABL1, nebo vlivem intolerance léčby. To může překonat nová léčebná možnost v podobě terapie asciminibem, jehož působení je odlišné. Bezpečnostní profil asciminibu je velmi dobrý, toto bylo ověřeno v registrační klinické studii fáze III ASCEMBL [6].
Účinnost a bezpečnost léku potvrzuje také uvedená kazuistika. Lze se domnívat, že v popisovaném případě by možnost dřívějšího využití terapie asciminibem mohla ev. zabránit vývoji ischemických komplikací, které se rozvinuly při léčbě nilotinibem, či je zmírnit, a výrazně tak zlepšit kvalitu života pacienta.
MUDr. Olga Černá
Hematologická klinika 3. LF UK a FN Královské Vinohrady
Ruská 87, 100 00 Praha 10
e‑mail: olga.cerna@vfn.cz
Literatura
[1] Hirji I, Gupta S, Goren A, et al. Chronic myeloid leukemia (CML): association of treatment satisfaction, negative medication experience and treatment restrictions with health outcomes, from the patient's perspective. Health Qual Life Outcomes 2013; 11: 167.
[2] Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020; 34: 966–984.
[3] Jabbour E, Parikh SA, Kantarjian H, Cortes J. Chronic myeloid leukemia: mechanisms of resistance and treatment. Hematol Oncol Clin North Am 2011; 25: 981‑v.
[4] Réa D, Hughes TP. Development of asciminib, a novel allosteric inhibitor of BCR‑ABL1. Crit Rev Oncol Hematol 2022; 171: 103580.
[5] Patel AB, OʼHare T, Deininger MW. Mechanisms of Resistance to ABL Kinase Inhibition in Chronic Myeloid Leukemia and the Development of Next Generation ABL Kinase Inhibitors. Hematol Oncol Clin North Am 2017; 31: 589–612.
[6] Réa D, Mauro MJ, Boquimpani C, et al. A phase 3, open‑label, randomized study of asciminib, a STAMP inhibitor, vs bosutinib in CML after 2 or more prior TKIs. Blood 2021; 138: 2031–2041.
[7] SPC Scemblix. Dostupné na: https://www.ema.europa.eu/cs/documents/product‑information/scemblix‑epar‑product‑information_cs.pdf
Úspěšná léčba chronické myeloidní leukemie – zkušenost z reálné klinické praxe
Souhrn
Čičátková P, Horňák T, Žáčková D. Úspěšná léčba chronické myeloidní leukemie – zkušenost z reálné klinické praxe.
Terapie chronické myeloidní leukemie inhibitory tyrozinkináz vedla k dramatickému zlepšení prognózy pacientů s tímto onemocněním. Po splnění cíle v podobě prodloužení délky života na roveň zdravým vrstevníkům je pozornost lékařů i pacientů nyní soustředěna na kvalitu jejich života. Velký potenciál je přisuzován nejnovějšímu tyrozinkinázovému inhibitoru asciminibu, který působí unikátním mechanismem účinku v podobě vazby do myristoylové kapsy. Níže je popsán případ pacienta léčeného asciminibem ve čtvrté linii po selhání i nesnášenlivosti dříve podávaných inhibitorů tyrozinkináz. Klíčová slova: chronická myeloidní leukemie – inhibitory tyrozinkináz – asciminib – inhibitor STAMP.
Summary
Cicatkova P, Hornak T, Zackova D. Successful treatment of chronic myeloid leukemia – an experience from real clinical practice.
The chronic myeloid leukemia therapy with tyrosine kinase inhibitors has led to a dramatic improvement of prognosis for patients with this disease. After achieving the goal of prolongation life expectancy to that of healthy peers, the focus of both doctors and patients is now on the quality of life. There is significant potential in the latest tyrosine kinase inhibitor, asciminib, which works through a unique mechanism by binding to the myristoyl pocket. The following case report describes a chronic myeloid leukemia patient treated with asciminib in the fourth line after failure or intolerance of previously administered tyrosine kinase inhibitors. Key words: chronic myeloid leukemia – tyrosine kinase inhibitors – asciminib – STAMP inhibitor.
Úvod
Prognóza chronické myeloidní leukemie (CML) v chronické fázi (chronic phase, CP) se díky zavedení inhibitorů tyrozinkináz (TKI) v čele s imatinibem dramaticky zlepšila a desetileté přežití těchto pacientů ve studii IRIS (International Randomized Study of Interferon and STI571) dosáhlo 83,3 %. Zároveň však byl po 10 letech od zahájení léčby imatinib vysazen u více než poloviny pacientů [1]. Tato skutečnost podtrhuje význam TKI vyšších generací a zdůrazňuje potřebu vyvíjet další TKI včetně těch s odlišným místem působení, než je adenosintrifosfátová (ATP) vazebná doména.
Prvním TKI s jiným mechanismem účinku je inhibitor STAMP (Specifically Targeting the BCR‑ABL1 Myristoyl Pocket) asciminib působící cestou myristoylové kapsy, což vede k inhibici patologické kinázy BCR::ABL1 [2]. Dveře do klinické praxe tomuto TKI otevřela studie ASCEMBL porovnávající u pacientů v CP předléčených alespoň dvěma TKI účinnost a bezpečnost asciminibu (40 mg 2× denně) oproti bosutinibu (500 mg 1× denně). Mezi pacienty léčenými asciminibem jsme v porovnání s bosutinibem viděli vyšší podíl dosažení velké molekulární odpovědi (major molecular response, MMR) jak po 24 měsících terapie (25,5 % vs. 13,2 %), tak po 96 měsících terapie (37,6 % vs. 15,8 %) [3,4]. Taktéž snášenlivost asciminibu se jevila velmi slibná, k ukončení terapie vedly nežádoucí účinky u 7,7 % pacientů léčených asciminibem v porovnání s 23,6 % pacientů léčených bosutinibem. Nejčastější nežádoucí účinky zahrnovaly bolest hlavy (19,9 %), únavu (14,7 %), arteriální hypertenzi (13,5 %), průjem, bolesti kloubů (shodně 12,8 %) a nevolnost (11,5 %) [4]. Postavení asciminibu v terapii CML i zkušenosti s jeho podáváním v reálné klinické praxi byly již v minulosti publikovány i v českém písemnictví [5–8]. Předkládaná kazuistika ukazuje případ pacienta léčeného asciminibem ve čtvrté linii léčby.
Popis případu
Pacient ve věku 42 let byl v září 2014 odeslán na hematologii praktickým lékařem pro splenomegalii a mírnou leukocytózu. Molekulárně genetickým vyšetřením byla potvrzena přítomnost fúzního genu BCR::ABL1 s typem transkriptu b2a2, a tak stanovena diagnóza CML v CP. Pacient trpěl přidruženými onemocněními v podobě arteriální hypertenze, dyslipidemie, obezity a Gilbertova syndromu.
V rámci první linie byla v říjnu 2014 zahájena terapie nilotinibem v plné dávce 600 mg na den. Po dvou týdnech terapie bylo dosaženo kompletní hematologické odpovědi, avšak také se začaly objevovat nežádoucí účinky v podobě trombocytopenie stupně závažnosti 2, elevace bilirubinu stupně závažnosti 2 a také elevace amylázy a lipázy stupně závažnosti 1 (všechny nežádoucí účinky byly hodnoceny dle CTCAE – Common Terminology Criteria for Adverse Events). Elevace bilirubinu se v prvních měsících terapie zhoršovala až na hodnoty odpovídající stupni závažnosti 3 a terapie musela být v průběhu roku 2015 opakovaně přerušována. Od prosince 2015 byl nilotinib podáván v redukované dávce 300 mg denně. Na elevaci bilirubinu měl jistý podíl i Gilbertův syndrom, ale při užívání snížené dávky nilotinibu již u bilirubinu nedocházelo k významnému nárůstu koncentrace, která se pohybovala maximálně na hodnotách odpovídajících stupni závažnosti 2. Léčebná odpověď v uzlových bodech v průběhu prvního roku léčby byla optimální dle kritérií ELN (European LeukemiaNet), přičemž po 12 měsících terapie, v říjnu 2015, byla hladina transkriptu BCR::ABL1 0,022 % na mezinárodní škále (international scale, IS), což odpovídá úrovni MMR [9]. Terapie probíhala s dobrou tolerancí i optimální účinností až do konce roku 2016. V lednu 2017 byla zaznamenána ztráta MMR s nárůstem transkriptu BCR::ABL1 na 1,3 % IS. Byla provedena mutační analýza s negativním výsledkem a také sternální punkce rovněž potvrzující ztrátu kompletní cytogenetické odpovědi.
Po konfirmaci ztráty MMR v únoru 2017 (hladina transkriptu BCR::ABL1 2,8 % IS) byla terapie změněna na dasatinib. Promptně bylo dosaženo hluboké molekulární odpovědi (deep molecular response, DMR, tj. hladina transkriptu BCR::ABL1 ≤ 0,01 %) s transkriptem BCR::ABL1 na úrovni 0,002 % IS. Opět se ale objevila trombocytopenie stupně závažnosti 2, kdy při hodnotě trombocytů 56 × 109/l byla dávka dasatinibu redukována na střídavě 80 mg a 60 mg denně. V říjnu 2017, po devíti měsících terapie, byla jednorázově zaznamenána ztráta MMR se vzestupem hladiny transkriptu BCR::ABL1 na 0,18 % IS. Následným odběrem však nebyla konfirmována a opět byla potvrzena DMR. Trombocytopenie se zlepšila na hodnoty kolísající mezi trombocytopenií 1. stupně závažnosti a jejich normálním počtem a pacient pokračoval v terapii sníženou dávkou dasatinibu s dobrou tolerancí i uspokojivou odpovědí.
V dubnu 2019, po 28 měsících terapie dasatinibem, došlo k opětovné progresi trombocytopenie na 2. stupeň závažnosti s nutností další redukce dávky na 60 mg denně (přechodně s víkendovou pauzou). V lednu 2020 byla konfirmována ztráta MMR (hodnota transkriptu BCR::ABL1 1,1 % IS). Dávka dasatinibu byla navýšena nejprve na 80 mg a později na plnou dávku 100 mg a provedená mutační analýza znovu prokázala negativní výsledek. Po přechodném poklesu hladiny transkriptu jeho hodnota opětovně narostla a v prosinci 2020 byla terapie změněna na ponatinib v dávce 30 mg denně. Již po dvou měsících terapie byla obnovena MMR, která přetrvávala i při dalších kontrolách, což vedlo v červnu 2021 ke snížení dávky ponatinibu na 15 mg denně. Pro ztrátu MMR byla dávka ponatinibu v říjnu 2021 opět navýšena na 30 mg. Přestože to vedlo nejen k promptnímu obnovení MMR, ale i DMR s nedetekovatelným transkriptem BCR::ABL1, léčebná odpověď v dalším průběhu znovu kolísala a došlo i k hraniční ztrátě MMR (0,13 % v srpnu 2022).
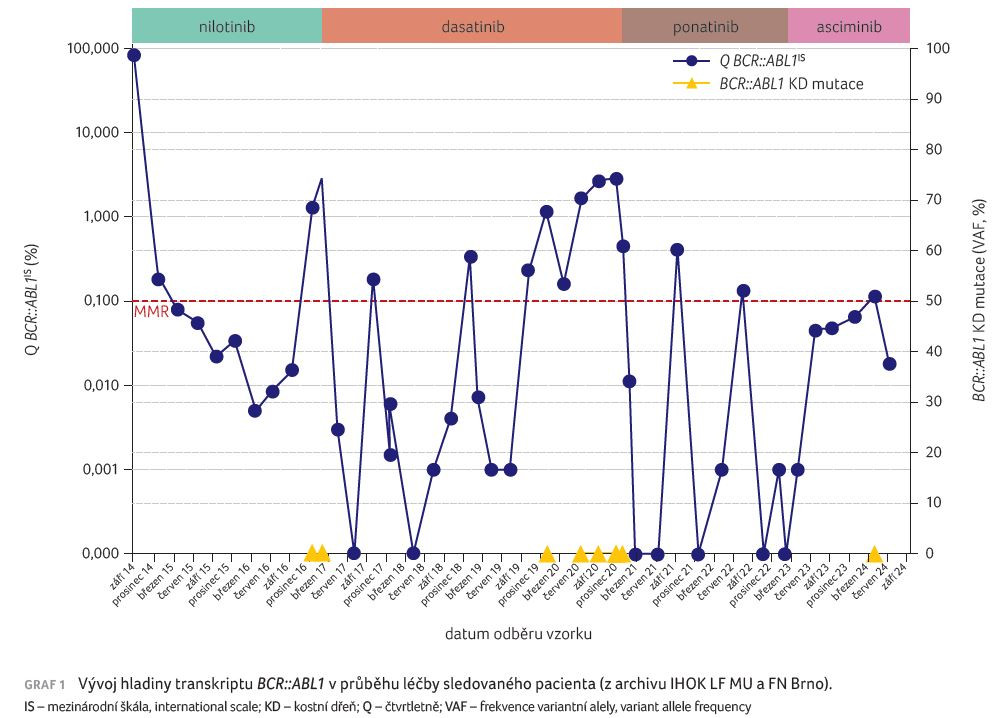 Vzhledem k nutnosti podávat alespoň 30 mg ponatinibu k udržení léčebné odpovědi a kvůli obavám z nežádoucích účinků při dlouhodobé terapii jsme se rozhodli léčbu změnit na asciminib v rámci specifického léčebného programu. Terapie byla zahájena v lednu 2023 ve standardním dávkování 40 mg 2× denně. Pacient léčbu od počátku subjektivně výborně toleroval, nicméně v květnu 2023 mu byla diagnostikována porucha glukózové tolerance s nutností zavedení diety s omezením cukrů. Prozatím nedošlo k rozvoji diabetes mellitus. Poslední kontrola proběhla v září 2024, po 20 měsících terapie asciminibem, kdy se již neobjevily žádné další nežádoucí účinky a léčebná odpověď dlouhodobě setrvává na úrovni MMR s ojedinělým zakolísáním těsně nad tuto hranici. Vývoj hladiny transkriptu BCR::ABL1 od diagnózy po celou dobu terapie ukazuje graf 1.
Vzhledem k nutnosti podávat alespoň 30 mg ponatinibu k udržení léčebné odpovědi a kvůli obavám z nežádoucích účinků při dlouhodobé terapii jsme se rozhodli léčbu změnit na asciminib v rámci specifického léčebného programu. Terapie byla zahájena v lednu 2023 ve standardním dávkování 40 mg 2× denně. Pacient léčbu od počátku subjektivně výborně toleroval, nicméně v květnu 2023 mu byla diagnostikována porucha glukózové tolerance s nutností zavedení diety s omezením cukrů. Prozatím nedošlo k rozvoji diabetes mellitus. Poslední kontrola proběhla v září 2024, po 20 měsících terapie asciminibem, kdy se již neobjevily žádné další nežádoucí účinky a léčebná odpověď dlouhodobě setrvává na úrovni MMR s ojedinělým zakolísáním těsně nad tuto hranici. Vývoj hladiny transkriptu BCR::ABL1 od diagnózy po celou dobu terapie ukazuje graf 1.
Závěr a diskuse
Spektrum nežádoucích účinků, které provázejí terapii jednotlivými TKI, je alespoň částečně určováno dalšími blokovanými tyrozinkinázami. Proto také některé nežádoucí účinky, včetně cytopenií, mohou provázet terapii vícero TKI, jak jsme pozorovali i při terapii našeho pacienta. Trombocytopenie byla přítomna jak při léčbě nilotinibem, tak při léčbě dasatinibem. Po pěti letech léčby nilotinibem ve studii ENESTnd se závažná trombocytopenie (gr. 3 a více) vyskytla u 10,4 % pacientů a při podávání dasatinibu ve studii DASISION byl výskyt tohoto nežádoucího účinku pozorován u 22 % léčených dasatinibem [10,11]. Proto jsou pravidelné kontroly krevního obrazu při terapii všemi TKI nezbytnou součástí monitorování nejen účinnosti této terapie, ale také právě její hematologické toxicity. I hepatotoxicita pozorovaná u našeho pacienta patří k obávaným nežádoucím účinkům léčby TKI, nicméně při terapii nilotinibem patří spíše ke vzácnějším (v rámci studie ENESTnd byla pozorována u 1,8 % pacientů léčených nilotinibem v dávce 600 mg denně) a na hyperbilirubinemii se u našeho pacienta významně podílel i Gilbertův syndrom prokázaný již v předchorobí. Kolísání léčebné odpovědi je pozorováno u nemalé části pacientů. U prezentovaného případu byla k udržení léčebné odpovědi nutná plná dávka dasatinibu (spojená se současným výskytem nežádoucích účinků) i vyšší dávka ponatinibu, jejíž dlouhodobé podávání je taktéž rizikové s ohledem na závažné nežádoucí účinky vyskytující se při terapii tímto přípravkem.
V předložené kazuistice bylo potvrzeno, že asciminib je vhodnou alternativou nejen pro referovaného pacienta, ať už s ohledem na udržení optimální léčebné odpovědi, nebo pro absenci závažných nežádoucích účinků. Porucha glukózové tolerance odhalená u našeho pacienta mohla mít kromě terapie asciminibem spojitost také s obezitou a životním stylem. Asciminib se tak jeví jako bezpečná volba pro předléčené pacienty, nicméně pro posouzení dlouhodobé účinnosti i snášenlivosti je třeba delšího sledování.
Předkládaná práce vznikla díky podpoře Grantu pro specifický výzkum LF MU pod grantovým číslem MUNI/A/1558/2023.
MUDr. Petra Čičátková
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20, 625 00 Brno
e‑mail: petra.cicatkova@fnbrno.cz
Literatura
[1] Hochhaus A, Larson RA, Guilhot F, et al. Long‑term outcomes of imatinib treatment for chronic myeloid leukemia. N Engl J Med 2017; 379: 919–927.
[2] Hughes TP, Mauro MJ, Cortes JE, et al. Asciminib in chronic myeloid leukemia after ABL kinase inhibitor failure. N Engl J Med 2019; 381: 2315–2326.
[3] Rea D, Mauro MJ, Boquimpani C, et al. A phase 3, open‑label, randomized study of asciminib, a STAMP inhibitor, vs bosutinib in CML after 2 or more prior TKIs. Blood 2021; 138: 2031–2041.
[4] Hochhaus A, Rea D, Boquimpani C, et al. Asciminib vs bosutinib in chronic‑phase chronic myeloid leukemia previously treated with at least two tyrosine kinase inhibitors: longer‑term follow‑up of ASCEMBL. Leukemia 2023; 37: 617–626.
[5] Čičátková P, Horňák T, Kvetková A, Žáčková D. Asciminib a jeho postavení v léčbě chronické myeloidní leukemie. Onkol Revue 2024; 11: 1–5.
[6] Čičátková P, Horňák T, Jurček T, Žáčková D. Chronická myeloidní leukemie – potřebujeme ještě nové inhibitory tyrozinkináz? Onko Revue 2023; 10(Suppl 1): 34–36.
[7] Čičátková P, Žáčková D. Postavení inhibitorů tyrozinkináz v léčbě chronické myeloidní leukemie. Onkol Revue 2023: 10: 1–6.
[8] Horňák T, Čičátková P, Žáčková D. Asciminib – nová léčebná možnost v léčbě CML. Farmakoterapie 2023; 1: 313–324.
[9] Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020; 36: 966–984.
[10] Hochhaus A, Saglio G, Hughes TP, et al. Long‑term benefits and risk of frintline nilotinib vs. imatinib for chronic myeloid leukemia in chronic phase: 5‑year update of the randomized ENESTnd trial. Leukemia 2016; 30: 1044–1054.
[11] Cortes JE, Saaglio G, Kantarjian HM, et al. Final 5‑year study results of DASISION: The dasatinib versus imatinib study in treatment‑näive chronic myeloid leukemia patients trial. J Clin Oncol 2016; 34: 2333–2347.
Asciminib v léčbě pacienta s CML po selhání a intoleranci tří předchozích inhibitorů tyrozinkináz
Souhrn
Horňák T, Čičátková P, Žáčková D. Asciminib v léčbě pacienta s CML po selhání a intoleranci tří předchozích inhibitorů tyrozinkináz.
Chronická myeloidní leukemie je dnes již považována za onemocnění s dobrou prognózou. Pacienti léčení inhibitory tyrozinkináz (TKI) mají očekávané dožití blízké dožití běžné populace. U většiny pacientů je léčba TKI celoživotní. Nežádoucí účinky terapie jsou časté. Zatímco chronické nežádoucí účinky mají negativní vliv na kvalitu života, akutní mohou být i život ohrožující. Asciminib představuje nový přírůstek do rodiny TKI a díky jinému vazebnému místu oproti ostatním TKI je spojen s nižším výskytem nežádoucích účinků a s efektivitou i v případech, kdy léčba jinými TKI selže. Klíčová slova: chronická myeloidní leukemie – inhibitory tyrozinkináz – asciminib.
Summary
Hornak T, Cicatkova P, Zackova D. Asciminib treatment in a patient with CML after failure and intolerance of three previous tyrosine kinase inhibitors.
Chronic myeloid leukemia is nowadays considered to be a disease with good prognosis. Patients treated with tyrosine kinase inhibitors have life expectancy close to that of the general population. In most patients, the treatment is life‑long. Adverse effects of the therapy are very common, some being chronic and negatively impacting quality of life, while other ones being acute and potentially life‑threatening. Asciminib is the newest addition to the TKI family and it was proven that due to its binding spot being different than in the rest of the TKI, it comes with less adverse effects and is efficient in cases when other TKIs fail. Key words: chronic myeloid leukemia – tyrosine kinase inhibitors – asciminib.
Úvod
Inhibitory tyrozinkináz (TKI) způsobily před více než dvaceti lety revoluci v léčbě chronické myeloidní leukemie (CML). Pacienti žijící s CML mají dnes velmi dobrou prognózu a jejich očekávaná délka dožití je srovnatelná s dožitím běžné populace [1]. Terapie CML je dodnes koncipována jako doživotní a jen malá část pacientů může terapii přerušit a dosáhnout stavu remise bez léčby (treatment‑free remision, TFR). I přes obecně dobrou prognózu však existuje skupina pacientů, která je na terapii rezistentní nebo ji netoleruje. Dnes je v ČR dostupných celkem pět TKI vážících se na molekulu BCR::ABL1 v místě pro vazbu adenosintrifosfátu (ATP) – imatinib, dasatinib, nilotinib, bosutinib, ponatinib – a jeden TKI vážící se na ABL1 v místě myristoylové kapsy (Specifically Targeting the BCR-ABL Myristoyl Pocket, STAMP) – asciminib.
Poslední jmenovaný je pro své reportované vlastnosti vítanou novinkou na poli léčby CML, protože na rozdíl od svých předchůdců se vyznačuje afinitou pouze k ABL1. Afinita k jiným kinázám kromě ABL1 (tzv. off‑target cíle) u ostatních TKI je pravděpodobnou příčinou alespoň některých nežádoucích účinků [2]. Asciminib prokázal v registrační studii ASCEMBL vyšší efektivitu v léčbě pacientů s CML po selhání či nesnášenlivosti alespoň dvou předchozích TKI v porovnání s pacienty léčenými bosutinibem. Léčba zároveň vedla k nižšímu výskytu závažných nežádoucích účinků či nežádoucích účinků vedoucích k nutnosti ukončení terapie [3]. V Evropě byl asciminib v této indikaci registrován v říjnu 2022 [4]. V následujícím textu uvádíme kazuistiku pacienta, který prošel léčbou třemi TKI z důvodů jak intolerance, tak rezistence a nyní je ve čtvrté linii již více než 12 měsíců léčen asciminibem.
Kazuistika
V září 2018 byl do hematologické ambulance referován pacient narozený v roce 1972. Jednalo se o náhodný nález leukocytózy v rámci interního předoperačního vyšetření před plánovanou totální endoprotézou levé kyčle. V krevním obraze s diferenciálním rozpočtem byla leukocytóza 24 × 109/l s výskytem ojedinělých mladých forem, jinak bez dalších pozoruhodností. Molekulární vyšetření potvrdilo přítomnost fúzního genu BCR::ABL1, a tudíž diagnózu CML. V anamnéze pacienta byla uvedena chronická obstrukční plicní nemoc (CHOPN), obezita a totální endoprotéza pravé kyčle v roce 2014, v medikaci pouze inhalační bronchodilatancia v rámci léčby CHOPN.
Riziková skóre dle Sokala i Hasforda byla vyhodnocena jako nízká a pacientovi byl v první linii léčby nasazen imatinib v dávce 400 mg denně. Během prvního měsíce užívání pacient referoval silné bolesti kloubů, nevolnosti, zvracení a otoky končetin, proto byla dávka imatinibu snížena na 300 mg. Po snížení dávky se intenzita nežádoucích účinků snížila, ale pro limitující bolesti kloubů musela být dávka dále snížena na 200 mg denně. I přes optimální léčebnou odpověď s hladinou transkriptu BCR::ABL1 < 10 % mezinárodní škály (international scale, IS) po třech měsících byla léčba imatinibem nakonec ukončena pro přetrvávající artralgie a myalgie a pacientovi byl nasazen nilotinib v dávce 450 mg/den.
Po prvním měsíci užívání nilotinibu pacient udával zmírnění bolestí kloubů, nově se však objevilo svědění kůže a zhoršení dušnosti. Následným plicním vyšetřením bylo objektivizováno zhoršení obstrukční poruchy a na RTG hrudníku byl zachycen obraz drobného bilaterálního fluidotoraxu. Dávka nilotinibu byla snížena na 300 mg jednou denně. Po postupném odeznění nežádoucích účinků a úvodním poklesu hladiny transkriptu došlo po devíti měsících léčby k jejímu opětovnému nárůstu na 0,94 % IS a dávka nilotinibu byla z tohoto důvodu opět zvýšena na 450 mg denně s efektem poklesu hladiny transkriptu až na úroveň ≤ 0,1 % IS, tedy velké molekulární odpovědi (major molecular response, MMR). I když po celou dobu užívání nilotinibu přetrvávaly nežádoucí účinky, jejich intenzita se stabilizovala a byla pacientem tolerována. Po 21 měsících léčby nilotinibem došlo u pacienta ke ztrátě MMR (hladina transkriptu BCR::ABL1 1,4 % IS), která byla konfirmována dalším molekulárním vyšetřením. Nebyla detekována mutace v kinázové doméně BCR::ABL1.
Vzhledem k selhání léčby nilotinibem a jeho dlouhodobým nežádoucím účinkům byla terapie změněna a ve třetí linii byl pacientovi v únoru 2021 nasazen bosutinib v dávce 300 mg/den. Krátce po zahájení léčby došlo k rozvoji gastrointestinálních nežádoucích účinků ve formě průjmu, bolestí a křečí v břiše, přičemž bolesti kloubů nadále přetrvávaly. Dávka bosutinibu byla proto snížena na 200 mg, ale i při této dávce přetrvávaly silné bolesti a křeče břicha v intenzitě, která si vyžádala vyšetření na chirurgické ambulanci s vyloučením náhlé příhody břišní. Terapie byla krátce přerušena a po odeznění gastrointestinálních příznaků byla restartována v dávce 100 mg denně, již s dobrou tolerancí. Pro pokles hladiny transkriptu a vysoké riziko recidivy nežádoucích účinků bylo toto dávkování ponecháno i v dalším období, v devátém měsíci terapie bosutinibem došlo však opět ke ztrátě léčebné odpovědi a vzestupu hladiny transkriptu na 4,8 % IS. Při následném navýšení dávky bosutinibu na 300 mg nastal přechodný pokles hladiny transkriptu, ale i opětovný výskyt nežádoucích účinků, majoritně ve formě gastrointestinálních obtíží. Poté však začala hladina transkriptu opět stoupat až na 15,88 % IS a ke gastrointestinálním obtížím se přidaly myalgie a artralgie.
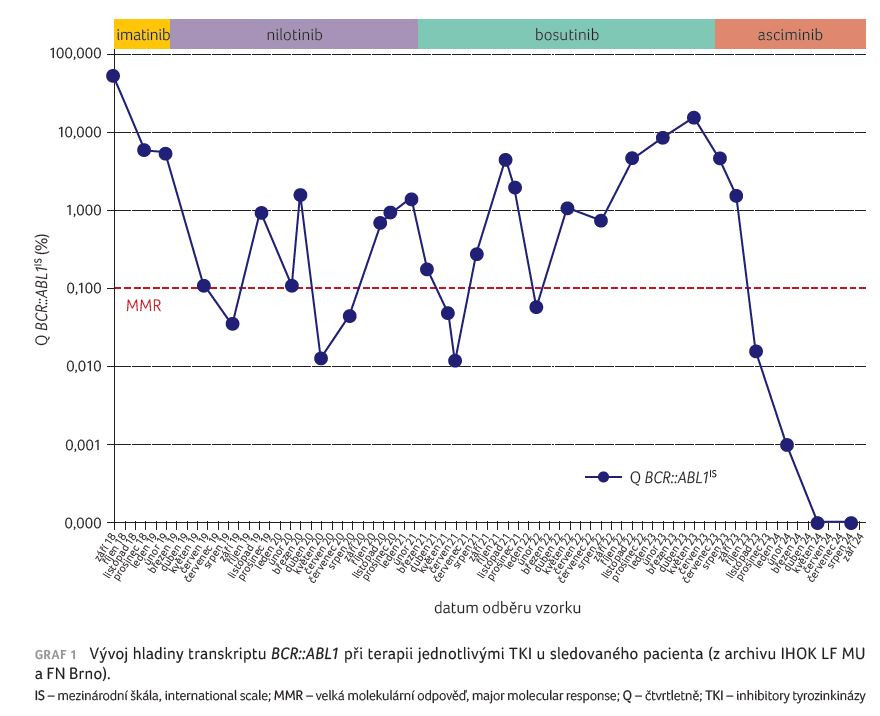 Bylo rozhodnuto o ukončení terapie bosutinibem, přičemž v další linii léčby byly zvažovány dva potentní přípravky – asciminib a ponatinib. Vzhledem k recidivujícím a limitujícím nežádoucím účinkům při léčbě předchozími TKI byla pacientovi doporučena první možnost. Léčba asciminibem byla zahájena v srpnu 2023 v plné dávce 80 mg denně. Několik týdnů po nasazení asciminibu došlo k ústupu většiny nežádoucích účinků a intenzita bolestí kloubů a svalů se významně snížila. Během tří měsíců léčby se hladina transkriptu rychle snížila na úroveň MMR a po šesti měsících i poprvé v historii terapie tohoto pacienta došlo k navození hluboké molekulární odpovědi (deep molecular response, DMR – hladina transkriptu BCR::ABL1 ≤ 0,01 % IS). Pacient je i po 12 měsících léčby bez nových nežádoucích účinků a odpověď na terapii zůstává nadále na úrovni DMR (graf 1).
Bylo rozhodnuto o ukončení terapie bosutinibem, přičemž v další linii léčby byly zvažovány dva potentní přípravky – asciminib a ponatinib. Vzhledem k recidivujícím a limitujícím nežádoucím účinkům při léčbě předchozími TKI byla pacientovi doporučena první možnost. Léčba asciminibem byla zahájena v srpnu 2023 v plné dávce 80 mg denně. Několik týdnů po nasazení asciminibu došlo k ústupu většiny nežádoucích účinků a intenzita bolestí kloubů a svalů se významně snížila. Během tří měsíců léčby se hladina transkriptu rychle snížila na úroveň MMR a po šesti měsících i poprvé v historii terapie tohoto pacienta došlo k navození hluboké molekulární odpovědi (deep molecular response, DMR – hladina transkriptu BCR::ABL1 ≤ 0,01 % IS). Pacient je i po 12 měsících léčby bez nových nežádoucích účinků a odpověď na terapii zůstává nadále na úrovni DMR (graf 1).
Diskuse
Terapie CML se stala jasným paradigmatem úspěšnosti protinádorové léčby. Léčba v našem prostředí je dostupná, účinná, a změnila tak CML na skutečně chronickou nemoc, která valnou většinu pacientů neohrožuje na životě. Protože je terapie často dlouhodobá, nebo i celoživotní, dostává se nyní do centra pozornosti kromě parametrů přežití i kvalita života pacientů často ovlivněná nežádoucími účinky TKI. Asciminib se svým specifickým vazebným místem se vyznačuje vysokou mírou selektivity vůči kináze ABL1. Proto se předpokládá nižší míra nežádoucích účinků vyvolaných inhibicí jiných kináz. Z klinické praxe je zřejmé, že u pacientů, kteří jsou negativně ovlivněni nežádoucími účinky, dochází často ke snížení denní dávky TKI. Výskyt nežádoucích účinků také negativně ovlivňuje adherenci k léčbě. Oba důvody se mohou odrazit rovněž na vzestupu hladiny transkriptu a následném selhání léčby. V případě popisované kazuistiky byla léčba TKI u pacienta doprovázena výskytem četných nežádoucích účinků, kvůli nimž bylo opakovaně snižováno dávkování. Z ambulantních zpráv se lze také domnívat, že užívání léku nebylo pro subjektivní diskomfort pacienta pravidelné. Po nasazení asciminibu došlo k ústupu nežádoucích účinků, pacient pozitivně reflektoval zlepšení kvality života, a je tak možné předpokládat i lepší compliance v rámci užívání léku. Asciminib je důležitým a hodnotným přírůstkem v rodině TKI a naše dosavadní zkušenosti s ním potvrzují data reportovaná v klinických studiích.
Tato práce byla podpořena z grantu MUNI/A/1685/2024.
MUDr. Tomáš Horňák
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20, 625 00 Brno
e‑mail: tomas.hornak@fnbrno.cz
Literatura
[1] Bower H, Björkholm M, Dickman PW, et al. Life Expectancy of Patients With Chronic Myeloid Leukemia Approaches the Life Expectancy of the General Population. J Clin Oncol 2016; 34: 2851–2857.
[2] Caldemeyer L, Dugan M, Edwards J, Akard L. Long‑Term Side Effects of Tyrosine Kinase Inhibitors in Chronic Myeloid Leukemia. Curr Hematol Malig Rep 2016; 11: 71–79.
[3] Hochhaus A, Réa D, Boquimpani C, et al. Asciminib vs bosutinib in chronic‑phase chronic myeloid leukemia previously treated with at least two tyrosine kinase inhibitors: longer‑term follow‑up of ASCEMBL. Leukemia 2023; 37: 617–626.
[4] SPC Scemblix. Dostupné na: https://www.ema.europa.eu/documents/product‑information/scemblix‑epar‑product‑information_en.pdf
Použití asciminibu u polymorbidního nemocného s CML s intolerancí dvou předchozích linií léčby tyrozinkinázovými inhibitory
Souhrn
Szeligová L. Použití asciminibu u polymorbidního nemocného s CML s intolerancí dvou předchozích linií léčby tyrozinkinázovými inhibitory.
Zavedení cílené léčby tyrozinkinázovými inhibitory (TKI) do klinické praxe zásadně změnilo osud nemocných s chronickou myeloidní leukemií. Nicméně stále zůstává nemalá skupina pacientů, u nichž není léčebná odpověď dostatečně hluboká, léčebnou odpověď ztrácejí nebo TKI musejí být vysazeny pro nežádoucí účinky. S cílem minimalizovat nežádoucí účinky TKI byl vyvinut asciminib s odlišným mechanismem účinku. Lék představuje vítanou alternativu především u starších polymorbidních pacientů, jak dokládá i popisovaný případ. Klíčová slova: chronická myeloidní leukemie – tyrozinkinázové inhibitory – asciminib – polymorbidní pacient.
Summary
Szeligova L. Asciminib use in a polymorbid patient with CML and intolerance of two previous lines of tyrosine kinase inhibitor treatment.
Introduction of targeted tyrosine kinase inhibitor (TKI) treatment in clinical practice has changed the fate of patients with chronic myeloid leukemia dramatically. However, there are still quite many patients in whom the therapeutic response is not deep enough, gets lost over time or has to be given up because of TKI adverse effects. Asciminib has been developed in order to minimize these side effects thanks to its different mechanism of action. This drug represents a welcome alternative especially in older polymorbid patients, as shown in our case study. Key words: chronic myeloid leukemia – tyrosine kinase inhibitors – asciminib – polymorbid patient.
Úvod
Chronická myeloidní leukemie (CML) je myeloproliferativní onemocnění, které je charakteristické přítomností tzv. filadelfského chromozomu, kdy dochází k reciproké translokaci části ramének mezi chromozomy 9 a 22 za vzniku fúzního genu BCR::ABL1. Vznikne tak patologická konstitutivně aktivovaná tyrozinkináza BCR::ABL1, která způsobí nekontrolovanou proliferaci myeloidních buněk a sníženou odpověď na proapoptotické signály [1].
Zavedení cílené léčby tyrozinkinázovými inhibitory (TKI) do klinické praxe v roce 2001 zásadně změnilo osud nemocných a z fatálního onemocnění se stalo onemocnění chronické. Nicméně stále zůstává nemalá skupina pacientů (20–30 %), u nichž není léčebná odpověď dostatečně hluboká, léčebnou odpověď ztrácejí nebo TKI musejí být vysazeny pro nežádoucí účinky [2]. S cílem minimalizovat nežádoucí účinky TKI byl vyvinut lék asciminib, první zástupce nové třídy inhibitorů STAMP (Specifically Targeting the BCR‑ABL Myristoyl Pocket). Ten má odlišný mechanismus účinku než ostatní používané TKI, které cílí na vazebné místo pro adenosintrifosfát (ATP). Asciminib cílí na jiné vazebné místo kinázy BCR::ABL1 – myristoylovou kapsu –, čímž napodobuje autoinhibiční účinek ABL [3]. Asciminib byl schválen americkým Úřadem pro kontrolu potravin a léčiv (FDA) v říjnu 2021 a Evropskou lékovou agenturou (EMA) v srpnu 2022 pro léčbu nemocných s CML léčených alespoň dvěma TKI nebo s mutací T315I.
Popis případu
Pacient ve věku 75 let byl odeslán do naší ambulance pro nově zjištěnou CML BCR::ABL1 pozitivní v chronické fázi, podtyp major b2a2. Ve vstupních parametrech krevního obrazu byly leukocyty 211 × 109/l, hemoglobin 99 g/l, trombocyty 525 × 109/l. Dále měl nemocný hmatnou splenomegalii s přesahem 7 cm pod žeberní oblouk, dle ultrasonografického vyšetření byla velikost sleziny 19 cm × 8 cm × 5 cm. Klinicky si nemocný stěžoval při minimální námaze na dušnost trvající asi dva týdny a na nechtěné hubnutí – snížení hmotnosti o 10 kg během dvou měsíců. Prognostická skóre CML byla: Sokalovo 1,24 (vysoké), Hasfordovo 1 012,16 (střední) a EUTOS 70 (nízké). Jednalo se o obézního polymorbidního nemocného s ischemickou chorobou srdeční po infarktu myokardu v minulosti s nutností zavedení stentu, s diabetes mellitus 2. typu a hypertenzí.
Po úvodní cytoredukční terapii hydroxykarbamidem byla zahájena léčba TKI imatinibem ve standardní dávce 400 mg/den. Během prvního měsíce léčby se rozvinula kožní toxicita (svědivý celotělový exantém), dále průjem a otoky obličeje, které nevymizely ani po redukci dávky na 300 mg/den a adekvátní podpůrné léčbě. Proto byl po třech měsících léčby imatinib vysazen a zahájena léčba TKI 2. generace dasatinibem v mírně redukované dávce 90 mg/den pro předchozí toxicitu imatinibu. Léčba byla zpočátku dobře tolerována. Ve třetím měsíci léčby bylo dosaženo velké molekulární odpovědi (major molecular response, MMR) a po šesti měsících léčby byla léčebná odpověď na úrovni MR 4.0. Pro neurotoxicitu byla dávka v devátém měsíci léčby snížena na 70 mg/den, pro kožní toxicitu byla v 15. měsíci léčby nutná další redukce dasatinibu na 70 mg 5× týdně. Z důvodu další toxicity – progredující bolesti hlavy, přičemž neurologické vyšetření bylo bez patologie – byl dasatinib vysazen a byla zavedena analgetická léčba.
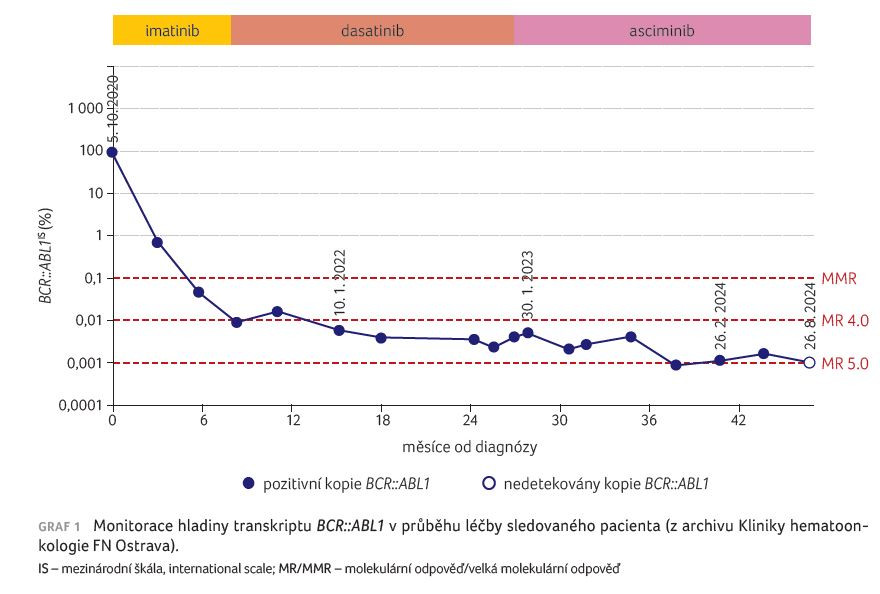 Ve třetí linii byla zahájena léčba inhibitorem STAMP asciminibem ve standardní dávce 80 mg/den. Po úvodní dobré toleranci se ve třetím měsíci výrazně zhoršily bolesti hlavy, rozvinulo se nechutenství, slabost, léčba asciminibem byla přerušena a bylo objednáno vyšetření mozku magnetickou rezonancí (MR). Po měsíci přerušení léčby nedošlo ke zmírnění bolestí hlavy, tedy bylo zhodnoceno, že potíže nesouvisejí s asciminibem. Byla navýšena dávka analgetik a znovuzahájena léčba asciminibem. Krátce nato byl nemocný hospitalizován na spádovém neurologickém oddělení pro rozvoj dvojitého vidění a ztráty rovnováhy. Na provedeném vyšetření výpočetní tomografií (CT) mozku byla popisována suspektní mastoiditida vpravo. Otorinolaryngologem byl nález zhodnocen jako chronický zánět středouší, byl chirurgicky ošetřen a klinický stav nemocného se zlepšil. Na doplněném MR vyšetření mozku byla popisována mírná atrofie mozku, prosáknutí pyramid a mastoidálních sklípků, bez známek abscesu či empyému, bez známek trombózy splavů. Vzhledem k přetrvávajícím, i když výrazně zmírněným obtížím byla dávka asciminibu redukována na polovinu, tedy na 40 mg/den. Nyní – po dalších 18 měsících léčby asciminibem – je stav nemocného stabilní, mírné chronické bolesti hlavy přetrvávají a léčebná odpověď se prohloubila na MR 5.0 s negativním nálezem kopií BCR::ABL1 (graf 1).
Ve třetí linii byla zahájena léčba inhibitorem STAMP asciminibem ve standardní dávce 80 mg/den. Po úvodní dobré toleranci se ve třetím měsíci výrazně zhoršily bolesti hlavy, rozvinulo se nechutenství, slabost, léčba asciminibem byla přerušena a bylo objednáno vyšetření mozku magnetickou rezonancí (MR). Po měsíci přerušení léčby nedošlo ke zmírnění bolestí hlavy, tedy bylo zhodnoceno, že potíže nesouvisejí s asciminibem. Byla navýšena dávka analgetik a znovuzahájena léčba asciminibem. Krátce nato byl nemocný hospitalizován na spádovém neurologickém oddělení pro rozvoj dvojitého vidění a ztráty rovnováhy. Na provedeném vyšetření výpočetní tomografií (CT) mozku byla popisována suspektní mastoiditida vpravo. Otorinolaryngologem byl nález zhodnocen jako chronický zánět středouší, byl chirurgicky ošetřen a klinický stav nemocného se zlepšil. Na doplněném MR vyšetření mozku byla popisována mírná atrofie mozku, prosáknutí pyramid a mastoidálních sklípků, bez známek abscesu či empyému, bez známek trombózy splavů. Vzhledem k přetrvávajícím, i když výrazně zmírněným obtížím byla dávka asciminibu redukována na polovinu, tedy na 40 mg/den. Nyní – po dalších 18 měsících léčby asciminibem – je stav nemocného stabilní, mírné chronické bolesti hlavy přetrvávají a léčebná odpověď se prohloubila na MR 5.0 s negativním nálezem kopií BCR::ABL1 (graf 1).
Závěr
Přes dobrou účinnost u většiny nemocných jsou TKI u nezanedbatelné skupiny zejména starších polymorbidních pacientů špatně tolerovány i v redukovaných dávkách a je nutné je vysadit. Pro tyto nemocné je vítanou alternativou asciminib s odlišným mechanismem účinku. Jak ukazuje případ našeho nemocného, je možnost redukovat dávku vítaným způsobem, jak dosáhnout dobré, v našem případně dokonce prohloubené léčebné odpovědi a současně zajistit dobrou toleranci léčby.
MUDr. Lenka Szeligová, Ph.D.
Klinika hematoonkologie, FN Ostrava
17. listopadu 1790, 708 52 Ostrava
e‑mail: lenka.szeligova@fno.cz
Literatura
[1] Soverini S, Mancini M, Bavaro L, et al. Chronic myeloid leukemia: the paradigm of targeting oncogenic tyrosine kinase signaling and counteracting resistance for succesful cancer therapy. Mol Cancer 2018; 17: 49.
[2] Hochhaus A, Souselle S, Rosti G, et al. Chronic myeloid leukemia ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up. Ann Oncol 2017; 28(Suppl 4): iv41–iv51.
[3] Schoepfer J, Jahnke W, Berellini G, et al. Discovery of asciminib (ABL001), an allosteric inhibitor of the tyrosine kinase activity of BCR‑ABL1. J Med Chem 2018; 61: 8120–8135.
 Asciminib v České republice aneb Účinná odpověď na výzvy v léčbě chronické myeloidní leukemie
Asciminib v České republice aneb Účinná odpověď na výzvy v léčbě chronické myeloidní leukemie