ZAOSTŘENO Migraine Headache Management 2024
OBSAH
 Dlouhodobá bezpečnost a snášenlivost anti‑CGRP terapií
Dlouhodobá bezpečnost a snášenlivost anti‑CGRP terapií
Léčba migrény u specifických skupin pacientů
Dlouhodobá bezpečnost a snášenlivost anti‑CGRP terapií
Jedna část prezentací odborného setkání Migraine Headache Management 2024 se zaměřila na nástroje pro hodnocení dlouhodobé bezpečnosti a snášenlivosti anti‑CGRP (calcitonin gene‑related peptide) terapie.
Příklad 1: Dlouhodobé otevřené studie
Příkladem z uvedené oblasti je pětiletá open‑label studie s erenumabem v prevenci epizodické migrény [1]. První fází léčby trvající 12 měsíců byla dvojitě zaslepená perioda, kdy pacienti užívali buď placebo, nebo erenumab v dávce 7 mg, nebo 21 mg, nebo 70 mg. Následovala otevřená fáze léčby, v níž zařazení pacienti užívali 70 mg erenumabu po dobu dvou let. Poté byla dávka erenumabu navýšena na 140 mg a pacientům byla podávána po dobu tří let. Z 250 nemocných, kteří postoupili do poslední fáze léčby dávkou erenumabu 140 mg, jich studii dokončilo 214. U pacientů, kteří léčbu v této fázi přerušili, nebyla důvodem neúčinnost terapie; dvě pacientky otěhotněly, tři pacienti měli nežádoucí účinky a 16 pacientů si již nepřálo pokračovat ve studii. Ve dvojitě zaslepené fázi studie došlo k poklesu o 1,5 MMD (monthly migraine days, počet dnů s migrénou v měsíci) během 12 měsíců, ve skupině s placebem pak o 1 MMD. V otevřené fázi s dávkou erenumabu 70 mg byl zaznamenán pokles o 2–3 MMD, v poslední fázi se 140 mg erenumabu byl zjištěn další pokles o 1–1,5 MMD.
Příklad 2: Studie z reálné praxe
Studie fáze IV PEARL prokázala efektivitu fremanezumabu trvající více než 24 měsíců [2]. Této fáze klinického hodnocení se zúčastnilo 574 pacientů, z nichž 148 trpělo epizodickou migrénou a 426 chronickou migrénou. Po měsíci léčby byl pozorován pokles v parametru počtu dnů s migrénou u pacientů s epizodickou migrénou o více než 5 MMD, ve skupině s chronickou migrénou téměř o 7 MMD. Po třech měsících léčby fremanezumabem bylo pozorováno zlepšení ve skupině pacientů s epizodickou migrénou o 7 MMD, ve skupině pacientů s chronickou migrénou o 8 MMD oproti počátečnímu počtu MMD (baseline). V dalších měsících byl pozorován pokračující trend poklesu počtu MMD v obou skupinách, ovšem výraznější byla redukce u skupiny pacientů s chronickou migrénou – v šestém měsíci pokles o 9 MMD, v devátém měsíci o 9,5 MMD a ve 12. měsíci téměř o 10 MMD. Ve skupině pacientů s epizodickou migrénou bylo snížení počtu MMD mezi 3., 6. a 9. měsícem sice pozvolnější, ve srovnání se skupinou pacientů s chronickou migrénou ale v trendu také klesající. Mezi 9. a 12. měsícem u pacientů s epizodickou migrénou byl pokles počtu MMD opět výrazný – o 8 MMD oproti výchozímu stavu. Dalším výstupem ze studie byly výsledky bezpečnosti měřené po šesti měsících: jeden nebo více nežádoucích účinků vykazovalo 25 % pacientů, ale závažný nežádoucí účinek udávalo pouze 2,1 % pacientů ze studie. Pacientů, kteří se pro nežádoucí účinky rozhodli studii přerušit, bylo pouze 2,2 %.
Příklad 3: Postmarketingový dohled
Dle systému hlášení nežádoucích účinků amerického Úřadu pro kontrolu potravin a léčiv (FDA) byl pro čtyři anti‑CGRP monoklonální protilátky sestaven žebříček „top 10“ nejčastějších nežádoucích účinků [3].
Pro erenumab byla nejčastějším nežádoucím účinkem zácpa (17,9 %), následovala bolest v místě vpichu (14 %), dále padání vlasů/alopecie (7 %), krvácení v místě injekce (5,7 %), svalové spasmy (3,8 %), abnormální pocit (3 %), hematom v místě vpichu (3 %), úzkost (2,7 %), zarudnutí v místě vpichu (2,7 %) a otok v místě vpichu (2,6 %).
Pro galkanezumab byla nejčastějším nežádoucím účinkem bolest v místě vpichu (24 %), dále zarudnutí v místě vpichu (5,3 %), následovalo krvácení v místě injekce (4,9 %), svědění v místě vpichu (4 %), otok místa vpichu (3,9 %), reakce v místě vpichu (3,5 %), padání vlasů/alopecie (3,4 %), nárůst hmotnosti (3,1 %), zácpa (2,9 %) a hematom v místě vpichu (2,5 %).
Pro fremanezumab byla nejčastěji pozorovaným nežádoucím účinkem bolest v místě vpichu (13 %), dále zarudnutí místa vpichu (7 %), svědění v místě vpichu (5,4 %), otok místa vpichu (4,4 %), svědění (3,6 %), reakce v místě vpichu (3,2 %), vyrážka (3,2 %), padání vlasů/alopecie (3 %), zarudnutí místa vpichu (2,8 %) a extravazace v místě vpichu (2,8 %).
U eptinezumabu z nežádoucích účinků byla nejčastěji pozorována únava (13,5 %), následovaly pocit podráždění hrdla (9 %), svědění (8,2 %), pocit ucpaného nosu (7,4 %), abnormální pocit (5,6 %), covid‑19 (5,6 %), přecitlivělost (5,1 %), bolest v oblasti orofaryngu (4,1 %), rinorea (3,6 %) a nazofaryngitida (2,8 %).
Příklad 4: Postmarketingová data během těhotenství
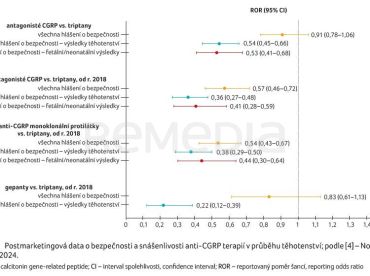 Prostřednictvím globální databáze farmakovigilance Světové zdravotnické organizace (WHO) VigiBase byla srovnávána bezpečnost antagonistů CGRP a triptanů, antagonistů CGRP a triptanů od roku 2018, anti‑CGRP monoklonálních protilátek a triptanů od roku 2018 a bezpečnost gepantů oproti triptanům od roku 2018 (graf 1) [4].
Prostřednictvím globální databáze farmakovigilance Světové zdravotnické organizace (WHO) VigiBase byla srovnávána bezpečnost antagonistů CGRP a triptanů, antagonistů CGRP a triptanů od roku 2018, anti‑CGRP monoklonálních protilátek a triptanů od roku 2018 a bezpečnost gepantů oproti triptanům od roku 2018 (graf 1) [4].
Atogepant není doporučen během těhotenství ani po dobu kojení u žen, které nepoužívají kontracepci [5]. Jako preventivní opatření je preferováno vyhnout se užívání eptinezumabu, erenumabu, fremanezumabu, galkanezumabu a rimegepantu během těhotenství [6–10]. Na zvířecích modelech bylo pozorováno poškození plodu při užívání ubrogepantu [11]. Při předepisování almotriptanu těhotným ženám je potřeba postupovat s opatrností [12]. Eletriptan by měl být v těhotenství používán, pouze pokud je jednoznačně zapotřebí [13]. Frovatriptan není v době gravidity a kojení doporučen u žen, které neužívají kontracepci, jeho užití je možné, pouze pokud by byl jednoznačně zapotřebí [14]. Podání naratriptanu je možné pouze v případě, že očekávaný benefit pro matku je výrazně vyšší než možné riziko pro plod [15]. Užívání rizatriptanu lze uvážit v těhotenství, pouze pokud je to klinicky nezbytné [16]. Podávání sumatriptanu by mělo být zvažováno pouze v případě, že očekávaný prospěch pro matku je výrazně vyšší než možné riziko pro plod [17]. Podávání zolmitriptanu v průběhu gravidity je možné pouze tehdy, převáží‑li očekávaný benefit pro matku potenciální riziko pro plod [18]. Výše uvedená doporučení se v jednotlivých státech mohou lišit.
Příklad 5: Systematická review a metaanalýzy
V této oblasti je příkladem randomizovaná, placebem kontrolovaná studie fáze III (a IIb/III) zaměřená na bezpečnost a snášenlivost monoklonálních protilátek cílících na CGRP a gepantů v prevenci migrény. Do studie byli zařazeni dospělí pacienti s diagnózou migrény dle ICHD‑3 (beta) kritérií, stermínem pro přijetí do studie do 11. února 2022 [19]. Srovnáván je atogepant v dávce 10 mg (poměr šancí [OR] 2,06), 30 mg (OR 1,53), 60 mg (OR 1,82) a 120 mg (OR = 2,22); rimegepant v dávce 75 mg (OR 1,28); eptinezumab v dávce 30 mg (OR 0,96), 100 mg (OR 0,98) a 300 mg (OR 1,11); erenumab v dávce 70 mg (OR 1,27) a 140 mg (OR 1,18); fremanezumab v dávce 225 mg (OR 1,21) a 675 mg (OR 1,20); galkanezumab v dávce 120 mg (OR 1,4) a 240 mg (OR 1,63) oproti placebu.
Další údaje je možno čerpat z databází zdravotních pojišťoven a z pacientských registrů.
Shrnutí
Data o dlouhodobé bezpečnosti a snášenlivosti anti‑CGRP terapií můžeme čerpat z dlouhodobých otevřených studií (open‑label long‑term studies), ze studií z reálné praxe (real‑world studies), z postmarketingového dohledu (post‑marketing surveillance), postmarketingových dat během těhotenství a ze systematických review a metaanalýz. Dále lze data získávat z databází zdravotních pojišťoven a z pacientských registrů. Informace a doporučení ohledně léčby v těhotenství se mohou v jednotlivých státech mírně lišit. Atogepant se jednoznačně nedoporučuje užívat v průběhu gravidity ani po dobu kojení u žen, které nepoužívají kontracepci; dále se doporučuje vyvarovat se užívání eptinezumabu, erenumabu, fremanezumabu, galkanezumabu a rimegepantu během těhotenství.
MUDr. Dana Čtrnáctá
Neurologické oddělení, Ústřední vojenská nemocnice Praha
Literatura
[1] Ashina M, Goadsby PJ, Reuter U, et al. Long‑term efficacy and safety of erenumab in migraine prevention: Results from a 5‑year, open‑label treatment phase of a randomized clinical trial. Eur J Neurol 2021; 28: 1716–1725.
[2] Ashina M, Mitsikostas DD, Amin FM, et al. Real‑world effectiveness of fremanezumab for the preventive treatment of migraine: Interim analysis of the pan‑European, prospective, observational, phase 4 PEARL study. Cephalalgia 2023; 43: 3331024231214987.
[3] Sun W, Li Y, Xia B, et al. Adverse event reporting of four anti‑Calcitonin gene‑related peptide monoclonal antibodies for migraine prevention: a real‑world study based on the FDA adverse event reporting system. Front Pharmacol 2024; 14: 1257282.
[4] Noseda R, Bedussi F, Gobbi C, et al. Calcitonin gene‑related peptide antagonists in pregnancy: a disproportionality analysis in VigiBase®. J Headache Pain 2024; 25: 10.
[5] Aquipta (SmPC). EMA, 2023.
[6] Vyepti (SmPC). EMA, 2024.
[7] Aimovig (SmPC). EMA, 2023.
[8] Ajovy (SmPC). EMA, 2023.
[9] Emgality (SmPC). EMA, 2024.
[10] Vydura (SmPC). EMA, 2024.
[11] Ubralvy (SmPC). FDA, 2023.
[12] Almotriptan (SmPC). MHRA, 2023.
[13] Relpax (SmPC). MHRA, 2024.
[14] Frovatriptan (SmPC). MHRA, 2024.
[15] Naratriptan (SmPC). MHRA, 2024.
[16] Maxalt (SmPC). MHRA, 2024.
[17] Sumatriptan (SmPC). MHRA, 2023.
[18] Zolmitriptan (SmPC). MHRA, 2016.
[19] Messina R, Huessler E‑M, Puledda F, et al. Safety and tolerability of monoclonal antibodies targeting the CGRP pathway and gepants in migraine prevention: A systematic review and network meta‑analysis. Cephalalgia 2023; 43: 3331024231152169.
Migréna a komorbidity
Část přednášek odborného setkání se zaměřila na management migrény a komorbidit, a to i z klinického hlediska. Diskutovány byly především komorbidity psychiatrické, kardiovaskulární a neurologické.
Migréna
Epizoda bolesti hlavy potká během života téměř každého, čímž se řadí mezi jeden z nejfrekventovanějších neurologických symptomů [1]. Ke správnému určení příčiny je důležité na základě podrobně odebrané anamnézy zjistit její frekvenci, intenzitu, lokalizaci, spouštěcí mechanismy a doprovodné projevy. Dle Mezinárodní klasifikace bolestí hlavy (International Classification of Headache Disorders‑3, ICHD‑3) se mezi nejčastější primární bolesti hlavy řadí migréna, která postihuje až 15 % celosvětové populace [2]. Jedná se o chronické a vysilující onemocnění, které se vyznačuje záchvaty velmi silné bolesti, dysfunkcí autonomního nervového systému a u přibližně jedné třetiny pacientů je doprovázena i předcházející aurou [3]. Celoživotní riziko rozvoje migrény je vysoké, u žen přibližně 33 % a 18 % u mužů [4]. Rozvoj migrény není striktně vázán na určitou věkovou kategorii, typicky však začíná v období puberty a adolescence, méně často pak po 50. roce života [2,5].
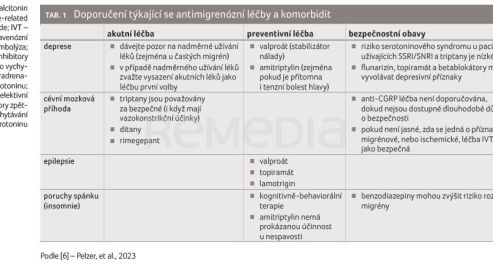 Komorbidita zahrnuje současný výskyt dvou nebo více zdravotních postižení, která mohou vzniknout ve vzájemné korelaci nebo na sobě zcela nezávisle [1]. Pojí se s nižší adherencí pacientů k léčbě, což vede k celkově vyšším nákladům na zdravotní péči. Mezi nejčastější komorbidní stavy u migrény patří psychiatrické, kardiovaskulární, neurologické onemocnění a další (tab. 1) [6].
Komorbidita zahrnuje současný výskyt dvou nebo více zdravotních postižení, která mohou vzniknout ve vzájemné korelaci nebo na sobě zcela nezávisle [1]. Pojí se s nižší adherencí pacientů k léčbě, což vede k celkově vyšším nákladům na zdravotní péči. Mezi nejčastější komorbidní stavy u migrény patří psychiatrické, kardiovaskulární, neurologické onemocnění a další (tab. 1) [6].
Psychiatrická onemocnění
Psychiatrickou zátěž u migreniků tvoří převážně deprese, úzkosti a bipolární porucha. Všechna zmíněná onemocnění predisponují ke zvýšenému riziku rozvoje migrény, které je dále eskalováno, pokud se u pacienta vyskytují současně [7,8]. Komorbidita migrény a deprese se považuje za obousměrnou asociaci, kde významný faktor představuje migréna chronická a migréna s aurou, u nichž je výskyt depresí až třikrát častější [9,10].
Úskalím depresivní symptomatiky, často podporující nadužívání analgetické medikace (medication overuse headache, MOH) při migrenózních atakách, je postupná chronifikace migrény [11], což dále vede ke snížené odpovídavosti na léčbu, a tím i k omezení terapeutických možností. V patofyziologii psychiatrických poruch významnou roli hrají familiární výskyt, genetické a environmentální faktory. K nim přispívá vliv stresu, který se sám o sobě řadí mezi často udávané subjektivní spouštěče migrenózní ataky [12]. Před nasazením preventivní terapie je vhodné doplnění screeningového testu deprese pro zvolení správné medikace, jelikož některá profylaktika (topiramát, flunarizin a betablokátory) mohou depresivní symptomy potencovat [13]. Naproti tomu jiná, například valproát, mohou mít náladu stabilizující efekt, tudíž jsou u pacientů s depresivním laděním ideálním kandidátem.
Amitriptylin je výhodné zvolit u pacientů s tenzním typem bolesti hlavy kombinované s poruchou spánku. Selektivní inhibitory zpětného vychytávání serotoninu (SSRI) nebo inhibitory zpětného vychytávání noradrenalinu a serotoninu (SNRI) nemají dostatečný antimigrenózní efekt, avšak jedná se o často dlouhodobě užívanou medikaci pacientů trpících depresemi (či úzkostnými poruchami). Riziko vzniku serotoninového syndromu u pacientů užívajících zároveň SSRI nebo SNRI a triptany (agonisty serotoninu) pro akutní léčbu migrény je nízké [14].
Jak již bylo řečeno, koincidence deprese u migrény může významně ovlivnit míru odpovědi na profylaktickou léčbu [15]. Jedním z takových případů je terapie onabotulinumtoxinem A, na niž je zaznamenána významně nižší odpověď u těchto pacientů [16]. V posledních letech se do popředí dostaly anti‑CGRP (calcitonin gene‑related peptide) monoklonální protilátky jakožto dostupná, bezpečná a interakčně neagresivní terapie v léčbě migrén [17]. Také post hoc analýzy v porovnání s placebem ukazují, že preventivní medikace anti‑CGRP při léčbě chronické migrény s depresí je významně efektivnější [18].
Kardiovaskulární onemocnění
Vazba kardiologických komorbidit, v popředí s cévní mozkovou příhodou a ischemickými srdečními příhodami, s primárními bolestmi hlavy je v poslední dekádě opakovaně prokázána mnoha výzkumy. Studie na zvířatech také dokazují vliv mikroembolizací jako spouštěče šíření korové deprese i bez následného rozvoje vzniku mikroinfarktů [19]. Již dlouhodobě je znám vyšší výskyt PFO (foramen ovale patens) u pacientů trpících migrénou s aurou. Ten tudíž zvyšuje nejen kardio‑ a cerebrovaskulární riziko, ale také četnost výskytu migrény s aurou [20]. V aktuálních guidelines však jeho uzávěr u pacientů s migrénou není indikován. Již dlouho se považuje za nutné zpozornět obzvláště u pacientek, které trpí vysoce aktivní formou migrény s aurou s četnými atakami, jsou toho času ve věku pod 45 let, mají anamnézu nikotinismu a současně užívají hormonální antikoncepci [21]. Otázkou ale je, zda by stejné riziko platilo i pro novou perorální antikoncepci s nižšími dávkami estrogenu. Při volbě antimigrenózní medikace je nutné vzít v potaz efekt standardně užívaných látek na vaskulární systém často způsobujících vazokonstrikci či zvýšení krevního tlaku [22]. Zásadní revoluci v akutní léčbě migrény představoval příchod triptanů, agonistů serotoninových receptorů, aktivujících vazokonstrikci dilatovaných cerebrálních tepen [23]. Pro tuto vlastnost bylo jejich indikační spektrum významně omezeno u pacientů s anamnézou kardiovaskulárního a cerebrovaskulárního rizika. Empiricky však byla opakovaně tato obava vyvrácena. Dokonce systematické sledování a observační studie publikované v roce 2015 nepopisují žádnou asociaci mezi užitím triptanů a rizikem kardiovaskulární příhody [24]. Je to vysvětleno patofyziologickým mechanismem vaskulárních chorob, v nichž vazokonstrikce sama o sobě hraje minoritní roli [25]. Jiná situace však nastává u pacientů s hemiplegickou migrénou a migrénou s kmenovou aurou při recentní ischemické cévní mozkové či srdeční příhodě nebo dekompenzované hypertenzi. Pro nasazení triptanů u těchto pacientů nemáme dostatečné množství průkazných studií o bezrizikovosti jejich dlouhodobého užívání, proto je zahájení této léčby kontraindikováno [26]. V případě dlouhodobě užívaných ergotaminových derivátů s působením nejen na serotoninové, ale i na dopaminergní a adrenergní receptory nastává významný vazokonstrikční efekt dominantně na extrakraniální, avšak minimálně na intrakraniální cévy, a tím absence vlivu na prokrvení mozkové cirkulace. Léky jsou asociovány se zvýšeným rizikem závažných ischemických komplikací. Jejich volba je tedy kontraindikována a považujeme je již za obsoletní formu terapie migrény. Léčebné metody pro akutní migrenózní ataky se u nás nově rozrůstají o možnost preskripce léků z řady gepantů, antagonistů CGRP receptoru. Ty představují pro pacienty s kardiovaskulárním rizikem nové obzory díky absenci vazokonstrikčního efektu. Jejich nasazení je tedy u těchto pacientů výhodné, přesto je nutný obezřetný přístup [27,28].
Roztroušená skleróza
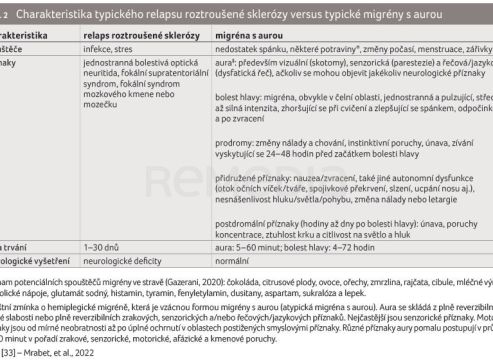 Bolest hlavy je dále jedním z typických průvodních jevů při roztroušené skleróze (RS). Prevalence výskytu primárních bolestí hlavy u pacientů s RS se pohybuje v rozmezí 35,5–70 %, přičemž nejčastějšími druhy jsou migréna a tenzní bolesti [29]. Obě onemocnění, migréna a RS, mají typicky nástup v produktivním období života při plánování založení rodiny a budování kariéry. Omezení, k nimž vedou, mají vliv nejen na rodinné, osobní a pracovní aktivity pacienta, ale znamenají i celkové společensko‑ekonomické dopady. Pokud se například bolest hlavy s aurou vyskytne u pacienta s diagnostikovanou RS, je důležité z hlediska diferenciální diagnostiky rozlišit, zda se jedná o ataku RS, či záchvat migrény. Recidivu RS definují akutní nebo subakutní fokální nebo multifokální příznaky CNS, které trvají alespoň 24 hodin a jsou následovány variabilním zotavením. Mohou zahrnovat například unilaterální optickou neuritidu, supratentoriální, kmenový či cerebelární syndrom [30]. Naproti tomu u migrény jsou fokální CNS symptomy vázané na auru, typicky vizuální, v 90 % (skotomy, výpadky zorného pole, jiskření, rozmazané či tunelové vidění), senzitivní (parestezie obličeje nebo končetin), poruchy řeči, motorické (hemiparézy – u familiární hemiplegické migrény, FHM) [31,32]. Obvykle se rozvíjejí během pěti minut a přetrvávají méně než 60 minut s plnou reverzibilitou. Typicky se projeví jeden symptom odpovídající dané oblasti zasažené mozkové kůry. Kratší délka trvání je zásadním diferenciačním faktorem mezi migrénou s aurou a atakou RS. Dalším důležitým symptomem přispívajícím k diagnóze migrény je následný rozvoj typických bolestí hlavy do 60 minut od příznaků aury. Diferenciální diagnostika migrény a relapsu RS může být obzvláště komplikovaná při prolongaci příznaků aury déle než tři hodiny nebo absenci nástupu migrenózní bolesti hlavy.
Bolest hlavy je dále jedním z typických průvodních jevů při roztroušené skleróze (RS). Prevalence výskytu primárních bolestí hlavy u pacientů s RS se pohybuje v rozmezí 35,5–70 %, přičemž nejčastějšími druhy jsou migréna a tenzní bolesti [29]. Obě onemocnění, migréna a RS, mají typicky nástup v produktivním období života při plánování založení rodiny a budování kariéry. Omezení, k nimž vedou, mají vliv nejen na rodinné, osobní a pracovní aktivity pacienta, ale znamenají i celkové společensko‑ekonomické dopady. Pokud se například bolest hlavy s aurou vyskytne u pacienta s diagnostikovanou RS, je důležité z hlediska diferenciální diagnostiky rozlišit, zda se jedná o ataku RS, či záchvat migrény. Recidivu RS definují akutní nebo subakutní fokální nebo multifokální příznaky CNS, které trvají alespoň 24 hodin a jsou následovány variabilním zotavením. Mohou zahrnovat například unilaterální optickou neuritidu, supratentoriální, kmenový či cerebelární syndrom [30]. Naproti tomu u migrény jsou fokální CNS symptomy vázané na auru, typicky vizuální, v 90 % (skotomy, výpadky zorného pole, jiskření, rozmazané či tunelové vidění), senzitivní (parestezie obličeje nebo končetin), poruchy řeči, motorické (hemiparézy – u familiární hemiplegické migrény, FHM) [31,32]. Obvykle se rozvíjejí během pěti minut a přetrvávají méně než 60 minut s plnou reverzibilitou. Typicky se projeví jeden symptom odpovídající dané oblasti zasažené mozkové kůry. Kratší délka trvání je zásadním diferenciačním faktorem mezi migrénou s aurou a atakou RS. Dalším důležitým symptomem přispívajícím k diagnóze migrény je následný rozvoj typických bolestí hlavy do 60 minut od příznaků aury. Diferenciální diagnostika migrény a relapsu RS může být obzvláště komplikovaná při prolongaci příznaků aury déle než tři hodiny nebo absenci nástupu migrenózní bolesti hlavy.
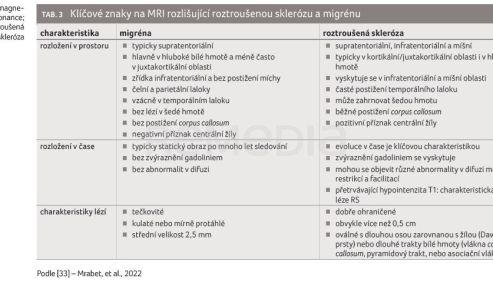 Současné výzkumy se aktuálně snaží o podrobnou interpretaci změn na magnetické rezonanci mozku (MRI) u pacienta s migrénou bez komorbidity RS. Zásadní pro stanovení diagnózy RS zůstává splnění specifických radiodiagnostických kritérií v korelaci s klinickým nálezem (tab. 2, 3) [33].
Současné výzkumy se aktuálně snaží o podrobnou interpretaci změn na magnetické rezonanci mozku (MRI) u pacienta s migrénou bez komorbidity RS. Zásadní pro stanovení diagnózy RS zůstává splnění specifických radiodiagnostických kritérií v korelaci s klinickým nálezem (tab. 2, 3) [33].
Epilepsie
Mezi další časté komorbidity migrény se řadí epilepsie, jejíž vazba s migrénou by se dala popsat jako obousměrná. Epileptický paroxysmus může souviset s rozvojem migrenózní ataky, stejně tak migrenózní ataka s rozvojem epileptického záchvatu. Prevalence migrény je přítomna u 8–24 % pacientů s epilepsií, z čehož vyplývá, že jsou ohroženi až dvojnásobným rizikem oproti běžné populaci [34]. Současná klinická manifestace bolesti hlavy a epilepsie může vést k vzájemnému prolínání jejich symptomů. Příkladem může být vizuální aura před záchvatem nebo postiktální bolest hlavy. Společný výskyt obou onemocnění se zejména vyskytuje u FHM. U této formy onemocnění byly identifikovány tři zásadní genetické mutace v genech CACNA1A (FHM1), ATP1A2 (FHM2) a SCN1A (FHM3), které se všechny podílejí na vzniku iontových transportérů a jsou pravděpodobně zodpovědné za zvýšení hodnoty glutamátu v neuronech [35]. Fenomén šíření kortikální deprese u migrény s aurou podněcuje po hyperexcitabilitě depolarizační blok, který nastoluje dlouhotrvající neuronální depresi. Depolarizační blok byl zaznamenán také u iktální, interiktální a postiktální epileptické aktivity [36]. Vzhledem k faktu, že profylaktické užívání antiepileptické medikace prokazatelně snižuje četnost migrenózních atak, to svědčí o jejich patofyziologickém propojení [37].
Závěr
Existuje mnoho patofyziologických mechanismů, které mohou objasnit vazbu migrény s dalšími nemocemi. Důslednou anamnézou můžeme odkrýt spouštěče migrenózních atak a zároveň včas identifikovat současný výskyt dalších onemocnění, jejichž brzké rozpoznání může vést k rychlejšímu a efektivnějšímu určení léčebné strategie. To nám mimo eliminaci míry zátěže na zdravotní stav pacienta umožní také mírnit dopady na celkovou kvalitu života ve smyslu omezení kariérní seberealizace a rodinné pohody. Léčba migrény ve spojení s komorbidními stavy si tedy žádá obezřetný a striktně individualizovaný přístup.
MUDr. Ľubica Joppeková1,2; MUDr. Hana Záhumenská2
1 Lékařská fakulta Masarykovy univerzity v Brně; 2 Neurologická klinika FN Brno
Literatura
[1] Andlin‑Sobocki P, Jönsson B, Wittchen HU, et al. Cost of disorders of the brain in Europe. Eur J Neurol 2005; 12: 1–27.
[2] Jensen R, Stovner LJ. Epidemiology and comorbidity of headache. Lancet Neurol 2008; 7: 354–361.
[3] Goadsby PJ. Mechanisms and Mangement of Headache. J Royal Coll Physicians Lond 1999; 33: 228–234.
[4] Stewart WF, Wood C, Reed ML, et al. Cumulative lifetime migraine incidence in women and men. Cephalalgia 2008; 28: 1170–1178.
[5] Feigin VL, Nichols E, Alam T, et al. Global, regional, and national burden of neurological disorders, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol 2019; 18: 459–480.
[6] Pelzer N, de Boer I, van den Maagdenberg AMJM, Terwindt GM. Neurological and psychiatric comorbidities of migraine: Concepts and future perspectives. Cephalalgia 2023; 43: 3331024231180564.
[7] Merikangas KR, Angst J, Isler H. Migraine and psychopathology. Results of the Zurich cohort study of young adults. Arch Gen Psychiatry 1990; 47: 849–853.
[8] Romo‑Nava F, Blom T, Cuellar‑Barboza AB, et al. Revisiting the bipolar disorder with migraine phenotype: Clinical features and comorbidity. J Affect Disord 2021; 295: 156–162.
[9] Rist PM, Schürks M, Buring JE, et al. Migraine, Headache and the Risk of Depression: Prospective Cohort Study. Cephalalgia 2013; 33: 1017–1025.
[10] Ashina S, Serrano D, Lipton RB, et al. Depression and risk of transformation of episodic to chronic migraine. J Headache Pain 2012; 13: 615–624.
[11] Louter MA, Bosker JE, van Oosterhout WPJ, et al. Cutaneous allodynia as a predictor of migraine chronification. Brain 2013; 136: 3489–3496.
[12] van Casteren DS, Verhagen IE, Onderwater GL, et al. Sex differences in prevalence of migraine trigger factors: A cross‑sectional study. Cephalalgia 2021; 41: 643–648.
[13] Celano CM, Freudenreich O, Fernandez‑Robles C, et al. Depressogenic effects of medications: a review. Dialogues Clin Neurosci 2011; 13: 109–125.
[14] Orlova Y, Rizzoli P, Loder E. Association of Coprescription of Triptan Antimigraine Drugs and Selective Serotonin Reuptake Inhibitor or Selective Norepinephrine Reuptake Inhibitor Antidepressants With Serotonin Syndrome. JAMA Neurol 2018; 75: 566–572.
[15] Raffaelli B, Fitzek M, Overeem LH, et al. Clinical evaluation of super‑responders vs. non‑responders to CGRP(‑receptor) monoclonal antibodies: a real‑world experience. J Headache Pain 2023; 24: 16.
[16] Schiano di Cola F, Caratozzolo S, Liberini P, et al. Response Predictors in Chronic Migraine: Medication Overuse and Depressive Symptoms Negatively Impact Onabotulinumtoxin‑A Treatment. Front Neurol 2019; 10: 678.
[17] Charles A, Pozo‑Rosich P. Targeting calcitonin gene‑related peptide: a new era in migraine therapy. Lancet 2019; 394: 1765–1774.
[18] Lipton RB, Cohen JM, Galic M, et al. Effects of fremanezumab in patients with chronic migraine and comorbid depression: Subgroup analysis of the randomized HALO CM study. Headache 2021; 61: 662–672.
[19] Nozari A, Dilekoz E, Sukhotinsky I, et al. Microemboli may link spreading depression, migraine aura, and patent foramen ovale. Ann Neurol 2010; 67: 221–229.
[20] Koppen H, Palm‑Meinders IH, Mess WH, et al. Systemic right‑to‑left shunts, ischemic brain lesions, and persistent migraine activity. Neurology 2016; 86: 1668.
[21] Øie LR, Kurth T, Gulati S, et al. Migraine and risk of stroke. J Neurol Neurosurg Psychiatry 2020; 91: 593–604.
[22] Chan KY, Vermeersch S, de Hoon J, et al. Potential mechanisms of prospective antimigraine drugs: a focus on vascular (side) effects. Pharmacol Ther 2011; 129: 332–351.
[23] Razzaque Z, Pickard JD, Ma QP, et al. 5‑HT1B‑receptors and vascular reactivity in human isolated blood vessels: assessment of the potential craniovascular selectivity of sumatriptan. Br J Clin Pharmacol 2002; 53: 266–274.
[24] Cameron C, Kelly S, Hsieh SC, et al. Triptans in the acute treatment of migraine: a systematic review and network meta‑analysis. Headache 2015; 55: 221–235.
[25] Frąk W, Wojtasińska A, Lisińska W, et al. Pathophysiology of cardiovascular diseases: new insights into molecular mechanisms of atherosclerosis, arterial hypertension, and coronary artery disease. Biomedicines 2022; 10: 1938.
[26] Catella‑Lawson F, Reilly MP, Kapoor SC, et al. Cyclooxygenase inhibitors and the antiplatelet effects of aspirin. N Engl J Med 2001; 345: 1809–1817.
[27] Rubio‑Beltran E, Chan KY, Danser AJ, et al. Characterisation of the calcitonin gene‑related peptide receptor antagonists ubrogepant and atogepant in human isolated coronary, cerebral and middle meningeal arteries. Cephalalgia 2020; 40: 357–366.
[28] Argunhan F, Brain SD. The vascular‑dependent and ‑independent actions of calcitonin gene‑ related peptide in cardiovascular disease. Front Physiol 2022; 13: 833645.
[29] Busillo V, Pizza V, Cassano D, et al. Headache and multiple sclerosis. PharmacologyOnLine 2014; 70: 68–72.
[30] Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17: 162–173.
[31] Fraser CL, Hepschke JL, Jenkins B, et al. Migraine Aura: Pathophysiology, Mimics, and Treatment Options. Semin Neurol 2019; 39: 739–748.
[32] Viana M, Sances G, Linde M, et al. Clinical features of migraine aura: Results from a prospective diary‑aided study. Cephalalgia 2017; 37: 979–989.
[33] Mrabet S, Wafa M, Giovannoni G. Multiple sclerosis and migraine: Links, management and implications. Mult Scler Relat Disord 2022; 68: 104152.
[34] Rogawski MA, Migraine and epilepsy‑Shared mechanisms within the family of episodic disorders. In: Avoli M, Noebels JL, Rogawski MA, et al. Jasper’s Basic Mechanisms of the Epilepsies, Oxford University Press, 2012.
[35] Hoffmann J, Charles A. Glutamate and Its Receptors as Therapeutic Targets for Migraine. Neurotherapeutics 2018; 15: 361–370.
[36] Mantegazza M, Cestèle S. Pathophysiological mechanisms of migraine and epilepsy: Similarities and differences. Neurosci Lett 2018; 667: 92–102.
[37] Demarquay G, Rheims S. Relationships between migraine and epilepsy: Pathophysiological mechanisms and clinical implications. Rev Neurol (Paris) 2021; 177: 791–800.
Léčba migrény u specifických skupin pacientů
V průběhu prvního dne odborné akce MHM zazněla řada inspirativních sdělení z praxe v souvislosti s nejnovějšími poznatky v léčbě migrény. Obsahem třetí sekce přednášek, které vedli Dr. Edoardo Caronna (Barcelona, Španělsko), prof. Antonio Russo (Neapol, Itálie) a prof. Gisela Terwindt (Leiden, Nizozemsko), byl management starších pacientů s migrénou a s vyšším kardiovaskulárním rizikem, související terapie pacientů užívajících další léky a možné lékové interakce a léčba migrény u mladších pacientů, dětí a těhotných žen.
Migréna u seniorů a pacientů s komorbiditami
Je známo, že migréna u seniorů se projevuje jinak než u mladších pacientů. Jejich léčba vyžaduje zvláštní pozornost vzhledem k chronické medikaci, současným dalším onemocněním a také s věkem souvisejícím fyziologickým změnám.
V populaci seniorů je bolest hlavy související s migrénou častěji bilaterální s menším podílem fotofobie nebo fonofobie. Aura se může častěji vyskytovat bez bolesti hlavy samostatně a imitovat tak jiná onemocnění spojená s ložiskovým neurologickým deficitem, zejména cévní mozkovou příhodu nebo fokální epileptický záchvat. Podle některých zdrojů se po překročení věku 55 let může 6% prevalence aury bez rozvoje bolesti hlavy zvýšit na 16 %. K tomu všemu může u seniorů docházet k rozvoji bolesti hlavy během noci a spánku, a to až v 60 % migrenózních záchvatů. V tom případě se hovoří o tzv. hypnagogické bolesti hlavy (hypnic headache) [1].
Prevalence migrény u starších pacientů postupně klesá. Zatímco tato prevalence je nejvyšší u žen ve věku 18–44 let a činí 23,5 % [2], u seniorek klesá k 10 % [3]. Zároveň může docházet k přechodu akutní migrény do chronické. Objevení migrény jako nového onemocnění u pacientů starších 55 let vyžaduje zbystření pozornosti a pomyšlení na sekundární bolest hlavy v souvislosti s možným tumorem, velkobuněčnou arteriitidou nebo cévní mozkovou příhodou.
Z léčebného hlediska přístup k seniorům vyžaduje pozornost z důvodu přítomnosti přidružených onemocnění, která jsou farmakologicky léčena a zvyšuje se tím pravděpodobnost lékových interakcí. Vhodná je eliminace léků ze skupiny opioidů a barbiturátů. Dlouhodobé užívání léků ze skupiny nesteroidních antirevmatik a opioidů zvyšuje riziko rozvoje bolesti hlavy z nadužívání léků (medication overuse headache, MOH). Je důležité sledovat frekvenci bolestí hlavy a včas iniciovat preventivní léčbu. Obecně se mluví při titrování preventivní terapie migrény u seniorů o úzkostlivém hledání minimální účinné dávky. Profylaktická léčba betablokátory může u seniorů způsobovat únavu, závratě, zhoršení bradykardie. Antidepresiva, zejména tricyklická, mohou navozovat sedaci, ortostatickou hypotenzi a zvyšovat riziko pádu. Užití nesteroidních analgetik a antiflogistik může narazit na limitace u antikoagulovaných pacientů zvýšením rizika krvácení. Antiepileptika užívaná v profylaxi migrény, jako jsou valproát a topiramát, mohou vyvolávat u seniorů kognitivní zhoršení nebo zvyšovat míru osteoporózy. Proto je ve starší populaci kladen ve větší míře důraz na nefarmakologické postupy léčby migrény. Jsou jimi behaviorální terapie, biofeedback, fyzikální léčba a úprava životosprávy. V akutní farmakologické léčbě se více obracíme k paracetamolu. Hypnagogická bolest hlavy seniorů může dobře odpovídat na akutní i preventivní konzumaci kofeinu například ve formě silného šálku kávy. V profylaktické léčbě se snižuje dávka betablokátorů na minimum nebo se dává přednost blokátorům kalciového kanálu, např. verapamilu. Antiepileptika a tricyklická antidepresiva vyžadují bedlivé monitorování stavu pacienta. Otázka triptanů v akutní terapii a anti‑CGRP (calcitonin gene‑related peptide) terapie v profylaxi je u seniorů zajímavá. Tématu byla věnována zvláštní pozornost v rámci třetí sekce MHM.
Triptany, anti‑CGRP monoklonální protilátky a gepanty u starších a polymorbidních pacientů
Narůstající kardiovaskulární riziko u seniorů hraje významnou roli. V této souvislosti byly diskutovány anti‑CGRP monoklonální protilátky a jejich vztah ke zvýšenému krevnímu tlaku. Erenumab může zvyšovat krevní tlak, a tím i riziko rozvoje cévní mozkové příhody, které vzrůstá až o 10 %. Proto je třeba na toto u starší populace myslet a volit přednostně fremanezumab, který na krevní tlak vliv nemá. V další části sdělení byly zmíněny gepanty jako neutrální ve vztahu ke kardiovaskulárnímu riziku čili bezpečné i ve starší populaci, a to jak v akutní terapii, tak v profylaxi. Triptany se dle nových sdělení ukazují u seniorů rovněž jako bezpečné a nezvyšují kardiovaskulární riziko ani v případě jejich nadužívání. Není tedy nutné se v této populaci triptanů vzdávat. Obecně je kardiovaskulární riziko ve starší populaci vyšší a léčeny by měly být obecné rizikové faktory, jimiž jsou hypertenze, dyslipidemie, diabetes mellitus, obezita a kardiovaskulární onemocnění.
V další části sdělení byla pozornost věnována managementu léčby migrény u polymorbidních pacientů. Anti‑CGRP monoklonální protilátky jsou relativně kontraindikovány u pacientů s jiným autoimunitním onemocněním. V této populaci pacientů stojí za zvážení atogepant jako alternativní postup k preventivní léčbě monoklonálními protilátkami.
Obstipace představuje u seniorů častou potíž. Léčba erenumabem vykazuje obstipaci jako jeden z nežádoucích účinků, lék tedy není u seniorů v případě těchto potíží nejvhodnější volbou.
Migréna u mladších pacientů
Je obecně známo, že projevy migrény u dětí se liší od projevů v dospělé populaci. Migréna u dětí se může projevit epizodickými příznaky, k nimž patří abdominální bolest a epizodické zvracení a pro něž se nedaří nalézt vysvětlující příčinu. Může se také projevit opakovanými závrativými stavy a vertigem ve velmi mladém věku, již u batolete. Postupně se příznaky transformují do příznaků typičtějších pro migrénu v dospělém věku. U adolescentů se objevuje bolest hlavy související s migrénou s prevalencí 6 %. Svojí intenzitou jsou projevy stejně závažné jako u dospělých, nicméně mohou trvat kratší dobu. Bolesti hlavy jsou často oboustranné temporální nebo frontální. Setkáme se také s nespecifickými příznaky, jako jsou únava, potíže s koncentrací, intolerance fyzické námahy apod.
Aura je také odlišná. Častěji se projevují příznaky korelující s kmenovými oblastmi. Pozorujeme vertigo, tinnitus, diplopii, ataxii, mohou nastat alterace vědomí, parestezie, dysartrie, poruchy sluchu, poruchy zorného pole různého typu. Příznaky aury by měly ustoupit do 60 minut. V případě bazilární aury není zjištěna motorická léze. Zániková motorická léze je kritériem pro familiární hemiplegickou migrénu. Aura může být také přítomna včetně zrakových, senzorických příznaků a zvracení. Při prvním výskytu se vždy vylučuje sekundární bolest hlavy.
Status migrenosus s trváním přes 72 hodin je u dětí velmi vzácný, nikoliv ale vyloučený. Zvlášť v případě nových potíží je nutné pomýšlet na sekundární bolest hlavy. U ní jsou významné zvyšující se frekvence a tíže bolesti hlavy během krátké doby, rovněž věk dítěte nižší než 12 let, nebo dokonce 7 let, a další příznaky jako křeče, absence horečky nebo pro migrénu svou povahou netypické změny zraku a sluchu.
Děti a těhotné ženy
Většina rodičů dítěte s migrénou se obvykle obává mozkového nádoru nebo jiného závažného patologického stavu. Nejdříve je proto důležité jak dítě, tak rodiče dobře informovat o diagnóze a pohovořit o předpokládaném vývoji migrény a jejích měnících se projevech v průběhu dospívání a dospělosti.
V další části se přednášející dotkli specifik léčby migrény u mladých pacientů. V preventivní terapii byl zdůrazněn význam topiramátu a gabapentinu ze skupiny antiepileptik, z antidepresiv pak amitriptylin v nízké dávce 5–10 mg, též betablokátory. Studie s anti‑CGRP monoklonálními protilátkami v preventivní léčbě u dětí v současné době probíhají.
Podle sdělení v jednom z workshopů profesorky Pozo‑Rosich a Dr. Caronny je propranolol u žen během těhotenství bezpečné podávat až do konce druhého trimestru. Také sumatriptan v akutní léčbě je v průběhu gravidity bezpečný. Uplatňuje se lokální terapie anestetiky a botulotoxinem.
Triptany u dětí v akutní léčbě lze použít bezpečně, schválena je celá řada triptanů pro adolescenty ve věku 12–17 let, včetně tabletových forem almotriptanu, eletriptanu, rizatriptanu a formy nazálního spreje zolmitriptanu jak ve Spojených státech amerických, tak v Evropě. V USA je schválen rizatriptan také pro děti ve věku 6–11 let. Užití nesteroidních antirevmatik, jako je ibuprofen, naproxen nebo kyselina acetylsalicylová, v nejkratší možné době od rozvoje bolesti hlavy je u dětí a adolescentů možné. Nutnost užití akutní terapie častěji než dvakrát týdně je indikací ke zvážení profylaktické léčby. V této je topiramát u dětí ve věku 12–17 let schválen k užití v USA.
Závěr
V rámci třetí sekce MHM byl diskutován měnící se pohled na triptany v populaci seniorů a rovněž dětí a těhotných žen, nová role gepantů, specifika léčby anti‑CGRP monoklonálními protilátkami ve starší populaci a riziko lékových interakcí narůstající s věkem.
Celé letošní odborné setkání pak kontinuálně zdůrazňovalo hlavní téma roku 2024, jímž je nutnost přehodnocení pravidel úhrady léčby anti‑CGRP monoklonálními protilátkami ve všech zúčastněných evropských zemích. Ve světle poznatků o existenci opožděných respondérů a ultra opožděných respondérů na léčbu anti‑CGRP monoklonálními protilátkami se zdá být revize úhrady nutná proto, aby o tuto moderní léčbu nebyla ochuzena řada pacientů s migrénou, kteří z ní mohou mít také prospěch.
MUDr. Robert Rezek
Neurologické oddělení, Nemocnice Písek a.s.
Literatura
[1] ICHD‑3 criteria for hypnic headache. The International Classification of Headache Disorders, 3rd edition (beta version). Cephalalgia 2013; 33: 629–808.
[2] Burch RC, Loder S, Loder E, Smitherman TA. The prevalence and burden of migraine and severe headache in the United States: updated statistics from government health surveillance studies. Headache 2015; 55: 21–34. Erratum in: Headache 2015; 55: 356.
[3] Wijeratne T, Tang HM, Crewther D, Crewther S. Prevalence of Migraine in the Elderly: A Narrated Review. Neuroepidemiology 2019; 52: 104–110.
Ohlédnutí za sérií kazuistik
Sobotní dopoledne MHM začalo blokem kazuistik s názvem „Praktické pohledy na léčbu migrény zaměřenou na molekuly ovlivňující CGRP dráhu“ (Practical perspectives in migraine management with CGRP pathway targeting treatments) pod vedením profesorky Patricie Pozo‑Rosich (Barcelona, Španělsko).
Kazuistika 1: Perzistence a výsledky léčby
První kazuistiku prezentovala profesorka Cristina Tassorelli (Pavia, Itálie) a věnovala se problematice ženy s postupným selháním perorální preventivní terapie a vývoji migrény v čase.
Kazuistika ženy (42 let), která trpí migrénou bez aury, jinak zcela zdravá, architektka a matka dvou dětí s počátkem migrenózní cefaley v 17 letech na střední škole, ukazuje možný časový vývoj migrény při nedostatečném zvládnutí preventivní terapie. Částečné zhoršování tíže a frekvence záchvatů u pacientky začalo ve věku mezi 20–30 lety. Další významná progrese nastala ve třetí dekádě života po dvou porodech. Nikdy nebyl identifikován spouštěč záchvatů. Klinickému stavu ale dominovalo progresivní snížení odpovědi na akutní terapii. Při první návštěvě centra pro bolesti hlavy pacientka trpěla 14–18 migrénami měsíčně (monthly migraine days, MMD) a užívala v rozmezí 10–12 dnů v měsíci triptany (často několikrát denně). Z triptanů na stavy účinkoval pouze eletriptan, další dva užívané v minulosti postupně ztratily účinnost. Když pacientka neužívala triptany, záchvaty zvládala nesteroidními antirevmatiky (NSAID). Perorální profylaxi započala při 12 MMD a postupně vyzkoušela několik profylaktik. První topiramát byl na migrénu bez efektu, druhý amitriptylin vykazoval pokles ve frekvenci záchvatů, ale musel být vysazen pro nežádoucí účinky. Z uvedených informací vyplývá, že se pacientka pohybovala na hraně stavu s bolestmi hlavy z nadužívání medikace (medication overuse headache, MOH).
Po prezentaci tohoto úvodu byly vyřčeny dvě řečnické otázky: Zabránila by správná optimalizace akutní terapie (kombinace triptanů a analgetik) postupnému zhoršování stavu? A pokud by byla profylaxe zahájena dříve než při 12 MMD, měla by pacientka lepší odpověď na terapii?
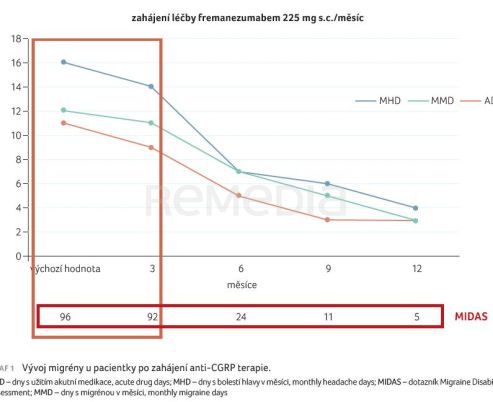 Pacientka byla nakonec převedena na anti‑CGRP (calcitonin gene‑related peptide) terapii fremanezumabem v dávce 225 mg s podáním 1× měsíčně. Profesorka Tassorelli následně pokračovala prezentací odpovědi na léčbu v čase. Graf 1 ukazuje závislost počtu MMD, MHD (monthly headache days) a ADD (acute drug days) na časové ose v měsících s paralelním hodnocením subjektivního stavu dotazníkem MIDAS (Migraine Disability Assessment). Vidíme zlepšení hodnot u všech parametrů závislých na čase, avšak jen velmi pozvolné. Po prvních třech měsících užívání fremanezumabu u pacientky dochází jen k nepatrnému poklesu, k 50% redukci počtu MMD a MHD dochází až ve 12. měsíci léčby, nicméně subjektivní prožívání stavu měřené dotazníkem MIDAS se výrazně zlepšuje (z 96 na 24 bodů) už po šesti měsících.
Pacientka byla nakonec převedena na anti‑CGRP (calcitonin gene‑related peptide) terapii fremanezumabem v dávce 225 mg s podáním 1× měsíčně. Profesorka Tassorelli následně pokračovala prezentací odpovědi na léčbu v čase. Graf 1 ukazuje závislost počtu MMD, MHD (monthly headache days) a ADD (acute drug days) na časové ose v měsících s paralelním hodnocením subjektivního stavu dotazníkem MIDAS (Migraine Disability Assessment). Vidíme zlepšení hodnot u všech parametrů závislých na čase, avšak jen velmi pozvolné. Po prvních třech měsících užívání fremanezumabu u pacientky dochází jen k nepatrnému poklesu, k 50% redukci počtu MMD a MHD dochází až ve 12. měsíci léčby, nicméně subjektivní prožívání stavu měřené dotazníkem MIDAS se výrazně zlepšuje (z 96 na 24 bodů) už po šesti měsících.
Uvedená kazuistika vyzdvihla potřebnost perzistence vedení terapie u komplikovaných pacientů s velmi postupnou odpovědí na anti‑CGRP terapii a poukázala na nedostatky hodnocení onemocnění při pouhém počítání MMD.
Dostupné údaje z randomizovaných klinických a observačních studií ukázaly, že anti‑CGRP monoklonální protilátky mají rychlý nástup účinku (mezi 1 týdnem až 3 měsíci). Této skutečnosti se také v mnohých zemích přizpůsobily úhradové podmínky. Nicméně údaje ze studií reálné praxe ukázaly, že u nezanedbatelného počtu pacientů (13,5–20 %) může dojít k terapeutické odpovědi až po více než třech měsících [1,2] a ze zahájené terapie mohou tito pacienti dlouhodobě profitovat.
Kazuistika 2: Přerušení, pozastavení, switching a opakování
Ve druhé prezentaci se profesor Peter J. Goadsby (Londýn, Spojené království) věnoval kazuistice ženy středního věku s migrénou bez aury. Anamnesticky byly záchvaty bolesti hlavy typicky jednostranně pulzující s fotofobií a fonofobií. Jako doprovodný příznak se vyskytovaly vzácnější autonomní projevy, a to oboustranné slzení či periorbitální edém. Pacientka dokázala také jasně identifikovat prodromy, jako jsou změny nálady, únava, horší koncentrace či bolesti za krkem. Anamnesticky nebyly přítomny jiné komorbidity kromě hyperlipidemie. Celková kvalita života byla významně snížena při pravidelných 20 MHD při perorální profylaktické terapii. Pacientka vyzkoušela v první řadě propranolol, pizotifen, amitriptylin, a po selhání byl bez efektu nasazen také topiramát. Zkoušela i jiné metody, například aplikaci botulotoxinu typu A či lokální blokádu okcipitálního nervu. Vše dlouhodobě bez přínosu pro její stav.
Změna nastala po převedení na anti‑CGRP terapii erenumabem v dávce 140 mg. Po třech měsících se celkový počet MMD snížil z 9 na 3 a MHD z 20 na 8. Nicméně po šesti měsících od začátku terapie došlo k opětovnému nárůstu k původním hodnotám (MMD 10, MHD 22).
Profesor Goadsby následně nechal hlasovat publikum o názoru na další vedení terapie. Sám nakonec volil switching s odstupem tří měsíců na jinou monoklonální protilátku (fremanezumab 225 mg s podáním 1× měsíčně), po němž byl u pacientky zaznamenán prospěch z léčby bez potíží, se setrvalou redukcí pod 50 % původních hodnot.
Sám přednášející dává přednost switchingu mezi monoklonálními protilátkami a věří, že u významného podílu non‑respondérů či parciálních respondérů může být tento postup přínosem.
Prozatím je k dispozici jen několik studií zaměřujících se na účinnost switchingu u non‑respondérů či parciálních respondérů s omezeným počtem pacientů. Z dostupných dat ale vyplývá, že switching mezi monoklonálními protilátkami je bezpečný a pro určitou skupinu nemocných může být dlouhodobě přínosný – některá data naznačují více než 30% redukci počtu MMD v prvních třech měsících od switchingu u 45 % pacientů [3,4].
Léčba pacientů s migrénou a nadužíváním medikace
Poslední sdělení přednesla profesorka Patricia Pozo‑Rosich (Barcelona, Španělsko) a zabývala se přístupem k pacientům s bolestmi hlavy a nadužíváním medikace. Hned na počátku prezentovala začarovaný kruh pacienta, ze kterého se nemocný těžce sám dokáže dostat. Hlavními pilíři problému jsou ve zkratce nedostatečná odpověď na preventivní terapii, často s nereálným očekáváním ze strany pacienta, společně s postupnou chronifikací migrény vedoucí k frustraci a k uchylování se k nadužívání léčiv akutní terapie, které opětovně zhoršuje účinnost zavedené preventivní medikace.
Prvním a základním bodem pro to, jak se dostat z kruhu ven, je dle profesorky Pozo‑Rosich nutnost edukace. Edukace jak samotného pacienta, tak široké odborné veřejnosti. Navrhuje přenést spoluodpovědnost za vlastní zdraví na pacienta a příkladně mu problém nadužívání léčiv a jeho důsledky vysvětlit i s pomocí záznamového deníku. Výhodou je také psychologická podpora či rozhovor s pacienty se stejnými potížemi (tzv. shared experience). U odborné veřejnosti významně doporučuje právě práci se záznamovým deníkem a jeho pravidelné kontroly spolu s motivujícím pohovorem směrem k nemocnému. Také obecně upozornila na riziko komercializace problémových a návykových léčiv.
Druhým bodem je pak rozhodnutí, zda u pacienta zahájit profylaktickou terapii bez omezení akutní medikace, nebo nejprve detoxikovat (omezit nadužívanou akutní medikaci nebo ji vyměnit za jinou lékovou skupinu) a nasadit profylaktickou terapii případně s odstupem. Zatím neexistuje jednoznačné doporučení, který postup zvolit, a mnohdy se jedná o vzájemnou dohodu mezi lékařem a pacientem [5]. Ovšem musíme mít na paměti, že přísná detoxikace může přinést pacientovi další psychické potíže a stres, a tedy ne pro všechny nemocné je optimální volbou. Z dostupných dat prozatím vyplývá, že mezi oběma přístupy není významný rozdíl v konečném efektu na snížení počtu MMD a MHD [6]. Rovněž profesorka Pozo‑Rosich prezentovala data, která ukazují, že nadužívání medikace u pacientů není prediktivním faktorem odpovědi na anti‑CGRP terapii.
Třetím bodem managementu nadužívání léčiv je pravidelná kontrola a vedení. Přednášející sdílela několik příběhů svých pacientů, u kterých volila jako první přístup s detoxikací. Většina těchto nemocných se shodla, že nejhorší byly počátky přerušení užívání medikace, nicméně po důkladné edukaci a opakované motivaci ze strany lékaře a s pomocí rodiny a přátel své těžkosti po několika týdnech překonali.
Na konci svého sdělení se profesorka Pozo‑Rosich věnovala otázce gepantů – malých molekul cílících na CGRP dráhu a užívaných jak v akutní, tak v preventivní terapii migrény. Právě s nízkým biologickým poločasem těchto molekul a jejich užíváním na denní bázi vyvstala otázka, zda nebudou indukovat bolest hlavy z nadužívání medikace. Z dostupných dat, která přednášející představila, vyplývá, že pravidelné užívání gepantů je z tohoto hlediska spíše bezpečné a zvýšené riziko nadužívání nehrozí. Nicméně podotkla, že se jedná o novější molekuly a bude jistě potřeba dlouhodobější sledování [7].
MUDr. David Mikolajek
Centrum pro diagnostiku a léčbu bolestí hlavy, Městská nemocnice Ostrava
Literatura
[1] Barbanti P, Aurilia C, Egeo G, et al. Late Response to Anti‑CGRP Monoclonal Antibodies in Migraine: A Multicenter Prospective Observational Study. Neurology 2023; 101: 482−488.
[2] Lambru G, Caponnetto V, Hill B, et al. Long‑term Effect of Switching From an Anti‑CGRP Receptor to an Anti‑CGRP Ligand Antibody in Treatment‑Refractory Chronic Migraine: A Prospective Real‑World Analysis. Neurotherapeutics 2023; 20: 1284–1293.
[3] Iannone LF, Burgalassi A, Vigani G, et al. Switching anti‑CGRP(R) monoclonal antibodies in multi‑assessed non‑responder patients and implications for ineffectiveness criteria: A retrospective cohort study. Cephalalgia 2023; 43: 3331024231160519.
[4] Suliman R, Santos V, Al Qaisi I, et al. Effectiveness of Switching CGRP Monoclonal Antibodies in Non‑Responder Patients in the UAE: A Retrospective Study. Neurol Int 2024; 16: 274–288.
[5] Ashina S, Terwindt G, Steiner TJ, et al. Medication overuse headache. Nat Rev Dis Primers 2023; 9: 5.
[6] Schwedt TJ, Hentz JG, Sahai‑Srivastava S, et al; MOTS Investigators. Patient‑Centered Treatment of Chronic Migraine With Medication Overuse: A Prospective, Randomized, Pragmatic Clinical Trial. Neurology 2022; 98: e1409–e1421.
[7] Lo Castro F, Guerzoni S, Pellesi L. Safety and Risk of Medication Overuse Headache in Lasmiditan and Second‑Generation Gepants: A Rapid Review. Drug Healthc Patient Saf 2021; 13: 233–240.
Neurostimulace a nervové bloky v léčbě migrény
Jedna z interaktivních lekcí odborné akce MHM v Berlíně se zabývala neurostimulačními metodami a nervovými bloky. Uvedené metody jsou vhodné pro pacienty, kteří jsou na obvyklou léčbu migrény refrakterní nebo nechtějí užívat farmakologickou medikaci.
Úvod
Podle invazivity dělíme neurostimulační metody na invazivní a neinvazivní. Mezi invazivní metody patří periferní nervová stimulace (PNS), jejímž hlavním efektem je blokáda sodíkových kanálů a následné zabránění vzniku akčního potenciálu. Dále snižuje dráždivost nervových C vláken. Kromě toho se tímto procesem nejspíše nastartuje změna uvolňování kyseliny gamaaminomáselné (GABA), CGRP (calcitonin gene-related peptide), substance P, serotoninu a alaninu [1].
V terapii chronické migrény, cluster headache, neuralgie okcipitálního nervu a cervikogenní bolesti hlavy je schválena léčba okcipitálním stimulátorem (ONS). Lokálně ovlivňuje n. occipitalis a přes jeho aferentní vlákna působí na kořen C2 a míšní část jádra n. trigeminus (trigeminocervikální komplex). Centrálně působí na thalamus a jeho projekce do korových oblastí. Jednostranná/oboustranná stripová nebo perkutánní elektroda je implantována do měkkých tkání na fascii v blízkosti n. occipitalis maior. Elektroda je vedena podkožním tunelem ke stimulátoru umístěnému infraklavikulárně nebo thorakálně. Cílem léčby je redukce počtu dní s bolestí hlavy [2].
Neurostimulační neinvazivní metody v léčbě migrény
V terapii migrény převažují především neurostimulační metody neinvazivní. Jednou z těchto metod je TENS (transkutánní elektrická nervová stimulace). Stimulační elektrody se přikládají na kůži a periferní nervový systém je stimulován nepřímo. Dochází k aktivaci endogenního opioidního systému, stimulaci a uvolňování enkefalinů a endorfinů a ke snížení hodnoty substance P. Zvyšuje se také prokrvení v daných oblastech. V léčbě migrény se používá externí stimulátor n. trigeminus (Cefaly/Heada Term). Zařízení vypadá jako čelenka s elektrodou, která se nosí nad kořenem nosu. Užívá se 20 minut denně a slouží k prevenci rozvoje migrény. Přístroj je bezpečný a dobře snášený a u některých pacientů vede ke snížení spotřeby akutní medikace [3].
Další neinvazivní metodou je transkraniální magnetická stimulace (TMS), kterou je možné vyvolat iontové a metabolické změny v oblasti mozkové kůry. Je založena na principu indukce elektrického potenciálu magnetickým polem ve své blízkosti. Indukcí vznikne pulz magnetického pole o velmi vysoké intenzitě (1–2 T), mechanismem Faradayovy indukce vznikne elektrické pole na membránách neuronů a změní se elektrochemický transmembránový potenciál. Dochází nejen k elektrochemickým změnám mozku, ale i ke změně organizace mozkové kůry a dalších částí mozku podílejících se na vnímání chronické bolesti [4]. Na rozdíl od léčby deprese se v léčbě migrény používá přístroj vydávající samostatný pulz o nízké intenzitě. TMS je v léčbě migrény využívána ve formě malého stimulátoru (eNeura), který si pacient aplikuje na kůži v záhlaví ve chvíli, kdy cítí počátek migrény [5]. Je možno jej používat i k prevenci migrény. Kontraindikací k užití TMS je implantace kardiostimulátoru nebo cévního stentu. Jedná se o metodu bezpečnou, mezi nejčastější nežádoucí účinky patří brnění v záhlaví, tinnitus, pocit podrážděnosti nebo únava, bolest hlavy. Účinnost metody není zcela prokázána, výsledky studií nejsou zcela konzistentní, nicméně u části pacientů je efekt doložen.
Dalším certifikovaným zařízením pro akutní i preventivní léčbu migrény je vzdálená elektrická neuromodulace Nerivio (remote electrical neuromodulation, REN). Zařízení se upevňuje na paži nemocného, ovládá se chytrým telefonem a stimulace trvá 45 minut. V akutním užití se přístroj aplikuje v auře nebo na začátku migrény, k profylaktické léčbě se používá obden. Zařízení vysílá elektrickou vlnu navrženou tak, aby aktivovala nociceptivní receptory, působí na centrum bolesti v mozkovém kmeni a reguluje endogenní systém vnímání bolesti.
Intenzita vstupního proudu je individuální. Léčba je americkým Úřadem pro kontrolu potravin a léčiv (FDA) schválena od roku 2023 u dospělých a adolescentů. Zařízení je bezpečné, dobře tolerované a u části pacientů účinné [6].
Poslední metodou je transkraniální stimulace stejnosměrným proudem (tDCS). Systém používá katodu a anodu, obě elektrody se přiloží na hlavu a nízkým proudem (0,029–0,08 mA/cm2) se stimuluje přímo na povrchu lebky. Anodová stimulace zvyšuje kortikální vzrušivost, zatímco katodová stimulace ji snižuje [7].
Dále můžeme neinvazivně stimulovat periferní nervy. Nejčastěji se jedná o trigeminální nerv a bloudivý nerv. Schválený přístroj se jmenuje GammaCore a přikládá se v léčbě migrény na krk, na oblast n. vagus 2–3× denně po dobu dvou minut. Předpokládá se, že stimulace bloudivého nervu blokuje dráhy vedoucí bolest a při dlouhodobém používání by mělo dojít k redukci počtu dní s bolestí hlavy. Jako nežádoucí účinek může pacient pociťovat brnění nebo svalové záškuby. Kontraindikací k použití je kardiostimulátor [8]. Dalším přístrojem je Relivion, který stimuluje jak okcipitální, tak trigeminální nerv.
Nervové bloky
Následně prezentované téma představovaly nervové bloky. Nejčastěji používaným blokem je n. occipitalis maior (GON). GON lze lokalizovat povrchově jako bod v jedné třetině (mediálně) mezi týlním výčnělkem (inion) a mastoidním výběžkem, přibližně 2 cm laterálně a 1,5–2,0 cm pod inionem. Týlní tepna obvykle probíhá laterálně od GON, a to je třeba mít na paměti [9,10]. K obstřiku se používá anestetikum (lidokain, bupivakain) a kortikoid (depomedrol). Mezi možné nežádoucí účinky patří krvácení v místě obstřiku, alergická reakce na aplikovanou látku, anestezie nebo infekce v místě aplikace. Tato metoda je běžně užívána u pacientů s cluster headache, je však možno ji použít i v indikaci chronické migrény. Další možností je například blok supraorbitální (SON). Tyto metody mohou být užity u pacientů s nedostatečným efektem běžných analgetik, jako přídavná terapie nebo během těhotenství.
Závěr
 Stimulační metody a nervové blokády jsou alternativní metody, jež mohou najít uplatnění u pacientů, kteří nepreferují klasickou farmakologickou léčbu nebo u nich tato léčba není dostačující nebo není tolerována. Všechny neinvazivní přístroje jsme si mohli během workshopu na vlastní kůži vyzkoušet. Přístroje jsou bezpečné a dobře tolerované (obr. 1A–G). Ohledně účinnosti jsou data horší. Publikované studie nejsou zcela konzistentní a kontrolní skupiny v nich prakticky neexistují. Do budoucna jsou potřebné další studie srovnávající účinnost těchto metod s metodami farmakologickými. Nevýhodou přístrojů je také jejich nedostupnost na evropském trhu (vyjma Velké Británie) a vysoká pořizovací cena. Nicméně pokud se dostanou do České republiky, u části pacientů jistě své uplatnění najdou.
Stimulační metody a nervové blokády jsou alternativní metody, jež mohou najít uplatnění u pacientů, kteří nepreferují klasickou farmakologickou léčbu nebo u nich tato léčba není dostačující nebo není tolerována. Všechny neinvazivní přístroje jsme si mohli během workshopu na vlastní kůži vyzkoušet. Přístroje jsou bezpečné a dobře tolerované (obr. 1A–G). Ohledně účinnosti jsou data horší. Publikované studie nejsou zcela konzistentní a kontrolní skupiny v nich prakticky neexistují. Do budoucna jsou potřebné další studie srovnávající účinnost těchto metod s metodami farmakologickými. Nevýhodou přístrojů je také jejich nedostupnost na evropském trhu (vyjma Velké Británie) a vysoká pořizovací cena. Nicméně pokud se dostanou do České republiky, u části pacientů jistě své uplatnění najdou.
MUDr. Petra Migaľová
Centrum pro diagnostiku a léčbu bolestí hlavy, Neurologická klinika FN Ostrava
Literatura
[1] Buschmann D, Oppel F. Peripheral nerve stimulation for pain relief in CRPS II and phantom‑limb pain. Schmerz 1999; 13: 113–120.
[2] https://www.cardion.cz/stimulace‑okcipitalniho‑nervu
[3] https://americanmigrainefoundation.org/resource‑library/understanding‑migrainecefaly‑for‑migraine‑prevention
[4] Hirayama A, Saitoh Y, Kishima H, et al. Reduction of intractable deaf‑ferentation pain by navigation‑guided repetitive transcranial magnetic stimulation of the primary motor cortex. Pain 2006; 122: 22–27.
[5] https://eneura.co.uk
[6] Monteith TS, Stark‑Inbar A, Shmuely S, et al. Remote electrical neuromodulation (REN) wearable device for adolescent with migraine: a real‑world study of high‑frequency abortive treatment suggest preventive effects. Front Pain Res (Lausanne) 2023; 4: 1247313.
[7] Fricová J. Neurostimulační metody v léčbě bolesti. Neurol praxi 2013; 14: 244–246.
[8] https://www.gammacore.com
[9] https://www.webmd.com/migraines‑headaches/transcranial‑magnetic‑stimulation‑tms‑migraine
[10] https://www.medicalnewstoday.com/articles/nerve‑blocks‑for‑migraine
Rozdíly v léčbě migrény a preference pacientů
V rámci velkého eventu MHM 2024 profesor Antonio Russo z Itálie a profesorka I. P. Martins z Portugalska vedli menší, ale přínosný workshop na téma rozdíly v léčbě migrény a preference pacientů v souvislosti s medikací. Účastníci workshopu prezentovali rozmanitost pohledů a různé zajímavé zkušenosti, protože své poznatky mohli sdílet neurologové z Rakouska, Slovenska, Polska, Slovinska, Španělska, Norska, Itálie, Chorvatska i z České republiky.
Anti‑CGRP monoklonální protilátky – preference a adherence k léčbě, přerušení terapie
Prvním bodem tohoto workshopu byla otázka, zda pacient s migrénou obecně preferuje monoklonální protilátky proti CGRP (calcitonin gene‑related peptide) a zda se o eventuální nasazení takové léčby aktivně zajímá. Všichni přítomní se shodli, že odpověď je určitě ano. Důvodů, proč si pacient často přeje být léčen anti‑CGRP monoklonálními protilátkami, je celá řada. Jak uvedl profesor Russo, dle povědomí laické veřejnosti jde o cílenou specifickou medikaci. Dále záleží na tom, jestli je pacient řádně informován; očekávání laiků ve smyslu efektivity léčby jsou u této terapie vyšší v porovnání se starší perorální medikací; někteří nemocní také referují nepříjemné pocity, pokud jim lékař v souvislosti s migrénou předepíše antidepresivum.
Profesor Russo zdůraznil, že máme dnes štěstí v tom, že pro pacienty trpící migrénou je k dispozici specifická a účinná terapie, která je navíc podle dlouhodobých dat dobře tolerována. Upozornil i na své dřívější zkušenosti, že užití antiepileptik nebo některých antidepresiv bylo spojeno s nízkou adherencí k léčbě kvůli nežádoucím účinkům této medikace. Uvedl např. výsledky studie, podle nichž po dobu 12 měsíců terapie konvenčním perorálním preventivním léčivým přípravkem činila adherence méně než 20 %. To představuje problém nejen pro pacienta, ale i pro samotného neurologa, který nemocného sleduje a léčí. Podobnou zkušenost sdílela rovněž profesorka Martins, která v rámci diskuse upozornila na to, že např. u mladého člověka s migrénou, který má zájem studovat, terapie topiramátem často studium komplikuje. Přednášející doporučila posílit komunikaci s pacienty před zahájením léčby a vysvětlovat potenciální rizika a nežádoucí efekty ve vztahu ke konkrétním preferencím nemocného a jeho obavám stran medikace. Profesor Russo diskutoval s přítomnými doporučení, co přesně pacientovi sdělit v případě, že má u něj být zahájena nová medikace. Důraz je kladen především na to, aby nemocný neměl nereálná očekávání.
Velký problém pro pacienty v různých státech EU představuje přerušení anti‑CGRP terapie, neurologové jej však nemohou ovlivnit. Přechodné přerušení léčby monoklonálními protilátkami na dobu 12 měsíců i v případě úspěšnosti této terapie je vyžadováno zdravotními pojišťovnami v některých státech. Podle názoru přednášejícího je takové přerušení pro pacienta velkým problémem, neboť opět snižuje kvalitu jeho života, byť pouze přechodně. České republiky se naštěstí tento problém netýká. Podle profesorky Martins nejde jen o finanční aspekty, ale také o určitou formu nevstřícnosti vůči populaci migreniků, kteří jsou i bez toho jistým způsobem stigmatizovanou skupinou v populaci. Je známo, že přerušení terapie jakoukoliv anti‑CGRP monoklonální protilátkou vede ke zhoršení průběhu migrény. A to jistě nepatří k preferencím pacientů.
Anti‑CGRP monoklonální protilátky – kombinace s jinými léky, způsob aplikace
V rámci uvedeného workshopu byly prezentovány také klinické informace ohledně souběžné kombinace anti‑CGRP monoklonální protilátky a botulotoxinu. Zazněla otázka, zda tuto kombinaci používat u pacientů s těžkým průběhem migrény, případně u nemocných, kteří vnímají efekt jednoho léku, ale přesto by si přáli ještě víc zlepšit kvalitu svého života. Kolegové z Itálie stejně jako kolega z Rakouska a kolegyně ze Slovinska informovali o tom, že tato kombinace je bezpečná a velice efektivní, někdy je však nutné reflektovat její nákladnost. Klinické nadšení z dlouhodobého použití anti‑CGRP monoklonálních protilátek nemá znamenat, že neurolog zapomene na konvenční perorální medikaci v preventivní léčbě migrény. Profesor Russo v této souvislosti referoval vlastní data, která ukazují, že 40 % pacientů léčených anti‑CGRP monoklonální protilátkou by mohlo mít prospěch i z druhého léčivého přípravku ze skupiny perorální preventivní medikace. Určitý praktický terapeutický přínos pro tyto pacienty je vnímán jako výsledek synergismu mezi monoklonální protilátkou, která funguje zejména periferně mimo neurony, a perorálním lékem, který ovlivní receptory centrálně, tj. v neuronech. Jsou rovněž k dispozici vědecká data, která potvrzují bezpečnost různých léčebných kombinací při různém mechanismu účinku.
Diskutováno bylo dále téma, zda pacient řeší způsob aplikace antimigrenózní terapie. Zkušenosti kolegů z různých zemí potvrdily, že anti‑CGRP monoklonální protilátky jsou dle subjektivních sdělení pacientů preferovanou medikací. Nemocní pozitivně hodnotí především fremanezumab z důvodu možnosti jeho kvartální aplikace oproti aplikaci jednou měsíčně. Italští odborníci v případě kvartální aplikace údajně neodhalili ani tzv. wearing‑off efekt (návrat nebo zhoršení klinických symptomů před další plánovanou dávkou léku nebo klinické zlepšení po podání následné dávky). Je však nutné zdůraznit, že pokud se náhle objeví výrazný spouštěč onemocnění, mohou pacienti léčení fremanezumabem nebo jakýmkoliv jiným lékem referovat zhoršení frekvence atak, které ale nijak nesouvisí s lékovou formou nebo způsobem podání.
Závěrem
V následné diskusi se řešily také některé nemedicínské aspekty. Například mladí pacienti v Rakousku či Norsku kladou důraz na udržitelnost balení či aplikátoru různých neurologických léků vzhledem k ekologickým problémům. Tato skupina pacientů preferuje léky s menším dopadem na přírodu. Italské nebo brazilské ženy s migrénou zase výrazně dávají přednost hledisku rizika nadváhy, které je zmiňováno při užívání určitých léčivých přípravků, a jejich preskripci striktně odmítají.
Profesorka Martins a profesor Russo se v závěru workshopu shodli, že v dnešní době je důležité myslet nejen na nutnost nasazení preventivní medikace při migréně, ale i na možné nežádoucí účinky takové léčby. Pacienti by v žádném případě neměli trpět omezujícími nežádoucími účinky antimigrenózní terapie.
MUDr. Evgeni Kavrakov
Neurologické oddělení, Nemocnice Karlovy Vary