Dlouhodobá bezpečnost a snášenlivost anti‑CGRP terapií
Jedna část prezentací odborného setkání Migraine Headache Management 2024 se zaměřila na nástroje pro hodnocení dlouhodobé bezpečnosti a snášenlivosti anti‑CGRP (calcitonin gene‑related peptide) terapie.
Příklad 1: Dlouhodobé otevřené studie
Příkladem z uvedené oblasti je pětiletá open‑label studie s erenumabem v prevenci epizodické migrény [1]. První fází léčby trvající 12 měsíců byla dvojitě zaslepená perioda, kdy pacienti užívali buď placebo, nebo erenumab v dávce 7 mg, nebo 21 mg, nebo 70 mg. Následovala otevřená fáze léčby, v níž zařazení pacienti užívali 70 mg erenumabu po dobu dvou let. Poté byla dávka erenumabu navýšena na 140 mg a pacientům byla podávána po dobu tří let. Z 250 nemocných, kteří postoupili do poslední fáze léčby dávkou erenumabu 140 mg, jich studii dokončilo 214. U pacientů, kteří léčbu v této fázi přerušili, nebyla důvodem neúčinnost terapie; dvě pacientky otěhotněly, tři pacienti měli nežádoucí účinky a 16 pacientů si již nepřálo pokračovat ve studii. Ve dvojitě zaslepené fázi studie došlo k poklesu o 1,5 MMD (monthly migraine days, počet dnů s migrénou v měsíci) během 12 měsíců, ve skupině s placebem pak o 1 MMD. V otevřené fázi s dávkou erenumabu 70 mg byl zaznamenán pokles o 2–3 MMD, v poslední fázi se 140 mg erenumabu byl zjištěn další pokles o 1–1,5 MMD.
Příklad 2: Studie z reálné praxe
Studie fáze IV PEARL prokázala efektivitu fremanezumabu trvající více než 24 měsíců [2]. Této fáze klinického hodnocení se zúčastnilo 574 pacientů, z nichž 148 trpělo epizodickou migrénou a 426 chronickou migrénou. Po měsíci léčby byl pozorován pokles v parametru počtu dnů s migrénou u pacientů s epizodickou migrénou o více než 5 MMD, ve skupině s chronickou migrénou téměř o 7 MMD. Po třech měsících léčby fremanezumabem bylo pozorováno zlepšení ve skupině pacientů s epizodickou migrénou o 7 MMD, ve skupině pacientů s chronickou migrénou o 8 MMD oproti počátečnímu počtu MMD (baseline). V dalších měsících byl pozorován pokračující trend poklesu počtu MMD v obou skupinách, ovšem výraznější byla redukce u skupiny pacientů s chronickou migrénou – v šestém měsíci pokles o 9 MMD, v devátém měsíci o 9,5 MMD a ve 12. měsíci téměř o 10 MMD. Ve skupině pacientů s epizodickou migrénou bylo snížení počtu MMD mezi 3., 6. a 9. měsícem sice pozvolnější, ve srovnání se skupinou pacientů s chronickou migrénou ale v trendu také klesající. Mezi 9. a 12. měsícem u pacientů s epizodickou migrénou byl pokles počtu MMD opět výrazný – o 8 MMD oproti výchozímu stavu. Dalším výstupem ze studie byly výsledky bezpečnosti měřené po šesti měsících: jeden nebo více nežádoucích účinků vykazovalo 25 % pacientů, ale závažný nežádoucí účinek udávalo pouze 2,1 % pacientů ze studie. Pacientů, kteří se pro nežádoucí účinky rozhodli studii přerušit, bylo pouze 2,2 %.
Příklad 3: Postmarketingový dohled
Dle systému hlášení nežádoucích účinků amerického Úřadu pro kontrolu potravin a léčiv (FDA) byl pro čtyři anti‑CGRP monoklonální protilátky sestaven žebříček „top 10“ nejčastějších nežádoucích účinků [3].
Pro erenumab byla nejčastějším nežádoucím účinkem zácpa (17,9 %), následovala bolest v místě vpichu (14 %), dále padání vlasů/alopecie (7 %), krvácení v místě injekce (5,7 %), svalové spasmy (3,8 %), abnormální pocit (3 %), hematom v místě vpichu (3 %), úzkost (2,7 %), zarudnutí v místě vpichu (2,7 %) a otok v místě vpichu (2,6 %).
Pro galkanezumab byla nejčastějším nežádoucím účinkem bolest v místě vpichu (24 %), dále zarudnutí v místě vpichu (5,3 %), následovalo krvácení v místě injekce (4,9 %), svědění v místě vpichu (4 %), otok místa vpichu (3,9 %), reakce v místě vpichu (3,5 %), padání vlasů/alopecie (3,4 %), nárůst hmotnosti (3,1 %), zácpa (2,9 %) a hematom v místě vpichu (2,5 %).
Pro fremanezumab byla nejčastěji pozorovaným nežádoucím účinkem bolest v místě vpichu (13 %), dále zarudnutí místa vpichu (7 %), svědění v místě vpichu (5,4 %), otok místa vpichu (4,4 %), svědění (3,6 %), reakce v místě vpichu (3,2 %), vyrážka (3,2 %), padání vlasů/alopecie (3 %), zarudnutí místa vpichu (2,8 %) a extravazace v místě vpichu (2,8 %).
U eptinezumabu z nežádoucích účinků byla nejčastěji pozorována únava (13,5 %), následovaly pocit podráždění hrdla (9 %), svědění (8,2 %), pocit ucpaného nosu (7,4 %), abnormální pocit (5,6 %), covid‑19 (5,6 %), přecitlivělost (5,1 %), bolest v oblasti orofaryngu (4,1 %), rinorea (3,6 %) a nazofaryngitida (2,8 %).
Příklad 4: Postmarketingová data během těhotenství
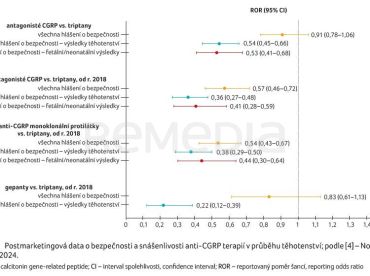 Prostřednictvím globální databáze farmakovigilance Světové zdravotnické organizace (WHO) VigiBase byla srovnávána bezpečnost antagonistů CGRP a triptanů, antagonistů CGRP a triptanů od roku 2018, anti‑CGRP monoklonálních protilátek a triptanů od roku 2018 a bezpečnost gepantů oproti triptanům od roku 2018 (graf 1) [4].
Prostřednictvím globální databáze farmakovigilance Světové zdravotnické organizace (WHO) VigiBase byla srovnávána bezpečnost antagonistů CGRP a triptanů, antagonistů CGRP a triptanů od roku 2018, anti‑CGRP monoklonálních protilátek a triptanů od roku 2018 a bezpečnost gepantů oproti triptanům od roku 2018 (graf 1) [4].
Atogepant není doporučen během těhotenství ani po dobu kojení u žen, které nepoužívají kontracepci [5]. Jako preventivní opatření je preferováno vyhnout se užívání eptinezumabu, erenumabu, fremanezumabu, galkanezumabu a rimegepantu během těhotenství [6–10]. Na zvířecích modelech bylo pozorováno poškození plodu při užívání ubrogepantu [11]. Při předepisování almotriptanu těhotným ženám je potřeba postupovat s opatrností [12]. Eletriptan by měl být v těhotenství používán, pouze pokud je jednoznačně zapotřebí [13]. Frovatriptan není v době gravidity a kojení doporučen u žen, které neužívají kontracepci, jeho užití je možné, pouze pokud by byl jednoznačně zapotřebí [14]. Podání naratriptanu je možné pouze v případě, že očekávaný benefit pro matku je výrazně vyšší než možné riziko pro plod [15]. Užívání rizatriptanu lze uvážit v těhotenství, pouze pokud je to klinicky nezbytné [16]. Podávání sumatriptanu by mělo být zvažováno pouze v případě, že očekávaný prospěch pro matku je výrazně vyšší než možné riziko pro plod [17]. Podávání zolmitriptanu v průběhu gravidity je možné pouze tehdy, převáží‑li očekávaný benefit pro matku potenciální riziko pro plod [18]. Výše uvedená doporučení se v jednotlivých státech mohou lišit.
Příklad 5: Systematická review a metaanalýzy
V této oblasti je příkladem randomizovaná, placebem kontrolovaná studie fáze III (a IIb/III) zaměřená na bezpečnost a snášenlivost monoklonálních protilátek cílících na CGRP a gepantů v prevenci migrény. Do studie byli zařazeni dospělí pacienti s diagnózou migrény dle ICHD‑3 (beta) kritérií, stermínem pro přijetí do studie do 11. února 2022 [19]. Srovnáván je atogepant v dávce 10 mg (poměr šancí [OR] 2,06), 30 mg (OR 1,53), 60 mg (OR 1,82) a 120 mg (OR = 2,22); rimegepant v dávce 75 mg (OR 1,28); eptinezumab v dávce 30 mg (OR 0,96), 100 mg (OR 0,98) a 300 mg (OR 1,11); erenumab v dávce 70 mg (OR 1,27) a 140 mg (OR 1,18); fremanezumab v dávce 225 mg (OR 1,21) a 675 mg (OR 1,20); galkanezumab v dávce 120 mg (OR 1,4) a 240 mg (OR 1,63) oproti placebu.
Další údaje je možno čerpat z databází zdravotních pojišťoven a z pacientských registrů.
Shrnutí
Data o dlouhodobé bezpečnosti a snášenlivosti anti‑CGRP terapií můžeme čerpat z dlouhodobých otevřených studií (open‑label long‑term studies), ze studií z reálné praxe (real‑world studies), z postmarketingového dohledu (post‑marketing surveillance), postmarketingových dat během těhotenství a ze systematických review a metaanalýz. Dále lze data získávat z databází zdravotních pojišťoven a z pacientských registrů. Informace a doporučení ohledně léčby v těhotenství se mohou v jednotlivých státech mírně lišit. Atogepant se jednoznačně nedoporučuje užívat v průběhu gravidity ani po dobu kojení u žen, které nepoužívají kontracepci; dále se doporučuje vyvarovat se užívání eptinezumabu, erenumabu, fremanezumabu, galkanezumabu a rimegepantu během těhotenství.
MUDr. Dana Čtrnáctá
Neurologické oddělení, Ústřední vojenská nemocnice Praha
Literatura
[1] Ashina M, Goadsby PJ, Reuter U, et al. Long‑term efficacy and safety of erenumab in migraine prevention: Results from a 5‑year, open‑label treatment phase of a randomized clinical trial. Eur J Neurol 2021; 28: 1716–1725.
[2] Ashina M, Mitsikostas DD, Amin FM, et al. Real‑world effectiveness of fremanezumab for the preventive treatment of migraine: Interim analysis of the pan‑European, prospective, observational, phase 4 PEARL study. Cephalalgia 2023; 43: 3331024231214987.
[3] Sun W, Li Y, Xia B, et al. Adverse event reporting of four anti‑Calcitonin gene‑related peptide monoclonal antibodies for migraine prevention: a real‑world study based on the FDA adverse event reporting system. Front Pharmacol 2024; 14: 1257282.
[4] Noseda R, Bedussi F, Gobbi C, et al. Calcitonin gene‑related peptide antagonists in pregnancy: a disproportionality analysis in VigiBase®. J Headache Pain 2024; 25: 10.
[5] Aquipta (SmPC). EMA, 2023.
[6] Vyepti (SmPC). EMA, 2024.
[7] Aimovig (SmPC). EMA, 2023.
[8] Ajovy (SmPC). EMA, 2023.
[9] Emgality (SmPC). EMA, 2024.
[10] Vydura (SmPC). EMA, 2024.
[11] Ubralvy (SmPC). FDA, 2023.
[12] Almotriptan (SmPC). MHRA, 2023.
[13] Relpax (SmPC). MHRA, 2024.
[14] Frovatriptan (SmPC). MHRA, 2024.
[15] Naratriptan (SmPC). MHRA, 2024.
[16] Maxalt (SmPC). MHRA, 2024.
[17] Sumatriptan (SmPC). MHRA, 2023.
[18] Zolmitriptan (SmPC). MHRA, 2016.
[19] Messina R, Huessler E‑M, Puledda F, et al. Safety and tolerability of monoclonal antibodies targeting the CGRP pathway and gepants in migraine prevention: A systematic review and network meta‑analysis. Cephalalgia 2023; 43: 3331024231152169.