Rekombinantní technologie – od laboratorních ke klinickým výsledkům
První přednášky sobotního bloku se ujal Dr. Shiv Shanker Gupta, Head of Medical Affairs, Fertility, Europe, společnosti Merck Group.
Komplexnost folikulostimulačního hormonu
Folikulostimulační hormon (FSH) je glykoprotein, který je složen ze dvou podjednotek – α a ß – spojených navzájem nekovalentními vazbami a produkován a secernován adenohypofýzou. FSH stimuluje růst ovariálních folikulů u žen a spermatogenezi u mužů.
Endogenní FSH
Podjednotka α FSH obsahuje 92 aminokyselin a je velice podobná podjednotkám α luteinizačního hormonu (LH), choriového gonadotropinu (hCG) a tyreotropního hormonu (TSH). Podjednotka β obsahuje 111 aminokyselin, je pro FSH jedinečná a určuje jeho imunologickou a funkční specificitu. Hormony FSH a LH regulují růst gonadálních tkání a jejich reprodukční aktivitu. Obě podjednotky FSH mají dvě glykosylační místa. Bioaktivita, imunoreaktivita a cirkulační poločas FSH závisejí na glykoformách ß podjednotek, které mají různé struktury, molekulovou hmotnost a izoelektrické vlastnosti [1].
![OBR. 1 Přehled glykosylace FSH; podle [3] – Lispi, et al., 2023. OBR. 1 Přehled glykosylace FSH; podle [3] – Lispi, et al., 2023.](https://www.remedia.cz/photo-pg-1520---.jpg) Glykosylace probíhá na čtyřech místech s důležitou funkcí. FSH je z hypofýzy vylučován do oběhu jako směs variant, které jsou prakticky identické v primární struktuře, ale liší se, pokud jde o oligosacharidy (glykany) připojené k jádru proteinu (obr. 1) [2,3].
Glykosylace probíhá na čtyřech místech s důležitou funkcí. FSH je z hypofýzy vylučován do oběhu jako směs variant, které jsou prakticky identické v primární struktuře, ale liší se, pokud jde o oligosacharidy (glykany) připojené k jádru proteinu (obr. 1) [2,3].
![OBR. 2 Makroheterogenita FSH – ß N‑glykosylační místa; podle [4,5] – Wang, et al., 2016; Davis, et al., 2014. OBR. 2 Makroheterogenita FSH – ß N‑glykosylační místa; podle [4,5] – Wang, et al., 2016; Davis, et al., 2014.](https://www.remedia.cz/photo-pg-1518---.jpg) Makroheterogenita FSH se mění s věkem (obr. 2) [4,5]. U menopauzálních žen se vyskytuje glykoforma FSHß24, u žen ve věku 21–41 let se vyskytuje glykoforma FSHß21. Větší sekrece estrogenu ve folikulární fázi produkuje méně glykosylované glykoformy [4,5]. Glykosylační profil ß podjednotky FSH se mění v závislosti na věku [1,6].
Makroheterogenita FSH se mění s věkem (obr. 2) [4,5]. U menopauzálních žen se vyskytuje glykoforma FSHß24, u žen ve věku 21–41 let se vyskytuje glykoforma FSHß21. Větší sekrece estrogenu ve folikulární fázi produkuje méně glykosylované glykoformy [4,5]. Glykosylační profil ß podjednotky FSH se mění v závislosti na věku [1,6].
FSH glykosylační molekulární implikace:
- Makroheterogenita – vzestup afinity receptoru FSH (FSHR), vzestup in vitro biologické aktivity, pokles biologického poločasu, pokles plazmatické clearance.
- Mikroheterogenita (antenarita) – při vysokém stupni antenarity pokles vazby FSHR (opožděná receptorová odpověď), při nízkém stupni antenarity vzestup vazby FSHR (rychlá receptorová odpověď).
- Mikroheterogenita (sialylace) – při výskytu více acidických izoforem pokles vazby FSHR, vzestup biologického poločasu, pokles míry eliminace, při výskytu méně acidických izorofem vzestup vazby FSHR, pokles biologického poločasu, vzestup míry eliminace [2–4].
Exogenní FSH
![OBR. 3 Časová osa léků na plodnost; podle [7,8] – Lunenfeld, et al., 2019; Leão, et al., 2014. OBR. 3 Časová osa léků na plodnost; podle [7,8] – Lunenfeld, et al., 2019; Leão, et al., 2014.](https://www.remedia.cz/photo-pg-1517---.jpg) V další části své přednášky zdůraznil Dr. Gupta ve stručnosti výhody působení nových léků na plodnost. Před příchodem technologie rekombinantní DNA byly gonadotropinové přípravky extrahovány z moči. Výrobní metody vyžadovaly sběr obrovského množství moči a vedly k produkci přípravků s různým složením a kontaminací bílkovinami. Rekombinantní gonadotropiny překonávají dřívější omezení, mohou být produkovány ve velkých objemech s vysokou čistotou a stálou konzistencí (obr. 3) [7,8].
V další části své přednášky zdůraznil Dr. Gupta ve stručnosti výhody působení nových léků na plodnost. Před příchodem technologie rekombinantní DNA byly gonadotropinové přípravky extrahovány z moči. Výrobní metody vyžadovaly sběr obrovského množství moči a vedly k produkci přípravků s různým složením a kontaminací bílkovinami. Rekombinantní gonadotropiny překonávají dřívější omezení, mohou být produkovány ve velkých objemech s vysokou čistotou a stálou konzistencí (obr. 3) [7,8].
Při výrobním procesu rekombinantních gonadotropinů je konečný produkt bez proteinů pocházejících z moči a dalších neznámých kontaminantů, s ≥ 99% čistotou a vykazuje vysokou konzistenci mezi šaržemi. Proces je popsán v těchto hlavních bodech: 1. hlavní buněčná banka – unikátní linie živých buněk; 2. buněčná kultura a expanze, 3. výroba buňky v bioreaktorech, 4. následné čištění, 5. charakterizace a stabilita. Výsledným produktem je čistý rekombinantní lidský FSH (r‑hFSH). Vzhledem ke složité výrobě biologického přípravku není možné vytvořit zcela identickou kopii [3,8–11].
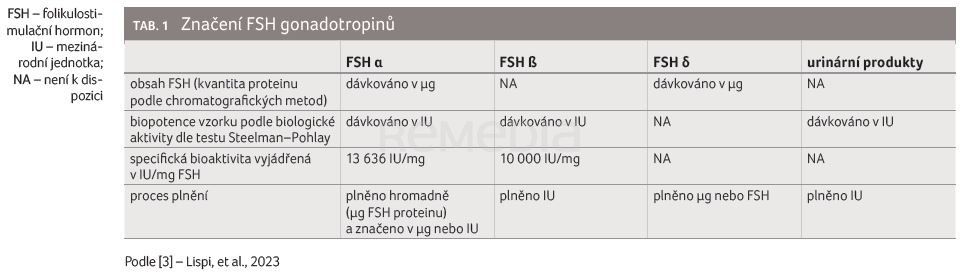 Steelmanův–Pohleyho in vivo biotest je standardním postupem používaným k měření biopotence FSH produktu. Při tomto testování jsou randomizovány 21–22 dnů staré krysí samice, jimž je subkutánně podán hCG jednou za tři dny. Čtvrtý den jsou odebrány a zváženy vaječníky a jsou zpracovávány údaje z testu. Vzhledem ke své vysoké čistotě může být FSH α kvantifikován v mezinárodních jednotkách (IU) a hmotnostně (tab. 1) [3].
Steelmanův–Pohleyho in vivo biotest je standardním postupem používaným k měření biopotence FSH produktu. Při tomto testování jsou randomizovány 21–22 dnů staré krysí samice, jimž je subkutánně podán hCG jednou za tři dny. Čtvrtý den jsou odebrány a zváženy vaječníky a jsou zpracovávány údaje z testu. Vzhledem ke své vysoké čistotě může být FSH α kvantifikován v mezinárodních jednotkách (IU) a hmotnostně (tab. 1) [3].
U originálního FSH α plněného podle hmotnosti byla prokázána významně lepší konzistence mezi jednotlivými šaržemi, což vedlo ke zkrácení léčby a přesnějšímu dávkování ve srovnání s plněním po IU [3,8,12].
Endogenní a exogenní FSH – shrnutí
Folikulostimulační hormon je z hypofýzy vylučován do oběhu jako směs variant. Heterogenita FSH závisí na přítomnosti koncové kyseliny sialové a komplexnosti sacharidů.
Složení glykoformy FSH se mění s věkem:
- v průběhu přirozeného menstruačního cyklu,
- během nástupu puberty,
- v menopauze.
Vzhledem ke složitému výrobnímu procesu biologického přípravku není možné vytvořit zcela identickou kopii. Z důvodu vysoké čistoty může být FSH α kvantifikován v IU a hmotnostně. Glykanová struktura ovlivňuje biologickou aktivitu, vazbu receptorů, poločas rozpadu a clearance FSH [2,3,6].
Biosimilární r‑hFSH α
![OBR. 4 Glykosylace FSH a výroba r‑hFSH; podle [2,13] – Bousfield, et al., 2019; Hua, et al., 2021. OBR. 4 Glykosylace FSH a výroba r‑hFSH; podle [2,13] – Bousfield, et al., 2019; Hua, et al., 2021.](https://www.remedia.cz/photo-pg-1519---.jpg) Souvislosti mezi glykosylací FSH a výrobou r‑hFSH nastiňuje obrázek 4 [2,13].
Souvislosti mezi glykosylací FSH a výrobou r‑hFSH nastiňuje obrázek 4 [2,13].
Biosimilární přípravek je biologický lék vysoce podobný referenčnímu přípravku, bez ohledu na přirozenou variabilitu, která je vlastní všem biologickým lékům. Biosimilars r‑FSH α byly schváleny Evropskou komisí a případně dalšími regulačními orgány na základě příslušných srovnávacích studií prokazujících podobnou účinnost, pokud jde o průměrný počet získaných oocytů a srovnatelnou bezpečnost.
Narození živého dítěte nebylo jako cílový ukazatel zahrnuto do registračních ani do srovnávacích studií. K posouzení klinické účinnosti a potenciálních rozdílů v následných reprodukčních výsledcích mezi referenčním r‑hFSH α a jeho biosimilárním přípravkem jsou zapotřebí přímé klinické studie i real‑world hodnocení [10,14–16].
Příklady biosimilárních přípravků r‑hFSH α jsou Ovaleap – schválen v září 2013, s vyšší sialylací a odlišnou vazbou FSHR – a Bemfola – schválen v březnu 2014 (první biosimilární r‑FSH v Evropě), s vyšší sialylací a antenaritou (tri‑ a tetra‑), potenciálně rezultující v pomalejší cílovou vazbu a opožděnou odpověď. Originální r‑FSH α se od svých biosimilárních přípravků liší na molekulární úrovni. Rozdíly v glykosylaci mohou ovlivnit jak signalizaci FSH, tak metabolickou stabilitu [3,17–22]. Bemfola má vyšší biologickou aktivitu in vivo a vyšší variabilitu mezi šaržemi oproti původnímu r‑hFSH α (8,3 % vs. 5,8 %). To by mohlo být způsobeno objemnějšími glykanovými strukturami a vyšší sialylací, což naznačuje, že Bemfola by měla mít delší biologický poločas, a tedy in vivo vyšší čistou účinnost ve srovnání s originálním r‑hFSH [22].
![GRAF 1 Charakteristika biosimilárních molekul; podle [23] – Manzi, et al., 2022. GRAF 1 Charakteristika biosimilárních molekul; podle [23] – Manzi, et al., 2022.](https://www.remedia.cz/photo-pg-1515---.jpg) Jiná, celosvětová studie charakterizovala a srovnávala originální r‑hFSH α s biologicky podobnými látkami, aby prozkoumala jejich fyzikálně‑chemické a strukturální vlastnosti. Zkoumané vlastnosti zahrnují primární, sekundární a terciární strukturu a také posttranslační modifikace, včetně glykosylace a kontaminantů (graf 1) [23].
Jiná, celosvětová studie charakterizovala a srovnávala originální r‑hFSH α s biologicky podobnými látkami, aby prozkoumala jejich fyzikálně‑chemické a strukturální vlastnosti. Zkoumané vlastnosti zahrnují primární, sekundární a terciární strukturu a také posttranslační modifikace, včetně glykosylace a kontaminantů (graf 1) [23].
Při srovnání referenčního r‑hFSH α oproti biosimilárním přípravkům byla pozorována klesající tendence v místech N‑glykosylace [23]. Biosimilární přípravky vykazovaly celkové biomolekulární strukturální rozdíly ve srovnání s originálním r‑hFSH α a mezi sebou navzájem. Většina biosimilars vykazovala vyšší glykanovou antenaritu, nižší podíl obsazení místa a odlišný obsah kyseliny sialové ve srovnání s referenčním r‑hFSH α.
U některých biosimilars byl zachycen odlišný glykanový vzorec, který může vést k imunogenním reakcím, rovněž byly zaznamenány rozdíly v oxidaci. Celkové rozdíly mezi originálním r‑hFSH α a biosimilars i mezi biosimilars navzájem potvrzují komplexnost molekuly FSH [23].
Klinické výsledky biosimilárních r‑hFSH α
Schválení přípravků v Evropské unii bylo založeno na klinických randomizovaných studiích (RCTs), které porovnávaly účinnost (měřeno počtem získaných oocytů) a bezpečnost biosimilárních léčiv oproti originálnímu přípravku [24,25]. Registrace v EU byla rovněž podpořena metaanalýzou studií [24–28].
Další metaanalýzy se zaměřily na pravděpodobnost narození živého dítěte [29,30]. První metaanalýza zahrnovala pět RCTs, které si jako primární cílový ukazatel stanovily porod živého dítěte (a výsledky těhotenství jako sekundární cílový ukazatel) při léčbě biosimilárními přípravky oproti originálnímu r‑hFSH α. Počet živě narozených dětí, probíhajících a klinických těhotenství u párů léčených biosimilárními přípravky ve srovnání s referenčním přípravkem byl významně nižší [29,30].
V souvislosti s těmito výsledky se nabízí otázka, zda jsou nějaké potenciální rozdíly v přípravě biosimilárního r‑FSH α a originálního přípravku ve vztahu ke kontrolované stimulaci vaječníků. Tím se zabýval systematický screening pěti databází RCTs, který srovnával biosimilární a referenční r‑FSH α. Primárními cílovými ukazateli byly počet získaných oocytů a částečná klinická odpověď. Analýza zahrnula šest RCTs s celkem 1 453 respondenty. Podle výsledků tohoto sledování se počet oocytů neliší (5 RCTs), avšak i zde byla léčba biosimilárními přípravky spojena (na základě středně kvalitní evidence) s nižší pravděpodobností klinického těhotenství [31].
První neintervenční real‑world studie (RWE) porovnávala míru živě narozených dětí (LBR) a kumulativní LBR (cLBR) jako primární cílové ukazatele léčby originálním r‑hFSH α a biologicky podobnými léčivy s využitím dat z francouzské národní zdravotní databáze. Studované kohorty byly vytvořeny na základě typu aplikovaného gonadotropinu: originální r‑hFSH α, r‑FSH ß, urinární přípravky (převážně HP‑hMG, méně u‑hFSH‑HP), biosimilární r‑hFSH α [32]. Byla pozorována o 19 % nižší pravděpodobnost LBR při léčbě biosimilars ve srovnání s originálním r‑hFSH α (p < 0,0001) a o 14 % nižší pravděpodobnost cLBR (p < 0,0001) [32]. Dále byla doložena o 7 % nižší pravděpodobnost LBR při léčbě urinárními přípravky ve srovnání s originálním r‑hFSH α (p < 0,0001) a o 11 % nižší pravděpodobnost cLBR [33]. cLBR byla setrvalá bez ohledu na věk nebo metodu asistované reprodukce [32]. Výsledky uvedené v této studii jsou v souladu také s recentně publikovanou prací [34]. Je však třeba zmínit limity uvedené RWE, např. nedostatek klinických a biologických informací, jako jsou ovariální rezerva, počet získaných oocytů nebo počet přenesených embryí.
Literatura
[1] Bousfield GR, Butnev VY, White WK, et al. Comparison of Follicle‑Stimulating Hormone Glycosylation Microheterogenity by Quantitative Negative Mode Nano‑Electrospray Mass Spectrometry of Peptide‑N Glycanase‑Released Oligosaccharides. J Glycomics Lipidomics 2015; 5: 129.
[2] Bousfield GR, Harvey DJ. Follicle‑Stimulating Hormone Glycobiology. Endocrinology 2019; 160: 1515–1535.
[3] Lispi M, Humaidan P, Bousfield GR, et al. Follicle‑Stimulating Hormone Biological Products: Does Potency Predict Clinical Efficacy? Int J Mol Sci 2023; 24: 9020.
[4] Wang H, Chen X, Zhang X, et al. Comparative Assessment of Glycosylation of a Recombinant Human FSH and a Highly Purified FSH Extracted from Human Urine. J Proteome Res 2016; 15: 923–932.
[5] Davis JS, Kumar TR, May JV, Bousfield GR. Naturally Occurring Follicle‑Stimulating Hormone Glycosylation Variants. J Glycomics Lipidomics 2014; 4: e117.
[6] Dias JA, Ulloa‑Aguirre A. New Human Follitropin Preparations: How Glycan Structural Differences May Affect Biochemical and Biological Function and Clinical Effect. Front Endocrinol (Lausanne) 2021; 12: 636038.
[7] Lunenfeld B, Bilger W, Longobardi S, et al. The Development of Gonadotropins for Clinical Use in the Treatment of Infertility. Front Endocrinol (Lausanne) 2019; 10: 429.
[8] Leão RBF, Esteves SC. Gonadotropin therapy in assisted reproduction: an evolutionary perspective from biologics to biotech. Clinics (Sao Paulo) 2014; 69: 279–293.
[9] Extracted from EMA website “Biosimilars in the EU, Information guide for HCP: https://www.ema.europa.eu/en/documents/leaflet/biosimilars‑eu‑information‑guide‑healthcare‑professionals_en.pdf”. Accessed Feb 2024.
[10] Bergandi L, Canosa S, Carosso AR, et al. Human Recombinant FSH and Its Biosimilars: Clinical Efficacy, Safety, and Cost‑Effectiveness in Controlled Ovarian Stimulation for In Vitro Fertilization. Pharmaceuticals (Basel) 2020; 13: 136.
[11] Orvieto R, Seifer DB. Biosimilar FSH preparations‑ are they identical twins or just siblings? Reprod Biol Endocrinol 2016; 14: 32.
[12] Wikland M, Hugues JN, Howles C. Improving the consistency of ovarian stimulation: follitropin alfa filled‑by‑mass. Reprod Biomed Online 2006; 12: 663–668.
[13] Hua G, George JW, Clark KL, et al. Hypo‑glycosylated hFSH drives ovarian follicular development more efficiently than fully‑glycosylated hFSH: enhanced transcription and PI3K and MAPK signaling. Hum Reprod 2021; 36: 1891–1906.
[14] EMA Guideline on similar biological medicinal products containing biotechnology‑derived proteins as active substance: non‑clinical and clinical issues. Accessed Feb 2024.
[15] Mellstedt H, Niederwieser D, Ludwig H. The challenge of biosimilars. Ann Oncol 2008; 19: 411–419.
[16] Schiestl M, Stangler T, Torella C, et al. Acceptable changes in quality attributes of glycosylated biopharmaceuticals. Nat Biotechnol 2011; 29: 310–312.
[17] Thomas MR, Sparks AE, Ryan GL, Van Voorhis BJ. Clinical predictors of human blastocyst formation and pregnancy after extended embryo culture and transfer. Fertil Steril 2010; 94: 543–548.
[18] Wide L, Eriksson K, Sluss PM, Hall JE. Serum half‑life of pituitary gonadotropins is decreased by sulfonation and increased by sialylation in women. J Clin Endocrinol Metab 2009; 94: 958–964.
[19] Riccetti L, Sperduti S, Lazzaretti C, et al. Glycosylation Pattern and in vitro Bioactivity of Reference Follitropin alfa and Biosimilars. Front Endocrinol (Lausanne) 2019; 10: 503.
[20] EMA. Ovaleap EPAR. https://www.ema.europa.eu/en/documents/overview/ovaleap‑epar‑summary‑public_en.pdf. Accessed Feb 2024.
[21] EMA. Bemfola EPAR. https://www.ema.europa.eu/en/documents/assessment‑report/bemfola‑epar‑public‑assessment‑report_en.pdf Accessed Feb 2024
[22] Mastrangeli R, Satwekar A, Cutillo F, et al. In‑vivo biological activity and glycosylation analysis of a biosimilar recombinant human follicle‑stimulating hormone product (Bemfola) compared with its reference medicinal product (GONAL‑f). PLoS One 2017; 12: e0184139.
[23] Manzi L, Sepe N, Migliaccio W, et al. Comparative Assessment of the Structural Features of Originator Recombinant Human Follitropin Alfa Versus Recombinant Human Follitropin Alfa Biosimilar Preparations Approved in Non‑European Regions. Int J Mol Sci 2022; 23: 6762.
[24] Rettenbacher M, Andersen AN, Garcia‑Velasco JA, et al. A multi‑centre phase 3 study comparing efficacy and safety of Bemfola versus Gonal‑f in women undergoing ovarian stimulation for IVF. Reprod Biomed Online 2015; 30: 504–513.
[25] Strowitzki T, Kuczynski W, Mueller A, Bias P. Randomized, active‑controlled, comparative phase 3 efficacy and safety equivalence trial of Ovaleap® (recombinant human follicle‑stimulating hormone) in infertile women using assisted reproduction technology (ART). Reprod Biol Endocrinol 2016; 14: 1.
[26] Fertility Biotech AG: Phase III Study Comparing Efficacy and Safety of AFOLIA vs Gonal‑f® RFF in Women (35 to 42) Undergoing IVF. U.S. National Library of Medicine; 2012 September. Report No.: NCT01687712. Dostupné na: https://clinicaltrials.gov/ct2/show/NCT01687712. Accessed Feb 2024.
[27] Barakhoeva Z, Vovk L, Fetisova Y, et al. A multicenter, randomized, phase III study comparing the efficacy and safety of follitropin alpha biosimilar and the original follitropin alpha. Eur J Obstet Gynecol Reprod Biol 2019; 241: 6–12.
[28] Hu L, Zhang S, Quan S, et al. Efficacy and safety of recombinant follicle‑stimulating hormone in patients undergoing in vitro fertilization‑embryo transfer. Aging (Albany NY) 2020; 12: 4918–4930. Erratum in: Aging (Albany NY) 2023; 15: 5951–5953.
[29] Chua SJ, Mol BW, Longobardi S, et al. Biosimilar recombinant follitropin alfa preparations versus the reference product (Gonal‑F®) in couples undergoing assisted reproductive technology treatment: a systematic review and meta‑analysis. Reprod Biol Endocrinol 2021; 19: 51.
[30] Venetis CA, Helwig C, Mol BW, et al. Correction: Biosimilar recombinant follitropin alfa preparations versus the reference product (Gonal‑F®) in couples undergoing assisted reproductive technology treatment: a systematic review and meta‑analysis. Reprod Biol Endocrinol 2023; 21: 68.
[31] Youssef M, Abdallah KS. Biosimilar recombinant human FSH (follitropin alpha) for controlled ovarian stimulation in ovulatory women undergone IVF/ICSI cycles? A systematic review and meta‑analysis. 38th Hybrid Annual Meeting of the ESHRE; 3–6 July 2022; Milan, Italy.
[32] Grynberg M, Cedrin‑Durnerin I, Raguideau F, et al. Comparative effectiveness of gonadotropins used for ovarian stimulation during assisted reproductive technologies (ART) in France: A real‑world observational study from the French nationwide claims database (SNDS). Best Pract Res Clin Obstet Gynaecol 2023; 88: 102308.
[33] Grynberg M, et al. 2023; https://doi.org/10.1016/j.bpobgyn.2022. 102308.
[34] Bühler KF, Fischer R, Verpillat P, et al. Comparative effectiveness of recombinant human follicle‑stimulating hormone alfa (r‑hFSH‑alfa) versus highly purified urinary human menopausal gonadotropin (hMG HP) in assisted reproductive technology (ART) treatments: a non‑interventional study in Germany. Reprod Biol Endocrinol 2021; 19: 90.
Kompletní zápis z akce EVOLUTION by Merck 2024 najdete na https://www.remedia.cz/specialy/evolution-by-merck/