Úspěšná a dobře tolerovaná terapie asciminibem u pacienta s chronickou fází CML a se zhoršující se ICHDK v rámci čtvrté linie léčby
Souhrn
Černá O. Úspěšná a dobře tolerovaná terapie asciminibem u pacienta s chronickou fází CML a se zhoršující se ICHDK v rámci čtvrté linie léčby.
Asciminib je nová léčebná modalita pro pacienty s chronickou fází chronické myeloidní leukemie (CML), u kterých došlo k selhání již minimálně dvou linií léčby. Jedná se o první alosterický inhibitor aktivity kinázy BCR::ABL1. Její aktivita je tak tlumena specifickým působením na ABL1 myristoylovou kapsu (STAMP), kde inhibuje působení ABL, která chybí u CML vlivem fúze s BCR. Asciminib působí jen na kinázu ABL1. Má vysokou specifičnost a účinnost i v případě mutací v kinázové doméně, kde léčba ostatními tyrozinkinázovými inhibitory není účinná. Bezpečnostní profil asciminibu je velmi dobrý, toto bylo ověřeno v registrační klinické studii fáze III ASCEMBL.
Klíčová slova: chronická myeloidní leukemie – asciminib – studie ASCEMBL – ischemická choroba dolních končetin.
Summary
Cerna O. Successful and well tolerated fourth‑line asciminib therapy in a patient with chronic phase CML and worsening ischemic lower limb disease.
Asciminib is a new treatment modality for patients with the chronic phase of chronic myeloid leukemia (CML) who have already received at least two lines of treatment. It is the first allosteric inhibitor of BCR::ABL1 kinase activity. Its activity is thus dampened by a specific action on the ABL1 myristoyl pocket, where it inhibits the action of ABL, which is absent in CML‑ABL due to the fusion with BCR. Asciminib acts only on the ABL1 kinase. It has high specificity and effectiveness even in the case of mutations in the kinase domain, where treatment with other tyrosine kinase inhibitors is not effective. The safety profile of asciminib is very good, this was verified in the phase III registration clinical trial, ASCEMBL.
Key words: chronic myeloid leukemia – asciminib – ASCEMBL trial – ischemic lower limb disease.
Úvod
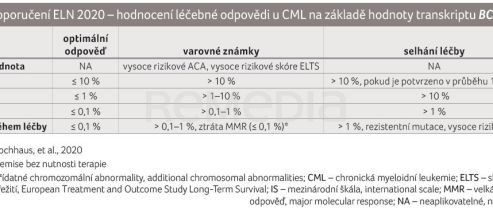
Chronická myeloidní leukemie (CML) je nádorové myeloproliferativní onemocnění. Podstatou je reciproká translokace části ramének mezi chromozomy 9 a 22 a vznik tzv. filadelfského (Ph) chromozomu. Pří této translokaci dochází k vytvoření fúzního genu BCR‑ABL1, kdy se setkají gen ABL1 z chromozomu 9 a BCR z chromozomu 22 a splynou. Fúzní gen BCR‑ABL1 kóduje vznik patologicky aktivované tyrozinkinázy BCR::ABL1 (protein p120), která způsobuje nekontrolovanou proliferaci krvetvorných buněk a snížení proapoptotické schopnosti [1]. Léčba CML zaznamenala v posledních 20 letech výrazné zlepšení a velmi příznivě ovlivnila prognózu pacientů právě díky vývoji molekulární biologie a zavedením cílené protinádorové léčby prvním tyrozinkinázovým inhibitorem (TKI) – imatinibem. Záhy následovalo zavedení dalších TKI druhé a třetí linie – nilotinibu, dasatinibu, bosutinibu, ponatinibu. Všechny tyto TKI mají vazbu na tyrozinkinázu BCR::ABL1 v oblasti, která váže adenosintrifosfát (ATP), a inhibují její fosforylaci. Terapie prostřednictvím TKI se stala léčebným standardem. Díky ní je očekávané dožití pacientů s chronickou fází CML téměř srovnatelné se standardní populací. V léčbě vycházíme z doporučení European LeukemiaNet (ELN) z roku 2020 (tab. 1) [2].
 Úprava těchto doporučení se v letošním roce koncipuje především s ohledem na kvalitu života pacientů. Terapie TKI je dlouhodobá, resp. i trvalá a řada pacientů má více či méně vyjádřené nežádoucí účinky spojené s léčbou, které mohou být obtěžující, ačkoliv ještě nejsou důvodem ke změně terapie. Zvažuje se tedy ev. také redukce terapeutické dávky, intermitentní užívání, to vše dle aktivity onemocnění. Snahou je vysazení léčby s cílem dosažení remise onemocnění bez terapie. Byla a je koncipována celá řada studií zaměřených na možnost vysazování TKI v první i dalších liniích této léčby.
Úprava těchto doporučení se v letošním roce koncipuje především s ohledem na kvalitu života pacientů. Terapie TKI je dlouhodobá, resp. i trvalá a řada pacientů má více či méně vyjádřené nežádoucí účinky spojené s léčbou, které mohou být obtěžující, ačkoliv ještě nejsou důvodem ke změně terapie. Zvažuje se tedy ev. také redukce terapeutické dávky, intermitentní užívání, to vše dle aktivity onemocnění. Snahou je vysazení léčby s cílem dosažení remise onemocnění bez terapie. Byla a je koncipována celá řada studií zaměřených na možnost vysazování TKI v první i dalších liniích této léčby.
U 20–30 % pacientů selhává léčebná odpověď na terapii TKI, a to buď vlivem rezistence na základě vzniku mutací v kinázové doméně BCR::ABL1, nebo vlivem intolerance léčby [3]. Tyto překážky může překonat nová léčebná možnost v podobě asciminibu, jehož působení je odlišné.
![OBR. 1A–C Konstitutivně aktivní kináza BCR::ABL1 a její inhibice asciminibem; podle [4] – Réa, Hughes, 2022.](https://www.remedia.cz/photo-pg-1566---.jpg) Jedná se o první alosterický inhibitor aktivity kinázy BCR::ABL1. Její aktivita je tlumena specifickým působením na ABL1 myristoylovou kapsu (Specifically Targeting the ABL Myristoyl Pocket, STAMP), kde inhibuje působení ABL, které chybí u CML vlivem fúze s BCR. Asciminib působí jen na kinázu ABL1. Má vysokou specifičnost a účinnost i v případě mutací v kinázové doméně, kde léčba ostatními TKI není efektivní (obr. 1) [4]. Bezpečnostní profil asciminibu je velmi dobrý, toto bylo ověřeno v registrační klinické studii fáze III ASCEMBL (obr. 2) [5,6].
Jedná se o první alosterický inhibitor aktivity kinázy BCR::ABL1. Její aktivita je tlumena specifickým působením na ABL1 myristoylovou kapsu (Specifically Targeting the ABL Myristoyl Pocket, STAMP), kde inhibuje působení ABL, které chybí u CML vlivem fúze s BCR. Asciminib působí jen na kinázu ABL1. Má vysokou specifičnost a účinnost i v případě mutací v kinázové doméně, kde léčba ostatními TKI není efektivní (obr. 1) [4]. Bezpečnostní profil asciminibu je velmi dobrý, toto bylo ověřeno v registrační klinické studii fáze III ASCEMBL (obr. 2) [5,6].
![OBR. 2 Uspořádání studie ASCEMBL; podle [5,6] – Patel, et al., 2017; Réa, et al., 2021.](https://www.remedia.cz/photo-pg-1565---.jpg) Tento perorální přípravek je velmi dobře snášen, užívá se v dávce 2× 40 mg denně, či se dávka modifikuje dle nežádoucích účinků (např. cytopenie). Tablety se musejí polykat celé a bez konzumace jídla dvě hodiny před užitím léku a jednu hodinu po něm.
Tento perorální přípravek je velmi dobře snášen, užívá se v dávce 2× 40 mg denně, či se dávka modifikuje dle nežádoucích účinků (např. cytopenie). Tablety se musejí polykat celé a bez konzumace jídla dvě hodiny před užitím léku a jednu hodinu po něm.
Dle Souhrnu údajů o přípravku má asciminib indikaci pro léčbu dospělé populace s chronickou fází CML po selhání minimálně dvou předchozích linií léčby. Přípravek dosud nemá úhradu ze zdravotního pojištění, je tedy nutné schválení úhrady revizním lékařem dle § 16 [7].
Popis případu
U dvaašedesátiletého pacienta byla CML v chronické fázi diagnostikována v červenci 2010 v jeho 51 letech. Podle relativní rizikové stratifikace na základě skóre Sokal, EUTOS a ELTS (European Treatment and Outcome Study [EUTOS] Long‑Term Survival) se jednalo o onemocnění nízce rizikové, klinicky asymptomatické, náhodně zjištěné, bez splenomegalie.
Pacient byl bez komorbidit, bez zátěže v rodinné anamnéze, bez metabolického syndromu, bez obezity. Léčí se jen monoterapií pro hypertenzi a je chronický kuřák.
V srpnu 2010 jsme zahájili standardní léčbu prvoliniovým TKI imatinibem v dávce 400 mg denně. Dne 5. října 2010 bylo dosaženo kompletní hematologické odpovědi, 30. listopadu 2010 kompletní cytogenetické odpovědi i velké molekulární remise. Terapeutickou odpověď bylo možno hodnotit jako optimální. Tolerance léčby imatinibem však byla velmi problematická. V průběhu terapie se stále výrazně zhoršovaly bolesti kostí a svalů, které pacienta limitovaly v pohybu, a výrazně tak zhoršovaly kvalitu života. Podrobným revmatologickým, neurologickým a cévním vyšetřením byla vyloučena jiná etiologie než v souvislosti s léčbou imatinibem. Pacient byl tedy z důvodu intolerance imatinibu na začátku července 2012 převeden na druhou linii léčby nilotinibem perorálně v dávce 2 tbl. à 200 mg dvakrát denně.
Svalové bolesti až křeče se však i při této terapii stupňovaly, a tak při trvající velké molekulární remisi na úrovni MR 4,5 byla dávka nilotinibu snížena od 2. prosince 2012 na poloviční 2× 200 mg/den. Obtíže přetrvávaly i při další redukci dávky nilotinibu za bedlivé monitorace transkriptu BCR::ABL1 a za stále trvající velké molekulární remise bez přítomnosti mutací v kinázové doméně BCR::ABL1. Pacient byl bez vývoje ischemických komplikací, zajištěn antiagregační terapií. Z důvodu intolerance léčby nilotinibem byla zahájena třetí linie léčby TKI dasatinibem od února 2017. Tato terapie však trvala jen velmi krátce a z důvodu těžké gastrointestinální intolerance byla ukončena.
Byla tedy navrácena ještě výrazněji redukovaná dávka nilotinibu 2× 200 mg/den dvakrát týdně za stále trvající velké molekulární remise na úrovni MR 4,5. V září 2021 byla u pacienta diagnostikována závažná ischemická choroba tepen dolních končetin (ICHDK) a významné stenózy femorálních tepen obou dolních končetin. U nemocného byl proveden cévní femoro‑popliteální bypass. Pro okluzi pravé arteria axillaris byl zaveden stent a byla posílena antiagregační terapie.
Z důvodu těchto cévních komplikací byla léčba nilotinibem v listopadu 2022 zcela ukončena. Pacient byl bez léčby TKI a pečlivě monitorován se stále trvající hlubokou molekulární remisí. Svalové a kostní bolesti se zmírnily a cévní komplikace se dále nezhoršovaly.
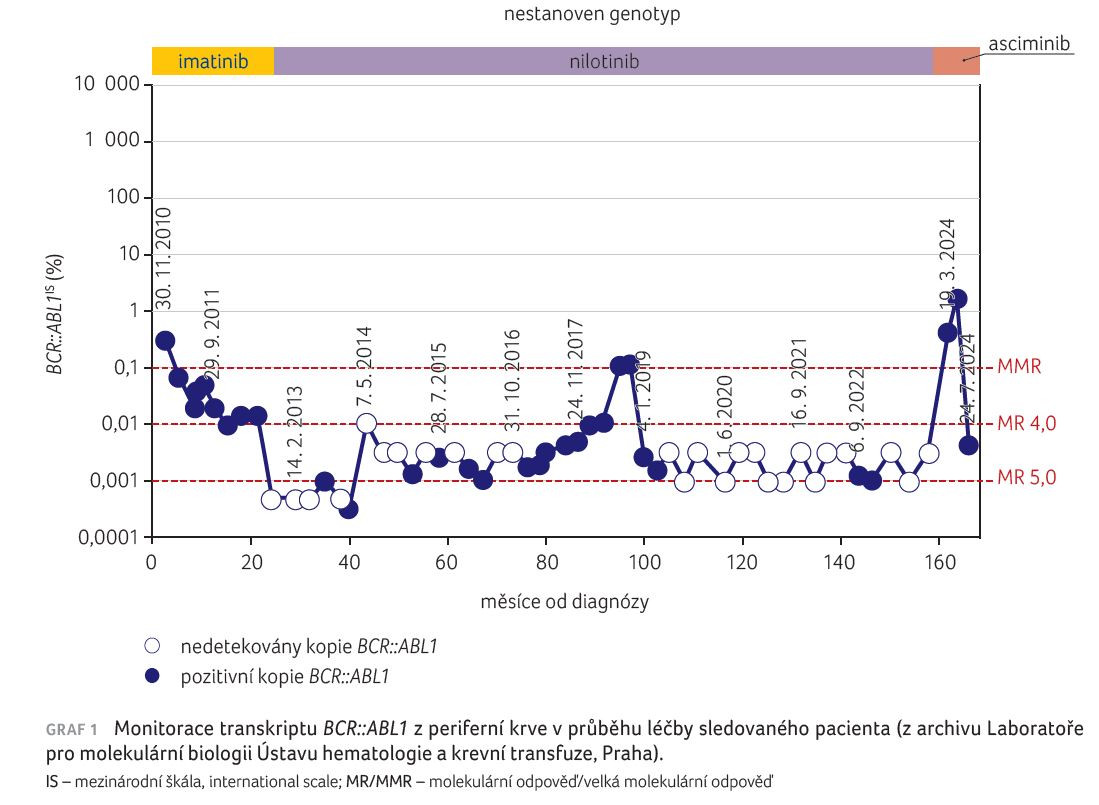 V březnu 2024 došlo k výraznému nárůstu transkriptu BCR::ABL1 (graf 1), ke ztrátě molekulární remise, avšak se stále trvající hematologickou a cytogenetickou remisí, bez průkazu jakýchkoliv mutací v kinázové doméně BCR::ABL1. Indikovali jsme zahájení čtvrté linie léčby nyní již dostupným lékem asciminibem v dávce 2× 40 mg/den. Úhrada léčby byla revizním lékařem zdravotní pojišťovny ihned schválena a terapie byla zahájena 14. května 2024. Pacient léčbu toleroval velmi dobře, neměl žádné nežádoucí účinky, které pozoroval v předchozích léčebných liniích. Byl bez bolestí kostí či svalů, bez zažívacích obtíží, bez vývoje cytopenie i při plném dávkování léku. Ani nehematologická toxicita léčby nebyla zaznamenána a nelimitovala péči. Co je velmi důležité, nezhoršily se ischemické cévní komplikace. Kvalita života pacienta je velmi dobrá, byl a je stále plně pracující. Po třech měsících léčby bylo opět docíleno velké molekulární odpovědi se zcela normálními hodnotami krevního obrazu. Dne 24. července 2024 bylo již znovu dosaženo velké molekulární odpovědi na úrovni MR 4,0. Léčba bez redukce dávky stále úspěšně pokračuje a její úhrada je dále schvalována.
V březnu 2024 došlo k výraznému nárůstu transkriptu BCR::ABL1 (graf 1), ke ztrátě molekulární remise, avšak se stále trvající hematologickou a cytogenetickou remisí, bez průkazu jakýchkoliv mutací v kinázové doméně BCR::ABL1. Indikovali jsme zahájení čtvrté linie léčby nyní již dostupným lékem asciminibem v dávce 2× 40 mg/den. Úhrada léčby byla revizním lékařem zdravotní pojišťovny ihned schválena a terapie byla zahájena 14. května 2024. Pacient léčbu toleroval velmi dobře, neměl žádné nežádoucí účinky, které pozoroval v předchozích léčebných liniích. Byl bez bolestí kostí či svalů, bez zažívacích obtíží, bez vývoje cytopenie i při plném dávkování léku. Ani nehematologická toxicita léčby nebyla zaznamenána a nelimitovala péči. Co je velmi důležité, nezhoršily se ischemické cévní komplikace. Kvalita života pacienta je velmi dobrá, byl a je stále plně pracující. Po třech měsících léčby bylo opět docíleno velké molekulární odpovědi se zcela normálními hodnotami krevního obrazu. Dne 24. července 2024 bylo již znovu dosaženo velké molekulární odpovědi na úrovni MR 4,0. Léčba bez redukce dávky stále úspěšně pokračuje a její úhrada je dále schvalována.
Shrnutí kazuistiky
Kazuistika demonstruje úspěšnou a velmi dobře tolerovanou léčbu čtvrtou linií TKI po předchozí intoleranci imatinibu, nilotinibu a dasatinibu a při vývoji ischemických cévních komplikací (nejspíše při terapii nilotinibem), které byly důvodem ukončení terapie. Při dlouhotrvající hluboké remisi na úrovni MR 4,5 po 11 letech léčby TKI byla terapie vysazena. Po 14 měsících po ukončení terapie TKI, což odpovídá výsledkům klinických studií s vysazováním TKI, však došlo k relapsu onemocnění. S ohledem na předchozí intoleranci terapie TKI a vzhledem ke komorbiditám při nepřítomnosti mutací v kinázové doméně byla indikována dnes již dostupná nová léčebná modalita asciminibem v plné dávce 2× 40 mg/den perorálně. Léčba byla velmi dobře tolerována, zcela bez nežádoucích účinků a bez zhoršení ischemických komplikací. Terapie byla i z hlediska hematologického velmi efektivní, po třech měsících léčby došlo opět k molekulární remisi onemocnění. Terapie je po celou dobu bez hematologické toxicity, bez redukce dávkování, nadále pokračuje a velmi zlepšila kvalitu života pacienta.
Diskuse
Asciminib je indikován pro léčbu dospělé populace s chronickou fází chronické myeloidní leukemie po selhání minimálně dvou předchozích linií léčby. Jedná se o první alosterický inhibitor aktivity kinázy BCR::ABL1. Její aktivita je tlumena specifickým působením na ABL1 myristoylovou kapsu (STAMP), kde inhibuje působení ABL, které chybí u CML vlivem fúze s BCR. Asciminib působí pouze na kinázu ABL1. Má vysokou specifičnost a účinnost i v případě mutací v kinázové doméně [6]. U 20–30 % pacientů léčebná odpověď na terapii tyrozinkinázovými inhibitory selhává, a to buď vlivem rezistence na základě vzniku mutací v kinázové doméně BCR::ABL1, nebo vlivem intolerance léčby. To může překonat nová léčebná možnost v podobě terapie asciminibem, jehož působení je odlišné. Bezpečnostní profil asciminibu je velmi dobrý, toto bylo ověřeno v registrační klinické studii fáze III ASCEMBL [6].
Účinnost a bezpečnost léku potvrzuje také uvedená kazuistika. Lze se domnívat, že v popisovaném případě by možnost dřívějšího využití terapie asciminibem mohla ev. zabránit vývoji ischemických komplikací, které se rozvinuly při léčbě nilotinibem, či je zmírnit, a výrazně tak zlepšit kvalitu života pacienta.
MUDr. Olga Černá
Hematologická klinika 3. LF UK a FN Královské Vinohrady
Ruská 87, 100 00 Praha 10
e‑mail: olga.cerna@vfn.cz
Literatura
[1] Hirji I, Gupta S, Goren A, et al. Chronic myeloid leukemia (CML): association of treatment satisfaction, negative medication experience and treatment restrictions with health outcomes, from the patient's perspective. Health Qual Life Outcomes 2013; 11: 167.
[2] Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020; 34: 966–984.
[3] Jabbour E, Parikh SA, Kantarjian H, Cortes J. Chronic myeloid leukemia: mechanisms of resistance and treatment. Hematol Oncol Clin North Am 2011; 25: 981‑v.
[4] Réa D, Hughes TP. Development of asciminib, a novel allosteric inhibitor of BCR‑ABL1. Crit Rev Oncol Hematol 2022; 171: 103580.
[5] Patel AB, OʼHare T, Deininger MW. Mechanisms of Resistance to ABL Kinase Inhibition in Chronic Myeloid Leukemia and the Development of Next Generation ABL Kinase Inhibitors. Hematol Oncol Clin North Am 2017; 31: 589–612.
[6] Réa D, Mauro MJ, Boquimpani C, et al. A phase 3, open‑label, randomized study of asciminib, a STAMP inhibitor, vs bosutinib in CML after 2 or more prior TKIs. Blood 2021; 138: 2031–2041.
[7] SPC Scemblix. Dostupné na: https://www.ema.europa.eu/cs/documents/product‑information/scemblix‑epar‑product‑information_cs.pdf
Kompletní ZASTŘENO Asciminib najdete na https://www.remedia.cz/specialy/zaostreno-asciminib/