Vývoj preimplantačního genetického testování a reprodukční genetiky v poslední dekádě
Tématu preimplantačního genetického testování věnoval svůj příspěvek Mgr. Jakub Horák, Ph.D., z pracoviště GNTlabs by GENNET, Praha.
Přednášející zahájil svoji prezentaci otázkou, co může genetika nabídnout pacientovi podstupujícímu in vitro fertilizaci (IVF). Jsou to především odpovědi na otázky, proč je pacient azoospermik, proč má pacientka předčasné ovariální selhání, co je důvodem selhání oplození atd. Genetika se pokouší najít kauzální příčinu těchto stavů. Klinická hodnota těchto odpovědí je však poněkud sporná, protože pacientům většinou nemohou pomoci vyřešit daný problém.
Dále genetika nabízí prekoncepční testování prováděné před IVF nebo před početím, jímž lze vyšetřit karyotyp, provést screening recesivních mutací, zabývat se genetickým reprodukčním rizikem páru, případně rizikem nežádoucích účinků včetně hyperstimulačního syndromu. Preimplantační genetické testování pak slouží k výběru životaschopných embryí a těch bez rizika rozvoje genetických onemocnění. Prenatální péče zahrnuje velkou oblast neinvazivního prenatálního testování a také invazivní kaskádové vyšetření od polymerázové řetězové reakce (PCR) až po SNP array (celogenomový screening s 1 000krát větší rozlišovací schopností pro nebalancované aberace než karyotyp).
Vývoj metod genetického testování
V cytogenetice jsme se posunuli od mikroskopu ke skenování vzorků a máme k dispozici analýzu obrazu vedenou umělou inteligencí (AI); v molekulární genetice pak od PCR nebo Sangerova sekvenování k sekvenování nové generace (NGS). Preimplantační genetické testování v případě aneuploidie prošlo evolucí od FISH array k dnešnímu NGS. U monogenních chorob se používala metoda PCR založená na STR markerech (analýza krátkých tandemových repetic), nyní lze využít karyomapping založený na SNP (jednonukleotidový polymorfismus). U každého takového laboratorního oboru je alfou a omegou automatizace a digitalizace procesů.
Základem prekoncepčního vyšetření před IVF cyklem by stále mělo být cytogenetické vyšetření karyotypu, aktuálně má velký význam vyšetřování recesivních mutací v DNA. „Každý z nás je nositelem zhruba pěti nebo šesti patogenetických recesivních mutací, a pokud potkáme partnera, který nese mutaci ve stejném genu, máme 25% šanci na narození dítěte s autozomálně recesivním onemocněním,“ vysvětlil doktor Horák. Cílem carrier testování založeného na exomu je snížit riziko narození dítěte s genetickým onemocněním z populační četnosti 1 : 100 na 1 : 1 000. Jakým způsobem toho efektivně dosáhnout a kolik genů bychom měli testovat? Lidský genom má 20 000–25 000 genů, z toho klinicky významných je asi 5 000 – postačuje tedy exom reprezentující kódující sekvence tohoto počtu genů. Dále je v případě carrier testování přínosné používat panel s menším počtem genů (113 vs. 450), neboť tyto vybrané geny mají vyšší riziko přenašečství – 1 : 200. Tímto způsobem zachytíme víc párů, které uvedené riziko mají. Při testování většího počtu genů je vyšetření sice komplexní, ale můžeme zabřednout do interpretačních potíží směrem k pacientovi. V praxi se přesto provádějí oba typy testování, protože nejsou finančně náročné a umožní individualizovat vyšetření (např. pokud už byl jeden z páru vyšetřen jiným panelem) a dobrý matching dárce gamety s příjemcem.
Výhodná je volba virtuálních panelů, jejichž prostřednictvím můžeme mj. hledat kauzální mutace pro genetická onemocnění dle genetické indikace. Při znalosti kauzální mutace pak lze pacientům nabídnout preimplantační genetické testování (PGT).
Preimplantační genetické testování
PGT je záležitostí vyšetřování blastocysty 5. až 6. den embryonálního vývoje, pro něž je nutné období přibližně jeden měsíc a následně je embryo transferováno. Využívají se dvě základní technologie: NGS a SNP array. Testují se rovněž aneuploidie všech chromozomů z toho důvodu, že s věkem pacientů klesá četnost narozených dětí (od 35. roku se exponenciálně zvyšují aneuploidie). Už ve věku 30 let zaznamenáváme zhruba 20 % aneuploidií. U vyšetření embrya v případě monogenních chorob je tedy vhodné testovat i aneuploidie, abychom toto riziko pokryli.
PGT u monogenních chorob (PGT‑M)
 Karyomapping jako nepřímá DNA diagnostika dokáže vyšetřit aneuploidie, je univerzálně použitelná u jakéhokoliv genetického onemocnění pro jakékoliv místo genomu. Jedná se o obecně aplikovatelný postup, kdy se referenční vzorky srovnávají s embryi a označuje se míra rizika. „Nevýhodou této metody je její finanční náročnost. Na našem pracovišti jsme proto SNP arraye vyměnili za levnější, software za rychlejší a přesnější a metodu jsme určitým způsobem resuscitovali,“ uvedl přednášející.
Karyomapping jako nepřímá DNA diagnostika dokáže vyšetřit aneuploidie, je univerzálně použitelná u jakéhokoliv genetického onemocnění pro jakékoliv místo genomu. Jedná se o obecně aplikovatelný postup, kdy se referenční vzorky srovnávají s embryi a označuje se míra rizika. „Nevýhodou této metody je její finanční náročnost. Na našem pracovišti jsme proto SNP arraye vyměnili za levnější, software za rychlejší a přesnější a metodu jsme určitým způsobem resuscitovali,“ uvedl přednášející.
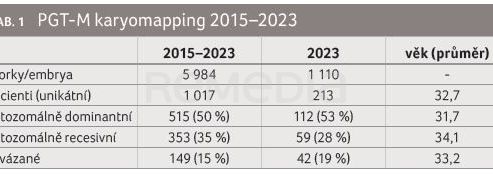
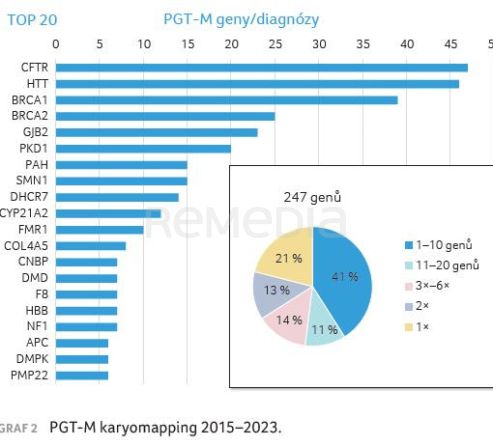
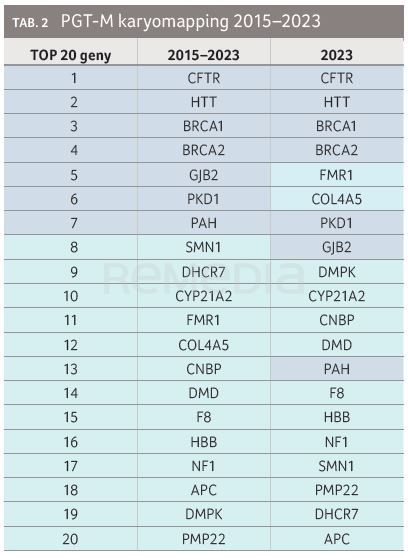 Na pracovišti GNTlabs by GENNET bylo touto metodou v letech 2015–2023 vyšetřeno přes 1 000 pacientů (tab. 1, 2, graf 1A, B, 2).
Na pracovišti GNTlabs by GENNET bylo touto metodou v letech 2015–2023 vyšetřeno přes 1 000 pacientů (tab. 1, 2, graf 1A, B, 2).
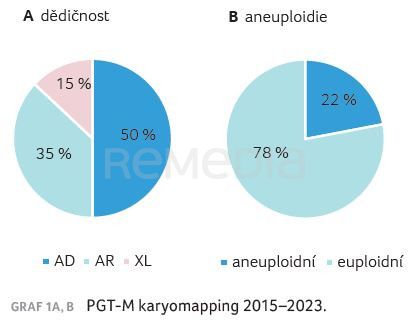 Typický pacient nemá autozomálně recesivní onemocnění. K vyšetření PGT‑M přichází nemocný s dominantní chorobou s pozdním nástupem, popř. s fenotypem nebo projevem, který není výrazně život ohrožující, ale pro pacienta je nepříjemný. Toto onemocnění nechce předat svému potomstvu, avšak nejedná se rozhodně o indikaci k ukončení těhotenství. Pacienti jsou ve věku nižším než 35 let s frekvencí aneuploidie 22 %. Za uvedené období byl PGT‑M karyomapping proveden pro 247 různých genů. U přibližně 50 % cyklů PGT‑M se jedná o unikátní diagnózy, pro něž by nebylo finančně a organizačně možné provádět PGT‑M jiným testem vyžadujícím individuální design.
Typický pacient nemá autozomálně recesivní onemocnění. K vyšetření PGT‑M přichází nemocný s dominantní chorobou s pozdním nástupem, popř. s fenotypem nebo projevem, který není výrazně život ohrožující, ale pro pacienta je nepříjemný. Toto onemocnění nechce předat svému potomstvu, avšak nejedná se rozhodně o indikaci k ukončení těhotenství. Pacienti jsou ve věku nižším než 35 let s frekvencí aneuploidie 22 %. Za uvedené období byl PGT‑M karyomapping proveden pro 247 různých genů. U přibližně 50 % cyklů PGT‑M se jedná o unikátní diagnózy, pro něž by nebylo finančně a organizačně možné provádět PGT‑M jiným testem vyžadujícím individuální design.
Testování aneuploidií (PGT‑A)
 U pacientů ve věku nad 35 let hraje toto vyšetření klíčovou roli a mělo by být součástí IVF cyklů. Cílem je vyřazení aneuploidních embryí z transferu – využitím PGT‑A se zvyšuje úspěšnost IVF z hlediska četnosti těhotenství na embryotransfer, snižuje se četnost potratů a zkracuje se doba léčby. Vyšetření je multidisciplinární záležitostí, která vyžaduje součinnost gynekologů, embryologů a PGT laboratoře.
U pacientů ve věku nad 35 let hraje toto vyšetření klíčovou roli a mělo by být součástí IVF cyklů. Cílem je vyřazení aneuploidních embryí z transferu – využitím PGT‑A se zvyšuje úspěšnost IVF z hlediska četnosti těhotenství na embryotransfer, snižuje se četnost potratů a zkracuje se doba léčby. Vyšetření je multidisciplinární záležitostí, která vyžaduje součinnost gynekologů, embryologů a PGT laboratoře.
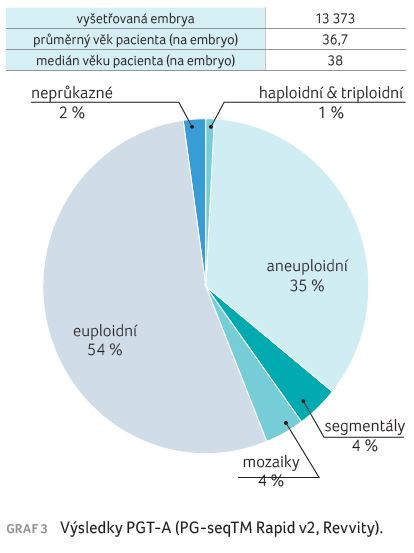 V roce 2014 se rozšířila technologie NGS, která během deseti let také prošla určitým vývojem. Aktuálně oproti počátkům analyzujeme jiné kategorie (graf 3). Snahou je především redukovat oranžové kategorie (klinicky nevýznamné mozaiky) a určitým způsobem přistoupit ke kategorii haploidních a triploidních embryí (fialové).
V roce 2014 se rozšířila technologie NGS, která během deseti let také prošla určitým vývojem. Aktuálně oproti počátkům analyzujeme jiné kategorie (graf 3). Snahou je především redukovat oranžové kategorie (klinicky nevýznamné mozaiky) a určitým způsobem přistoupit ke kategorii haploidních a triploidních embryí (fialové).
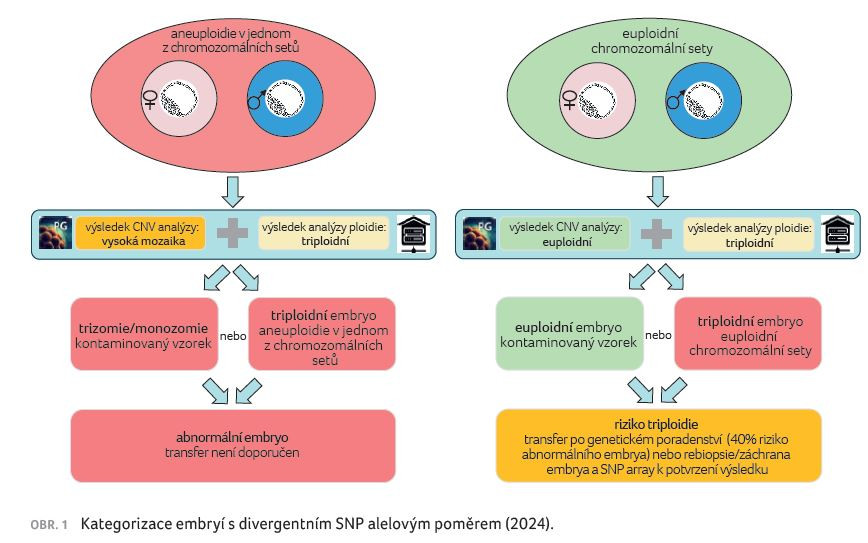 V rámci této tendence aplikujeme zkušenosti ze SNP array do PGT‑A a využíváme SNP analýzy NGS dat, abychom odhalili abnormálně fertilizované vzorky. V roce 2023 jsme tuto metodu použili prospektivně, kombinovali jsme analýzu počtu kopií se SNP analýzou a následně jsme verifikovali 62 embryí, 7 z nich bylo haploidních, 19 triploidních, 60 % vzorků bylo kontaminováno maternální DNA (tato kontaminace mimikuje triploidní stav). V případě aneuploidního pozadí je takto možno pracovat se dvěma hypotézami, které při ověření vždy končí se závěrem patologie, tedy je možné bez dalšího vyřadit z transferu embrya s potenciálně falešně negativními vysokými mozaikami. U euploidního pozadí je to složitější, buď je embryo euploidní a kontaminované, nebo skutečně triploidní. V této situaci embryo příslušně označíme oranžově a bez jednoznačného závěru a pacienti mají možnost je transferovat jako nevyšetřené nebo v podobném modu, aby bylo bráno v úvahu 40% riziko triploidie (obr. 1). Popřípadě je možné toto embryo nechat rebioptovat k potvrzení euploidie nebo triploidie. Inkorporace SNP analýzy umožňuje vyšetřovat embrya pocházející ze zygot s abnormálním počtem prvojader.
V rámci této tendence aplikujeme zkušenosti ze SNP array do PGT‑A a využíváme SNP analýzy NGS dat, abychom odhalili abnormálně fertilizované vzorky. V roce 2023 jsme tuto metodu použili prospektivně, kombinovali jsme analýzu počtu kopií se SNP analýzou a následně jsme verifikovali 62 embryí, 7 z nich bylo haploidních, 19 triploidních, 60 % vzorků bylo kontaminováno maternální DNA (tato kontaminace mimikuje triploidní stav). V případě aneuploidního pozadí je takto možno pracovat se dvěma hypotézami, které při ověření vždy končí se závěrem patologie, tedy je možné bez dalšího vyřadit z transferu embrya s potenciálně falešně negativními vysokými mozaikami. U euploidního pozadí je to složitější, buď je embryo euploidní a kontaminované, nebo skutečně triploidní. V této situaci embryo příslušně označíme oranžově a bez jednoznačného závěru a pacienti mají možnost je transferovat jako nevyšetřené nebo v podobném modu, aby bylo bráno v úvahu 40% riziko triploidie (obr. 1). Popřípadě je možné toto embryo nechat rebioptovat k potvrzení euploidie nebo triploidie. Inkorporace SNP analýzy umožňuje vyšetřovat embrya pocházející ze zygot s abnormálním počtem prvojader.
Závěrem
Genetická vyšetření mají své pevné místo v rámci asistované reprodukce. Technologický vývoj nás v současnosti zahlcuje novými možnostmi, někdy je složité vidět cíl a vytyčit si k němu cestu. Správný cíl je ten, který má klinickou hodnotu pro pacienta, nicméně cestu komplikují překotný vývoj, finanční náklady, módní trendy, konkurenční boj a další faktory.
Kompletní zápis z akce EVOLUTION by Merck 2024 najdete na https://www.remedia.cz/specialy/evolution-by-merck/